Facharzt des Artikels
Neue Veröffentlichungen
Goodpasture-Syndrom: Ursachen, Symptome, Diagnose, Behandlung
Zuletzt überprüft: 12.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
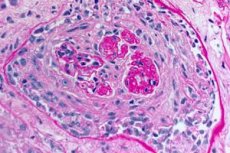
Das Goodpasture-Syndrom ist ein Autoimmunsyndrom, das mit alveolären Lungenblutungen und Glomerulonephritis einhergeht und durch zirkulierende Anti-GBM-Antikörper verursacht wird. Das Goodpasture-Syndrom tritt am häufigsten bei Personen mit einer genetischen Veranlagung auf, die Zigaretten rauchen. Das Einatmen von Kohlenwasserstoffen und virale Atemwegsinfektionen sind jedoch mögliche weitere Faktoren. Zu den Symptomen des Goodpasture-Syndroms gehören Dyspnoe, Husten, Müdigkeit, Hämoptyse und/oder Hämaturie. Ein Goodpasture-Syndrom wird bei Patienten mit Hämoptyse oder Hämaturie vermutet und durch den Nachweis von Anti-GBM-Antikörpern im Blut bestätigt. Die Behandlung des Goodpasture-Syndroms umfasst Plasmaaustausch, Glukokortikoide und Immunsuppressiva wie Cyclophosphamid. Die Prognose ist gut, wenn die Behandlung begonnen wird, bevor sich ein Atem- oder Nierenversagen entwickelt.
Das Goodpasture-Syndrom wurde erstmals 1919 von Goodpasture beschrieben. Es ist eine Kombination aus Glomerulonephritis und Alveolarblutung in Gegenwart von Anti-GBM-Antikörpern. Am häufigsten manifestiert sich das Goodpasture-Syndrom als Kombination aus diffuser Alveolarblutung und Glomerulonephritis, kann aber auch eine isolierte Glomerulonephritis (10–20 %) oder eine Lungenbeteiligung (10 %) verursachen. Männer sind häufiger betroffen als Frauen.
Was verursacht das Goodpasture-Syndrom?
Die Ursache der Erkrankung ist nicht genau geklärt. Es wird eine genetische Prädisposition für das Goodpasture-Syndrom vermutet, dessen Marker das Vorhandensein von HLA-DRW2 ist. Es gibt Überlegungen zur möglichen Rolle einer früheren Virusinfektion (Hepatitis-A-Virus und andere Viruserkrankungen), von Arbeitsunfällen und Medikamenten (vor allem D-Penicillamin).
Grundlage der Pathogenese des Goodpasture-Syndroms ist die Bildung von Autoantikörpern gegen die Basalmembranen der glomerulären Kapillaren der Nieren und Alveolen. Diese Antikörper gehören zur IgG-Klasse und binden in Gegenwart der C3-Komponente des Komplements an die Antikörper der Basalmembranen, woraufhin sich eine Immunentzündung der Nieren und Alveolen entwickelt.
Anti-GBM-Antikörper richten sich gegen die nichtkollagene (NC-1) Domäne der 3-Kette von Kollagen Typ IV, die in den Basalmembranen der Nieren- und Lungenkapillaren am stärksten konzentriert ist. Umwelteinflüsse – Rauchen, virale akute Atemwegsinfektionen und Inhalation von Hydrokarbonat-Suspensionen (häufiger) – und seltener Lungenentzündung aktivieren die Präsentation alveolarkapillärer Antigene gegenüber zirkulierenden Antikörpern bei Menschen mit erblicher Prädisposition (meistens Träger der HLA-DRwl5-, -DR4- und -DRB1-Allele). Zirkulierende Anti-GBM-Antikörper binden an Basalmembranen, fixieren Komplement und induzieren eine zelluläre Entzündungsreaktion, die zur Entwicklung einer Glomerulonephritis und/oder pulmonalen Kapillaritis führt.
Es besteht wahrscheinlich eine gewisse Gemeinsamkeit von Autoantigenen der Basalmembran der glomerulären Kapillaren der Nieren und Alveolen. Das Autoantigen wird unter dem Einfluss der schädigenden Wirkung des ätiologischen Faktors gebildet. Ein unbekannter ätiologischer Faktor schädigt und verändert die Struktur der Basalmembranen der Nieren und der Lunge. Die Ausscheidung der entstehenden Abbauprodukte der glomerulären Basalmembranen der Nieren verlangsamt und verringert sich, wenn diese geschädigt sind, was natürlich die Voraussetzungen für die Entwicklung von Autoimmunschäden an Nieren und Lunge schafft. Es ist noch nicht vollständig geklärt, welcher Bestandteil der Basalmembran zum Autoantigen wird. Derzeit wird angenommen, dass dies der innere Strukturbestandteil der glomerulären Basalmembran der Niere ist, die a3-Kette von Kollagen Typ 4.
Die gebildeten Immunkomplexe lagern sich entlang der Basalmembranen der glomerulären Kapillaren ab, was zur Entwicklung eines immunen Entzündungsprozesses im Nierenglomerulus (Glomerulonephritis) und in den Alveolen (Alveolitis) führt. Die wichtigsten an der Entstehung dieser Immunentzündung beteiligten Zellen sind T-Lymphozyten, Monozyten, Endotheliozyten, polymorphkernige Leukozyten und Alveolarmakrophagen. Die Interaktion zwischen ihnen wird durch molekulare Mediatoren und Zytokine (Wachstumsfaktoren – Thrombozyten, insulinähnlich, b-transformierend; Interleukin-1, Tumornekrosefaktor usw.) gewährleistet. Arachidonsäuremetaboliten, freie Sauerstoffradikale, proteolytische Enzyme und Adhäsionsmoleküle spielen eine wichtige Rolle bei der Entstehung von Immunentzündungen.
Die Aktivierung von Alveolarmakrophagen ist von großer Bedeutung für die Entstehung einer Alveolitis beim Goodpasture-Syndrom. Im aktivierten Zustand sezernieren sie etwa 40 Zytokine. Zytokine der Gruppe I (Chemotaxine, Leukotriene, Interleukin-8) fördern den Zustrom polymorphkerniger Leukozyten in die Lunge. Zytokine der Gruppe II (Wachstumsfaktoren – Thrombozyten, Makrophagen) fördern die Bewegung von Fibroblasten in die Lunge. Alveolarmakrophagen produzieren zudem aktive Sauerstoffformen, Proteasen, die das Lungengewebe schädigen.
Pathomorphologie des Goodpasture-Syndroms
Die wichtigsten pathomorphologischen Manifestationen des Goodpasture-Syndroms sind:
- vorherrschende Schädigung des Mikrozirkulationsbetts von Nieren und Lunge. In der Lunge zeigt sich ein Bild von Venulitis, Arteriolitis, Kapillaritis mit ausgeprägten Zerstörungs- und Proliferationsphänomenen; Schädigungen der Kapillaren werden hauptsächlich in den interalveolären Septen beobachtet, es entwickelt sich eine Alveolitis mit hämorrhagischem Exsudat in den Alveolen. Nierenschäden sind durch die Entwicklung einer extrakapillären proliferativen Glomerulonephritis mit anschließender Bildung von Hyalinose und Fibrose gekennzeichnet, die zur Entwicklung eines Nierenversagens führt;
- ausgeprägte intraalveoläre Blutungen;
- Entwicklung einer pulmonalen Hämosiderose und Pneumosklerose unterschiedlichen Schweregrades als Folge der Entwicklung einer Alveolitis.
Symptome des Goodpasture-Syndroms
Die Erkrankung manifestiert sich am häufigsten klinisch mit pulmonalen Pathologien. Hämoptyse ist das auffälligste Symptom; bei hämorrhagischen Manifestationen kann Hämoptyse jedoch fehlen, und der Patient kann lediglich infiltrative Veränderungen im Röntgenthorax oder ein Infiltrat sowie Atemnot und/oder Atemversagen aufweisen. Dyspnoe (vor allem bei Anstrengung), Husten, Unwohlsein, eingeschränkte Arbeitsfähigkeit, Brustschmerzen, Fieber und Gewichtsverlust sind häufig. Bis zu 40 % der Patienten weisen eine Makrohämaturie auf, wobei Lungenblutungen den renalen Manifestationen um Wochen bis Jahre vorausgehen können.
Bei einer Hämoptyse kann die Kurzatmigkeit zunehmen. Schwäche und verminderte Arbeitsfähigkeit können ebenfalls auftreten.
Die Symptome des Goodpasture-Syndroms variieren im Laufe der Zeit und reichen von klaren Lungen bei der Auskultation bis hin zu knisternden und trockenen Rasselgeräuschen. Einige Patienten haben periphere Ödeme und Blässe aufgrund einer Anämie.
Bei der Untersuchung fällt auf blasse Haut, Zyanose der Schleimhäute, pastöse oder ausgeprägte Schwellung des Gesichts, verminderte Muskelkraft und Gewichtsverlust. Die Körpertemperatur ist meist bis auf Fieber erhöht.
Bei der Perkussion der Lunge kann über ausgedehnten Lungenblutungsherden eine Verkürzung des Perkussionsgeräusches festgestellt werden, dies wird jedoch selten beobachtet; häufiger kommt es zu keiner Veränderung des Perkussionsgeräusches.
Ein charakteristisches auskultatorisches Zeichen des Goodpasture-Syndroms ist trockenes und feuchtes Keuchen, dessen Anzahl während oder nach der Hämoptyse deutlich zunimmt.
Bei der Untersuchung des Herz-Kreislauf-Systems zeigt sich eine arterielle Hypertonie, möglicherweise eine Erhöhung der Grenze der relativen Herzschwäche nach links, gedämpfte Herztöne, ein leises systolisches Geräusch und ein Perikardreibungsgeräusch mit der Entwicklung eines schweren Nierenversagens. Bei fortschreitender Nierenschädigung vor dem Hintergrund einer signifikanten arteriellen Hypertonie kann sich eine akute Linksherzinsuffizienz mit dem Bild von Herzasthma und Lungenödem entwickeln. Normalerweise entwickelt sich diese Situation im Endstadium der Krankheit.
Nierenschäden manifestieren sich in der Regel erst nach einer gewissen Zeit nach Auftreten der Lungensymptome. Charakteristische klinische Anzeichen einer Nierenerkrankung sind Hämaturie (manchmal Makrohämaturie), schnell fortschreitendes Nierenversagen, Oligurie und arterielle Hypertonie.
In 10–15 % der Fälle beginnt das Goodpasture-Syndrom mit klinischen Anzeichen einer Nierenerkrankung – es tritt das klinische Bild einer Glomerulonephritis auf (Oligurie, Ödeme, arterielle Hypertonie, ausgeprägte Blässe), und dann kommen Symptome einer Lungenschädigung hinzu. Viele Patienten können an Myalgie und Arthralgie leiden.
Unabhängig von den Ausbruchsvarianten verläuft das Goodpasture-Syndrom in den meisten Fällen schwer, die Krankheit schreitet stetig voran, es entwickelt sich ein schweres Lungen- und Nierenversagen. Die Lebenserwartung der Patienten beträgt ab Krankheitsbeginn mehrere Monate bis 1–3 Jahre. Am häufigsten sterben Patienten an Urämie oder Lungenblutung.
Was bedrückt dich?
Diagnose des Goodpasture-Syndroms
Die Diagnose des Goodpasture-Syndroms erfordert den Nachweis von Serum-Anti-GBM-Antikörpern mittels indirekter Immunfluoreszenz oder, sofern verfügbar, mittels direktem Enzymimmunoassay (ELISA) mit rekombinantem humanem NC-1 a3. Weitere serologische Tests, wie z. B. der Test auf antinukleäre Antikörper (ANA), werden zum Nachweis von SLE und der Antistreptolysin-O-Titer zum Nachweis einer poststreptokokkalen Glomerulonephritis eingesetzt, die die Ursache vieler Fälle des pulmorenalen Syndroms sein kann. ANCA ist (in peripheren Proben) in 25 % der Fälle des Goodpasture-Syndroms positiv. Eine Nierenbiopsie kann bei Vorliegen einer Glomerulonephritis (Hämaturie, Proteinurie, Erythrozyten-Sludge im Urin und/oder Nierenversagen) angezeigt sein. Beim Goodpasture-Syndrom und allen anderen Ursachen des pulmorenalen Syndroms findet sich in der Biopsie eine rasch fortschreitende fokal-segmentale nekrotisierende Glomerulonephritis mit progressivem Verlauf. Die Immunfluoreszenzfärbung von Nieren- oder Lungengewebe zeigt üblicherweise lineare IgG-Ablagerungen entlang der glomerulären oder alveolären Kapillaren. Diese Ablagerungen treten auch bei diabetischer Niere und fibrillärer Glomerulonephritis auf, einer seltenen Erkrankung, die ein pulmorenales Syndrom verursacht. Der Nachweis von GBM-Antikörpern ist bei diesen Erkrankungen jedoch unspezifisch.
Lungenfunktionstests und bronchoalveoläre Lavage sind nicht diagnostisch für das Goodpasture-Syndrom, können aber zur Bestätigung einer diffusen alveolären Hämorrhagie bei Patienten mit Glomerulonephritis und Lungeninfiltraten, jedoch ohne Hämoptyse, eingesetzt werden. Bleibt die Lavageflüssigkeit auch nach mehrmaligem Spülen hämorrhagisch, kann dies ein Hinweis auf ein diffuses hämorrhagisches Syndrom sein, insbesondere bei gleichzeitigem Abfall des Hämatokrits.
 [ 3 ]
[ 3 ]
Labordiagnostik des Goodpasture-Syndroms
- Allgemeine Blutanalyse. Charakteristische Merkmale sind hypochrome Eisenmangelanämie, Hypochromie, Anisozytose und Poikilozytose der Erythrozyten. Leukozytose, Linksverschiebung der Leukozytenformel und ein signifikanter Anstieg der BSG werden ebenfalls beobachtet.
- Allgemeine Urinanalyse. Im Urin finden sich Proteine (der Grad der Proteinurie kann signifikant sein), Zylinder (granulär, hyalin, Erythrozyten), Erythrozyten (Makrohämaturie kann auftreten). Mit fortschreitender chronischer Niereninsuffizienz nimmt die relative Dichte des Urins ab und es entwickelt sich im Zimnitsky-Test eine Isohyposthenurie.
- Biochemischer Bluttest. Erhöhte Blutwerte von Harnstoff, Kreatinin, Haptoglobin, Seromucoid, a2 und Gammaglobulinen, verringerter Eisengehalt.
- Immunologische Untersuchungen. Eine Abnahme der Anzahl von T-Lymphozytensuppressoren kann nachgewiesen werden, zirkulierende Immunkomplexe werden nachgewiesen. Antikörper gegen die Basalmembran der glomerulären und alveolären Kapillaren werden mittels indirekter Immunfluoreszenz oder radioimmunologischer Methoden nachgewiesen.
- Sputumanalyse. Im Sputum werden viele Erythrozyten, Hämosiderin und Siderophagen nachgewiesen.
Instrumentelle Diagnostik des Goodpasture-Syndroms
- Röntgenuntersuchung der Lunge. Charakteristische Röntgenzeichen sind Lungeninfiltrate im Wurzelbereich mit Ausbreitung in die unteren und mittleren Lungenabschnitte sowie progressive, symmetrische, beidseitige, wolkenartige Infiltrate.
- Untersuchung der Funktion der äußeren Atmung. Die Spirometrie zeigt eine restriktive Form der Ateminsuffizienz (verminderte Vitalkapazität), im weiteren Krankheitsverlauf kommt eine obstruktive Form der Ateminsuffizienz hinzu (verminderter FEV1, Tiffeneau-Index).
- EKG. Es zeigen sich Anzeichen einer schweren Myokarddystrophie anämischer und hypoxischer Genese (Verringerung der Amplitude der T-Wellen und des ST-Intervalls in vielen Ableitungen, am häufigsten in den linken Brustableitungen). Bei schwerer arterieller Hypertonie treten Anzeichen einer linksventrikulären Myokardhypertrophie auf.
- Die Blutgasanalyse zeigt eine arterielle Hypoxämie.
- Untersuchung von Lungen- und Nierenbiopsien. Eine Biopsie des Lungengewebes (offene Biopsie) und der Nieren wird zur endgültigen Diagnosesicherung durchgeführt, wenn eine genaue Diagnose der Erkrankung mit nicht-invasiven Methoden nicht möglich ist. Die Biopsien werden histologisch und immunologisch untersucht. Folgende Symptome sind charakteristisch für das Goodpasture-Syndrom:
- das Vorhandensein morphologischer Anzeichen einer Glomerulonephritis (meistens extrakapillär), hämorrhagischer Alveolitis, Hämosiderose und interstitieller Fibrose;
- Nachweis linearer Ablagerungen von IgG und Komplementkomponente C3 auf den Basalmembranen der Lungenbläschen und Nierenglomeruli mittels Immunfluoreszenzmethode.
Diagnosekriterien für das Goodpasture-Syndrom
Bei der Diagnose des Goodpasture-Syndroms ist es ratsam, die folgenden Kriterien zu verwenden.
- Eine Kombination aus Lungen- und Nierenerkrankungen, d. h. Hämoptyse (häufig Lungenblutung), Kurzatmigkeit und Symptome einer Glomerulonephritis.
- Stetig fortschreitender Krankheitsverlauf mit Entwicklung von Atem- und Nierenversagen.
- Entwicklung einer Eisenmangelanämie.
- Erkennung mehrerer bilateraler wolkenartiger Infiltrate bei der Röntgenuntersuchung der Lunge vor dem Hintergrund einer retikulären Deformation des Lungenmusters.
- Nachweis hoher Titer zirkulierender Antikörper gegen die Basalmembran der Nierenglomeruli und Alveolen im Blut.
- Nachweis linearer Ablagerungen von IgG und Komplementkomponente C3 auf den Basalmembranen glomerulärer und alveolärer Kapillaren.
- Fehlen anderer systemischer Manifestationen (außer Lungen- und Nierensymptome).
Differentialdiagnose des Goodpasture-Syndroms
Das Goodpasture-Syndrom muss von einer Reihe von Erkrankungen unterschieden werden, die sich durch Hämoptyse oder Lungenblutungen manifestieren. Es ist notwendig, onkologische Erkrankungen der Bronchien und der Lunge, Tuberkulose, Lungenabszesse, Bronchiektasien, Herz- und Gefäßerkrankungen (die zu Stauung und Bluthochdruck im Lungenkreislauf führen), systemische Vaskulitis und hämorrhagische Diathese auszuschließen.
Goodpasture-Syndrom-Screening-Programm
- Allgemeine Blut- und Urintests.
- Biochemische Blutuntersuchung: Bestimmung von Gesamtprotein und Proteinfraktionen, Kreatinin und Harnstoff, Transaminasen, Seromucoid, Haptoglobin, Fibrin, Eisen.
- Sputumanalyse: zytologische Untersuchung, Bestimmung von Siderophagen.
- Immunologische Untersuchungen: Bestimmung des Gehalts an B- und T-Lymphozyten, Subpopulationen von T-Lymphozyten, Immunglobulinen, zirkulierenden Immunkomplexen, Antikörpern gegen die Basalmembranen der Glomeruli der Nieren und Alveolen.
- Röntgenuntersuchung der Lunge.
- EKG.
- Spirometrie.
- Untersuchung von Lungen- und Nierenbiopsien.
Welche Tests werden benötigt?
Behandlung des Goodpasture-Syndroms
Die Behandlung des Goodpasture-Syndroms umfasst einen täglichen oder zweitägigen Plasmaaustausch über 2–3 Wochen (4 l Plasmaaustausch) zur Entfernung von Anti-GBM-Antikörpern. In Kombination mit intravenösen Glukokortikoiden (in der Regel Methylprednisolon 1 g über mindestens 20 Minuten jeden zweiten Tag, dreimal täglich, zusammen mit Prednisolon 1 mg/kg Körpergewicht täglich) und Cyclophosphamid (2 mg/kg einmal täglich) über 6–12 Monate, um die Bildung neuer Antikörper zu verhindern. Die Therapie kann ausgeschlichen werden, wenn sich Lungen- und Nierenfunktion nicht mehr verbessern. Die Langzeitmortalität hängt vom Grad der Nierenfunktionsstörung zu Krankheitsbeginn ab. Patienten, die frühzeitig eine Dialyse benötigen, und Patienten mit mehr als 50 % halbmondförmigen Nephronen in der Biopsie haben eine Überlebenszeit von weniger als 2 Jahren und benötigen oft eine Dialyse, sofern nicht eine Nierentransplantation in Betracht gezogen wird. Hämoptyse kann ein gutes prognostisches Zeichen sein, da sie zu einer früheren Diagnose der Krankheit führt. Die Minderheit der ANCA-positiven Patienten spricht besser auf die Behandlung des Goodpasture-Syndroms an. Ein Rückfall tritt in einem geringen Prozentsatz der Fälle auf und ist auf fortgesetztes Rauchen und Infektionen der Atemwege zurückzuführen. Bei Patienten mit terminaler Niereninsuffizienz, die eine Nierentransplantation hatten, kann die Erkrankung im Transplantat erneut auftreten.
Wie ist die Prognose beim Goodpasture-Syndrom?
Das Goodpasture-Syndrom schreitet häufig rasch fort und kann tödlich verlaufen, wenn es nicht umgehend diagnostiziert und behandelt wird. Die Prognose ist gut, wenn mit der Behandlung begonnen wird, bevor es zu Atem- oder Nierenversagen kommt.
Das unmittelbare Überleben zum Zeitpunkt einer Lungenblutung und eines Atemversagens hängt mit der Sicherstellung der Durchgängigkeit der Atemwege zusammen. Bei Patienten mit grenzwertigen arteriellen Blutgaswerten und drohendem Atemversagen werden eine endotracheale Intubation und eine mechanische Beatmung empfohlen.

