Facharzt des Artikels
Neue Veröffentlichungen
Goodpasture-Syndrom: Ursachen, Symptome, Diagnose, Behandlung
Zuletzt überprüft: 23.04.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
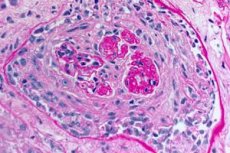
Das Goodpasture-Syndrom ist ein Autoimmun-Syndrom, das alveoläre Lungenblutungen und Glomerulonephritis durch zirkulierende Anti-GBM-Antikörper umfasst. Das Goodpasture-Syndrom entwickelt sich am häufigsten bei Personen mit erblicher Veranlagung, die Zigaretten rauchen, aber mögliche zusätzliche Faktoren sind die Inhalation von Kohlenwasserstoff- und Virusinfektionen der Atemwege. Symptome des Goodpasture-Syndroms sind Kurzatmigkeit, Husten, Müdigkeit, Bluthusten und / oder Hämaturie. Das Goodpasture-Syndrom wird bei Patienten mit Hämoptyse oder Hämaturie vermutet und wird durch das Vorhandensein von Anti-GVM-Antikörpern im Blut bestätigt. Behandlung Goodpacers-Syndrom umfasst Plasmapherese, Glucocorticoide und Immunsuppressiva wie Cyclophosphamid. Die Prognose ist günstig, wenn die Behandlung vor der Entwicklung einer respiratorischen oder renalen Insuffizienz begonnen wird.
Das Goodpasture-Syndrom wurde erstmals 1919 von Goodpasther beschrieben. Das Goodpasture-Syndrom ist eine Kombination aus Glomerulonephritis und Alveolenblutung in Gegenwart von Anti-GVM-Antikörpern. Das Goodpasture-Syndrom manifestiert sich am häufigsten durch eine Kombination von diffuser alveolärer Blutung und Glomerulonephritis, verursacht aber manchmal eine isolierte Glomerulonephritis (10-20%) oder eine Lungenschädigung (10%). Männer sind häufiger krank als Frauen.
Was verursacht das Goodpasture-Syndrom?
Die Ursache der Krankheit ist nicht genau festgestellt. Die genetische Veranlagung zum Goodpasture-Syndrom wird vermutet, sein Marker gilt als HLA-DRW2. Es gibt einen Standpunkt über die mögliche Rolle der übertragenen Virusinfektion (Hepatitis-A-Virus und andere Viruserkrankungen), Produktionsgefahren, Drogen (insbesondere D-Penicillamin).
Die Grundlage der Pathogenese des Goodpasture-Syndroms ist die Bildung von Autoantikörpern gegen die Basalmembranen der Kapillaren der Glomeruli der Nieren und Alveolen. Diese Antikörper gehören zur IgG-Klasse, sie binden an die Antikörper der Basalmembranen in Gegenwart der Komplement-C3-Komponente, gefolgt von der Entwicklung einer Immunentzündung der Nieren und Lungenalveolen.
Anti-GVM-Antikörper, die gegen die nicht-kollagenen (NC-1) Bereich oS Ketten von Kollagen Typ IV, die die höchste Konzentration ist, ist in der Basalmembran von Erkrankungen der Nieren und Lungenkapillaren. Die Exposition gegenüber Umweltfaktoren - Rauchen, virale ARI und Inhalation Bicarbonat-Slurries (häufiger) - und, weniger häufig, aktiviert Pneumonie alveolar Präsentation Antigene Kapillaren Antikörper bei Patienten mit einer erblichen Veranlagung (meist Träger HLA-DRwl5, zirkulierende - DR4 und - DRB1 Allele ). Zirkulierender anti-GVM-Antikörper an die Basalmembran binden, Komplement fixiert und induzieren zelluläre Entzündungsreaktion, was zu der Entwicklung von Glomerulonephritis und / oder pulmonaler kapillyarita.
Wahrscheinlich gibt es eine bestimmte Allgemeinheit der Autoantigene der Basalmembran der Kapillaren der Glomeruli der Nieren und Alveolen. Das Autoantigen wird unter dem Einfluss der schädigenden Wirkung des ätiologischen Faktors gebildet. Ein unbekannter ätiologischer Faktor schädigt und modifiziert die Struktur der Basalmembranen von Niere und Lunge. Die Ausscheidung von Abbauprodukten Basalmembranen Niere Glomeruli in ihrer Niederlage gebildet verlangsamt und verringert, was natürlich eine Voraussetzung für die Entwicklung einer Autoimmun Zerstörung der Nieren und die Lunge noch völlig unbekannt ist, welche Komponente der Basalmembran auto-Antigen wird. Gegenwärtig wird angenommen, dass dies eine interne strukturelle Komponente der Basalmembran des Glomerulus der Nieren-a3-Kette von Typ-4-Kollagen ist.
Die gebildeten Immunkomplexe lagern sich entlang der basalen Membranen der glomerulären Kapillaren ab, was zur Entwicklung eines immuninflammatorischen Prozesses im Nierenglomerulus (Glomerulonephritis) und Alveolen (Alveolitis) führt. Die Hauptzellen, die an der Entwicklung dieser Immunentzündung beteiligt sind, sind T-Lymphozyten, Monozyten, Endothelozyten, polymorphkernige Leukozyten, Alveolarmakrophagen. Die Wechselwirkung zwischen ihnen wird durch molekulare Mediatoren, Zytokine (Wachstumsfaktoren - Thrombozyten, Insulin-like, b-transforming, Interleukin-1, Tumor-Nekrose-Faktor, etc.) zur Verfügung gestellt. Eine wichtige Rolle in der Entwicklung der Immunentzündung spielen die Metaboliten der Arachidonsäure, freie Sauerstoffradikale, proteolytische Enzyme, Adhäsionsmoleküle.
Bei der Entstehung der Alveolitis beim Goodpasture-Syndrom ist die Aktivierung von Alveolarmakrophagen von großer Bedeutung. Im aktivierten Zustand setzen sie etwa 40 Zytokine frei. Zytokine der Gruppe I (Chemotaxine, Leukotriene, Interleukin-8) erhöhen den Fluss von polymorphkernigen Leukozyten in die Lunge. Zytokine der Gruppe II (Wachstumsfaktoren - Thrombozyten, Makrophagen) fördern die Bewegung von Fibroblasten in die Lunge. Alveolare Makrophagen produzieren auch aktive Formen von Sauerstoff, Proteasen, die das Lungengewebe schädigen.
Pathomorphologie des Goodpasture-Syndroms
Die wichtigsten pathomorphologischen Manifestationen des Goodpasture-Syndroms sind:
- die primäre Läsion des Mikrozirkulationsbettes der Nieren und Lungen. In den Lungen gibt es ein Bild von Venolen, Arterioliten, Kapillaritis mit deutlicher Zerstörung und Proliferation; Die Infektion der Kapillaren wird hauptsächlich in den interalveolaren Septen beobachtet, die Alveolitis mit hämorrhagischem Exsudat entwickelt sich in den Alveolen. Nierenschäden sind gekennzeichnet durch die Entwicklung einer extrakapillaren proliferativen Glomerulonephritis, gefolgt von der Bildung von Hyalinose und Fibrose, was zur Entwicklung von Nierenversagen führt;
- schwere intraalveoläre Blutung;
- Entwicklung von Hämosiderose der Lunge und Pneumosklerose unterschiedlicher Schwere, als Folge der Entwicklung der Alveolitis.
Symptome des Goodpasture-Syndroms
Die Erkrankung beginnt meistens mit den klinischen Erscheinungsformen der Lungenpathologie. Hämoptyse ist das prominenteste Symptom; hemoptysis kann aber in Gegenwart von hämorrhagischen Manifestationen abwesend sein, und der Patient kann nur infiltrative Veränderungen in der Brust-Röntgen oder infiltriert und respiratory distress syndrome und / oder Fehler erkannt werden. Häufig entwickelt sich Dyspnoe (hauptsächlich mit körperlicher Aktivität), Husten, Unwohlsein, Behinderung, Brustschmerzen, Fieber und Gewichtsverlust. Bis zu 40% der Patienten haben eine Makrohämaturie, obwohl eine Lungenblutung den Nierenmanifestationen über Wochen und Jahre vorausgehen kann.
Dyspnoe kann während der Hämoptyse zunehmen. Sorgen sind auch Schwäche, Behinderung.
Die Symptome des Goodpasture-Syndroms variieren über einen langen Zeitraum von reinen Lungen über Auskultation bis hin zu Knistern und trockenem Keuchen. Einige Patienten leiden an peripheren Ödemen und Blässe aufgrund von Anämie.
Bei der Untersuchung wird auf die Blässe der Haut, Zyanose der Schleimhäute, Verfall oder ausgeprägte Ödeme des Gesichts, Verminderung der Muskelkraft, Verlust des Körpergewichts hingewiesen. Die Körpertemperatur wird in der Regel auf fieberhafte Stellen erhöht.
Bei der Perkussion der Lunge kann eine Verkürzung des Perkussionssounds über die großen Herde der Lungenblutung festgestellt werden, aber dies ist selten, es gibt normalerweise keine Veränderung im Perkussionssound.
Ein charakteristisches auskultivierendes Zeichen des Goodpasture-Syndroms ist trockenes und feuchtes Keuchen, dessen Anzahl während oder nach Hämoptyse signifikant ansteigt.
In der Studie des kardiovaskulären Systems erkannt Hypertonie nach links den Grenzen der relativen Dumpfheit des Herzens erhöhen, gedämpft Herzton, ein weiches systolisches Geräusch, mit der Entwicklung von schwerer Niereninsuffizienz erscheint pericardial Reibung. Mit progressiven Nierenschäden vor dem Hintergrund einer signifikanten arteriellen Hypertonie ist es möglich, ein akutes linksventrikuläres Versagen mit einem Bild von Herzasthma und Lungenödem zu entwickeln. Normalerweise entwickelt sich diese Situation im Endstadium der Krankheit.
In der Regel manifestiert sich eine Nierenschädigung später, nach einer gewissen Zeit nach der Entwicklung von Lungensymptomen. Charakteristische klinische Zeichen der Nierenpathologie sind Hämaturie (manchmal Makrohämaturie), rasch fortschreitendes Nierenversagen, Oligoanurie, arterielle Hypertonie.
In 10-15% der Fälle beginnt Goodpasture-Syndrom mit klinischen Anzeichen einer Nierenpathologie - dort Klinik Glomerulonephritis (Oligurie, Ödeme, Bluthochdruck, markiert Blässe) und dann Lungenläsion Symptome verbunden. Viele Patienten können Myalgie, Arthralgie haben.
Unabhängig von den Möglichkeiten ist das Goodpasture-Syndrom in den meisten Fällen schwierig, die Krankheit schreitet stetig voran, es entwickelt sich ein schweres Lungen- und Nierenversagen. Die Lebenserwartung der Patienten von Beginn der Krankheit reicht von mehreren Monaten bis zu 1-3 Jahren. Meistens sterben Patienten an einer Urämie oder einer Lungenblutung.
Was bedrückt dich?
Diagnose des Goodpasture Syndroms
Die Diagnose erfordert Identifizierung von Goodpasture-Syndrom Serum anti-GVM-Antikörper durch indirekte Immunofluoreszenz oder, falls vorhanden, durch direkte enzyme-linked immunosorbent assay (ELISA) mit rekombinantem humanen NC-1 aS. Andere serologische Tests wie der Test für antinukleäre Antikörper (ANA), werden verwendet , um SLE titre antistreptolisin-O zu erkennen - post-Streptokokken Glomerulonephritis zu identifizieren, die die Ursache von vielen Fällen von Lungen-renaler Syndrom können. ANCA sind in 25% der Fälle des Goodpasture-Syndroms positiv (in peripheren Mustern). In Gegenwart von Glomerulonephritis (Hämaturie, Proteinurie, Schlämmen Erythrozyten im Assay von Urin und / oder Nierenversagen) , Nierenbiopsie kann zugeordnet werden. Rapid progressive Glomerulonephritis fokale segmentaler nekrotisierende mit progressiver durch Biopsie in Goodpasture-Syndrom und alle anderen Ursachen für pulmonales-renales Syndrom festgestellt. Immunfluoreszenzfärbung von Nieren- oder Lungengewebe zeigt klassischerweise eine lineare Ablagerung von IgG entlang glomerulären oder alveolären Kapillaren. Es kommt auch in diabetischen Nieren und fibrilläre Glomerulonephritis - eine seltene Erkrankung verursacht Lungen-Nieren-Syndrom, aber Antikörpern bei diesen Erkrankungen GBM-Fixierung ist unspezifisch.
Lungenfunktionstests und Bronchiallavage sind nicht Diagnose von Goodpasture-Syndrom, können aber verwendet werden, um die Anwesenheit von diffusen alveolären Blutungen bei Patienten mit Glomerulonephritis und Lungeninfiltrate zu bestätigen, aber ohne hemoptysis. Spülungsflüssigkeit, die nach wiederholten Waschungen hämorrhagischen bleibt ermöglicht diffuses hämorrhagisches Syndrom bestätigt, vor allem mit der damit einhergehenden Verringerung des Hämatokrits.
 [3],
[3],
Labordiagnose des Goodpasture Syndroms
- Allgemeiner Bluttest. Charakteristischer Eisenmangel hypochrome Anämie, Hypochromie, Anisozytose, Poikilozytose von Erythrozyten. Es gibt auch eine Leukozytose, eine Verschiebung der Leukozytenformel nach links, eine signifikante Erhöhung der ESR.
- Allgemeine Analyse von Urin. Im Urin wird ein Protein nachgewiesen (der Grad der Proteinurie kann signifikant sein), Zylinder (körnig, hyalin, Erythrozyten), Erythrozyten (kann Makrohämaturie sein). Da das Fortschreiten der langdauernden renalen Mangelhaftigkeit, die relative Dichte des Urins abnimmt, entwickelt sich in der Probe Zimnitskij die Isohyposterurie.
- Biochemischer Bluttest. Es gibt einen Anstieg des Harnstoff-, Kreatinin-, Haptoglobin-, Seromucoid-, a2- und Gammaglobulinspiegels im Blut , eine Abnahme des Eisengehalts.
- Immunologische Forschung. Es kann eine Abnahme der Anzahl der T-Lymphozyten-Suppressoren geben, wobei zirkulierende Immunkomplexe aufgedeckt werden . Antikörper gegen die Basalmembran der Kapillaren der Glomeruli und Alveolen werden durch indirekte Immunfluoreszenz oder durch Radioimmunoassay nachgewiesen.
- Sputum-Analyse. Es gibt viele rote Blutkörperchen im Sputum, Hämosiderin, Siderophagen werden gefunden.
Instrumentelle Diagnose des Goodpasture Syndroms
- Röntgenuntersuchung der Lunge. Charakteristische radiologische Merkmale sind pulmonale Infiltrate im basalen Bereich mit Ausbreitung auf den unteren und mittleren Lungenabschnitt sowie progressive, symmetrische bilaterale wolkenartige Infiltrate.
- Untersuchung der Funktion der äußeren Atmung. Die Spirographie zeigt einen restriktiven Typ von respiratorischem Versagen (eine Abnahme der GEL), im Verlauf der Erkrankung wird ein obstruktiver Typ von respiratorischem Versagen (Reduktion von FEV1, Tiffno-Index) hinzugefügt.
- EKG. Es gibt Anzeichen einer ausgeprägten Myokarddystrophie der anämischen und hypoxischen Genese (Abnahme der Amplitude der T-Welle und des ST-Intervalls in vielen Ableitungen, häufiger im linken Thorax). Bei schwerer arterieller Hypertonie gibt es Anzeichen einer Myokardhypertrophie des linken Ventrikels.
- Untersuchung der Gaszusammensetzung von Blut. Arterielle Hypoxämie wird aufgedeckt.
- Untersuchung von Lungen- und Nierenbiopsien. Eine Biopsie des Lungengewebes (offene Biopsie) und der Nieren wird für die endgültige Überprüfung der Diagnose durchgeführt, wenn es unmöglich ist, die Krankheit mit nicht-invasiven Methoden genau zu diagnostizieren. Die histologische und immunologische Untersuchung von Biopsien wird durchgeführt. Typisch für das Goodpasture-Syndrom sind die folgenden Symptome:
- Vorhandensein von morphologischen Zeichen der Glomerulonephritis (am häufigsten extrakapillär), hämorrhagische Alveolitis, Hämosiderose und interstitielle Fibrose;
- Nachweis mittels Immunofluoreszenz-Verfahren der linearen Ablagerung von IgG- und C3-Komplement-Komponenten auf Basalmembranen von Lungenalveolen und Nierenglomeruli.
Diagnostische Kriterien für das Goodpasture-Syndrom
Bei der Diagnose des Goodpasture-Syndroms empfiehlt es sich, die folgenden Kriterien zu verwenden.
- Die Kombination von Lungenpathologie und Nierenpathologie, d.h. Bluthusten (oft Lungenblutung), Dyspnoe und Symptome der Glomerulonephritis.
- Ein stetig fortschreitender Krankheitsverlauf mit der Entwicklung von respiratorischem und renalem Versagen.
- Entwicklung von Eisenmangelanämie.
- Identifizierung mehrerer bilateraler wolkenartiger Infiltrate bei der Röntgenuntersuchung der Lunge vor dem Hintergrund einer Netzwerkdeformation des Lungenmusters.
- Nachweis von hohen Titern zirkulierender Antikörper gegen die Basalmembran von Nierenglomeruli und Alveolen im Blut.
- Nachweis von linearen Ablagerungen der IgG- und C3-Komplementkomponenten auf den Basalmembranen der glomerulären Kapillaren und Alveolen.
- Fehlen anderer systemischer (außer pulmonaler und renaler) Manifestationen.
Differenzialdiagnose des Goodpasture-Syndroms
Das Goodpasture-Syndrom muss mit einer Reihe von Erkrankungen differenziert werden, die sich durch Bluthusten oder Lungenblutungen manifestieren. Es ist notwendig, um Krebs der Bronchien und die Lunge, Tuberkulose, Lungenabszess, Bronchiektasen, Herzkrankheiten und Blutgefäße (führen zu Stillstand und Hypertonie in einem kleinen Kreis), systemische Vaskulitis, hämorrhagische Diathese auszuschließen.
Das Inspektionsprogramm beim Goodpasture-Syndrom
- Gemeinsame Bluttests, Urintests.
- Biochemischer Bluttest: Bestimmung des Gehalts an Gesamtprotein und Proteinfraktionen, Kreatinin und Harnstoff, Transaminasen, Seromucoid, Haptoglobin, Fibrin, Eisen.
- Sputumanalyse: Zytologische Untersuchung, Definition von Siderophagen.
- Immunologische Untersuchungen: Bestimmung von B- und T-Lymphozyten-Subpopulationen von T-Lymphozyten, Immunglobuline, zirkulierende Immunkomplexe, Antikörper Basalmembran und alveolären Knospen zur glomerulären.
- Röntgenuntersuchung der Lunge.
- EKG.
- Spirographie.
- Untersuchung von Lungen- und Nierenbiopsien.
Was muss untersucht werden?
Welche Tests werden benötigt?
Behandlung des Goodpasture Syndroms
Die Behandlung Goodpasture-Syndrom sind täglich oder jeden zweiten Tag Plasmapherese statt für 2-3 Wochen (plazmozameschenie 4 L) zu aHTH-GBM-Antikörper in Kombination mit intravenöser Gabe von Glukokortikoiden (Methylprednisolon in der Regel 1 g für mindestens 20 Minuten pro Tag dreimal entfernen mit Prednison 1 mg / kg Körpergewicht pro Tag) und Cyclophosphamid (2 mg / kg 1 Mal pro Tag) für 6 bis 12 Monate, um die Bildung neuer Antikörper zu verhindern. Die Therapie kann reduziert werden, wenn die Verbesserung der Lungen- und Nierenfunktion aufhört. Langzeitmortalität ist mit dem Grad der Nierenfunktionsstörung zu Beginn der Krankheit verbunden; Patienten am Anfang, als auch diejenigen, die Dialyse, die mit Sicheln auf Biopsie mehr als 50% der Nephronen hatten, haben von weniger als 2 Jahren eine Überlebensrate und oft Dialyse benötigen, wenn Nierentransplantation gelassen. Hämoptyse kann ein gutes prognostisches Zeichen sein, weil es zu einem früheren Nachweis der Krankheit führt; Eine Minderheit der Patienten, die ANCA-positiv sind, reagieren besser auf die Behandlung des Goodpasture-Syndroms. Rückfall tritt in einem kleinen Prozentsatz der Fälle auf und ist mit der Fortsetzung des Rauchens und der Infektion der Atemwege verbunden. Bei Patienten mit terminaler Niereninsuffizienz, die sich einer Nierentransplantation unterzogen haben, kann die Krankheit bei der Transplantation wieder auftreten.
Was ist das Goodpasture-Syndrom?
Das Goodpasture-Syndrom verläuft häufig schnell und kann tödlich sein, wenn eine schnelle Diagnose und Behandlung des Goodpasture-Syndroms nicht durchgeführt wird; die Prognose ist günstig, wenn die Behandlung vor der Entwicklung von respiratorischem oder Nierenversagen beginnt.
Ein sofortiges Überleben zum Zeitpunkt der Lungenblutung und des Atemversagens ist mit der Sicherstellung der Durchgängigkeit der Atemwege verbunden; Die endotracheale Sondierung und künstliche Beatmung wird bei Patienten empfohlen, bei denen die arteriellen Blutgase im Grenzbereich liegen und eine respiratorische Insuffizienz droht.

