Facharzt des Artikels
Neue Veröffentlichungen
Aplasie des Knochenmarks
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
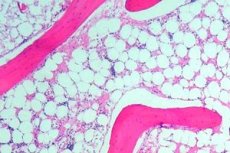
Knochenmarkaplasie (oder hämatopoetische Aplasie) ist ein Syndrom der Knochenmarkinsuffizienz, das eine Gruppe von Erkrankungen umfasst, bei denen die hämatopoetische Funktion des Knochenmarks stark unterdrückt ist. Die Folge dieser Erkrankung ist die Entwicklung einer Panzytopenie (es kommt zu einem Mangel aller Blutzellen: Leukozyten, Erythrozyten und Blutplättchen). Eine tiefe Panzytopenie ist ein lebensbedrohlicher Zustand.
Ursachen Knochenmarkaplasie
Zu den Ursachen einer Knochenmarkaplasie zählen unter anderem:
- Chemotherapie und Strahlentherapie.
- Autoimmunerkrankungen.
- Umweltschädliche Arbeitsbedingungen.
- Verschiedene Virusinfektionen.
- Kontakt mit Herbiziden und Insektiziden.
- Einige Medikamente, beispielsweise solche zur Behandlung von rheumatoider Arthritis oder Antibiotika.
- Nächtliche Hämoglobinurie.
- Hämolytische Anämie.
- Erkrankungen des Bindegewebes.
- Schwangerschaft – Das Knochenmark wird durch eine perverse Reaktion des Immunsystems geschädigt.
Risikofaktoren
Zu den Risikofaktoren für eine Knochenmarkaplasie zählen die im Folgenden beschriebenen.
- Chemische Verbindungen: Zytostatika – sie helfen, die Zellteilung zu stoppen und werden üblicherweise zur Behandlung von Tumoren eingesetzt. Eine bestimmte Dosierung solcher Medikamente kann das Knochenmark schädigen und die Bildung von Blutzellen stören. Immunsuppressiva – sie unterdrücken das körpereigene Immunsystem und werden bei übermäßiger Aktivierung des Immunsystems eingesetzt, die das eigene gesunde Gewebe schädigt. Nach Absetzen der Einnahme wird die Hämatopoese oft wiederhergestellt.
- Substanzen, die den Körper beeinflussen, wenn der Patient eine individuelle Überempfindlichkeit dagegen hat. Dies sind Antibiotika (antibakterielle Medikamente), Benzin, Quecksilber, verschiedene Farbstoffe, Chloramphenicol und Goldpräparate. Solche Substanzen können sowohl eine reversible als auch eine irreversible Zerstörung der Knochenmarkfunktion verursachen. Sie können durch die Haut, durch Einatmen von Aerosolen, oral – mit Wasser und Nahrung – in den Körper gelangen;
- Bestrahlung mit ionischen Teilchen (Strahlung) – beispielsweise bei Verstößen gegen Sicherheitsvorschriften in Kernkraftwerken oder in medizinischen Einrichtungen, in denen Tumore mittels Strahlentherapie behandelt werden;
- Virusinfektionen – wie Grippe, Hepatitis-Virus usw.
Pathogenese
Die Pathogenese der Knochenmarkaplasie ist noch nicht vollständig geklärt. Verschiedene Mechanismen ihrer Entstehung werden derzeit diskutiert:
- Das Knochenmark wird durch die pluripotenten Stammzellen beeinflusst;
- Der hämatopoetische Prozess wird durch den Einfluss humoraler oder zellulärer Immunmechanismen unterdrückt;
- Komponenten der Mikroumgebung beginnen, falsch zu funktionieren;
- Entwicklung eines Mangels an Faktoren, die den hämatopoetischen Prozess fördern.
- Mutationen in Genen, die erbliche Knochenmarkversagenssyndrome verursachen.
Bei dieser Erkrankung nimmt der Gehalt an Bestandteilen (Vitamin B12, Eisen und Protoporphyrin), die direkt an der Hämatopoese beteiligt sind, nicht ab, gleichzeitig kann das hämatopoetische Gewebe sie jedoch nicht verwerten.
Symptome Knochenmarkaplasie
Eine Knochenmarkaplasie manifestiert sich in Abhängigkeit davon, welches zelluläre Element des Blutes betroffen ist:
- Bei einer Abnahme der Anzahl roter Blutkörperchen treten Kurzatmigkeit, allgemeine Schwäche und andere Symptome einer Anämie auf.
- Sinkt die Zahl der weißen Blutkörperchen, kommt es zu Fieber und die Infektanfälligkeit des Körpers steigt;
- Bei einer Verringerung des Thrombozytenspiegels besteht die Tendenz zur Entwicklung eines hämorrhagischen Syndroms, von Petechien und Blutungen.
Bei der partiellen Erythrozytenaplasie des Knochenmarks kommt es zu einer starken Abnahme der Produktion roter Blutkörperchen, einer tiefen Retikulozytopenie und einer isolierten normochromen Anämie.
Es gibt angeborene und erworbene Formen dieser Krankheit. Die zweite manifestiert sich in Form einer erworbenen primären Erythroblastophthise sowie eines Syndroms, das bei anderen Krankheiten auftritt (dies können Lungenkrebs, Hepatitis, Leukämie, infektiöse Mononukleose oder Lungenentzündung sowie Sichelzellenanämie, Mumps oder Colitis ulcerosa usw. sein).
Komplikationen und Konsequenzen
Zu den Komplikationen einer Knochenmarkaplasie gehören:
- Anämisches Koma, bei dem es zu Bewusstlosigkeit kommt, Entwicklung eines komatösen Zustands. Es erfolgt keine Reaktion auf äußere Reize, da Sauerstoff nicht in der erforderlichen Menge ins Gehirn gelangt - dies liegt daran, dass der Gehalt an roten Blutkörperchen im Blut schnell und deutlich abnimmt;
- Es kommt zu verschiedenen Blutungen (hämorrhagischen Komplikationen). Die schlimmste Option ist in diesem Fall ein hämorrhagischer Schlaganfall (ein Teil des Gehirns wird mit Blut durchtränkt und stirbt infolgedessen ab).
- Infektionen – Mikroorganismen (verschiedene Pilze, Bakterien oder Viren) verursachen Infektionskrankheiten;
- Beeinträchtigter Funktionszustand einiger innerer Organe (wie Nieren oder Herz), insbesondere bei gleichzeitiger chronischer Erkrankung.
Diagnose Knochenmarkaplasie
Bei der Diagnose einer Knochenmarkaplasie werden die Krankengeschichte und die Beschwerden des Patienten untersucht: Wie lange sind die Krankheitssymptome bereits aufgetreten und womit verbindet der Patient ihr Auftreten?
Anschließend wird die Lebensgeschichte des Patienten abgeklärt:
- Das Vorhandensein gleichzeitiger chronischer Erkrankungen beim Patienten.
- Vorhandensein von Erbkrankheiten.
- Hat der Patient schlechte Angewohnheiten?
- Dabei wird abgeklärt, ob in letzter Zeit über einen längeren Zeitraum Medikamente eingenommen wurden.
- Das Vorhandensein von Tumoren beim Patienten.
- Gab es Kontakt mit verschiedenen toxischen Elementen?
- War der Patient Strahlung oder anderen Strahlungsfaktoren ausgesetzt?
Anschließend wird eine körperliche Untersuchung durchgeführt. Die Hautfarbe wird bestimmt (bei Knochenmarkaplasie tritt Blässe auf), die Pulsfrequenz (meistens schnell) und die Blutdruckwerte (niedrig). Schleimhäute und Haut werden auf Blutungen, eitrige Bläschen usw. untersucht.
Tests
Im Rahmen der Diagnose der Krankheit werden auch einige Labortests durchgeführt.
Es wird eine Blutuntersuchung durchgeführt. Bei einer Knochenmarkaplasie wird ein Rückgang des Hämoglobinspiegels sowie der Anzahl der roten Blutkörperchen festgestellt. Der Farbindex des Blutes bleibt normal. Die Anzahl der Blutplättchen mit Leukozyten nimmt ab, und außerdem ist das korrekte Leukozytenverhältnis gestört, da der Gehalt an Granulozyten abnimmt.
Außerdem wird ein Urintest durchgeführt, um das Vorhandensein von roten Blutkörperchen im Urin festzustellen - dies ist ein Zeichen für ein hämorrhagisches Syndrom oder das Vorhandensein von Leukozyten und Mikroorganismen, was ein Symptom für die Entwicklung infektiöser Komplikationen im Körper ist.
Außerdem wird eine biochemische Blutuntersuchung durchgeführt. Dabei werden die Werte von Glukose, Cholesterin, Harnsäure (zur Erkennung begleitender Organschäden), Kreatinin und Elektrolyten (Natrium, Kalium und Kalzium) bestimmt.
 [ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ], [ 43 ], [ 44 ]
[ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ], [ 43 ], [ 44 ]
Instrumentelle Diagnostik
Bei der instrumentellen Diagnostik werden folgende Verfahren durchgeführt.
Zur Untersuchung des Knochenmarks wird eine Punktion (Durchstechen, bei der der Knocheninhalt entnommen wird) eines Knochens, meist des Brustbeins oder des Hüftknochens, durchgeführt. Mithilfe einer mikroskopischen Untersuchung wird festgestellt, ob blutbildendes Gewebe durch Narbengewebe oder Fett ersetzt wurde.
Eine Trepanbiopsie, bei der das Knochenmark und seine Beziehung zum umliegenden Gewebe untersucht werden. Bei diesem Verfahren wird ein spezielles Gerät namens Trepan verwendet. Mit seiner Hilfe wird eine Knochenmarksäule zusammen mit dem Periost und dem Knochen aus dem Darmbein entnommen.
Elektrokardiographie, die es ermöglicht, Probleme mit der Ernährung des Herzmuskels und dem Herzrhythmus zu erkennen.
Welche Tests werden benötigt?
Differenzialdiagnose
Bei folgenden Erkrankungen wird eine Differentialdiagnostik durchgeführt:
- Nächtliche paroxysmale Hämoglobinurie;
- Hypoplastische Anämie (und auch vorübergehende Erythroblastopenie bei Kindern);
- Hypersplenismus;
- Myelodysplastisches Syndrom;
- Akute und Haarzellleukämie;
- SKV;
- DIC-Syndrom;
- Anämie, die als Folge einer Hypophyseninsuffizienz, einer Schilddrüsenunterfunktion oder einer Lebererkrankung entsteht.
Wen kann ich kontaktieren?
Behandlung Knochenmarkaplasie
Es ist fast unmöglich, die Krankheit durch eine etiotrope Behandlung (durch Beeinflussung ihrer Ursache) zu beseitigen. Die Beseitigung des auslösenden Faktors kann hilfreich sein (z. B. Absetzen des Medikaments, Verlassen der Strahlungszone usw.). In diesem Fall verringert sich jedoch nur die Knochenmarkstodrate, eine stabile Hämatopoese kann mit dieser Methode jedoch nicht wiederhergestellt werden.
Eine immunsuppressive Behandlung wird angewendet, wenn eine Transplantation nicht möglich ist (es gibt keinen geeigneten Spender für den Patienten). In diesem Fall werden Medikamente aus der Gruppe der Cyclosporine A oder Antilymphozytenglobuline eingesetzt. Manchmal werden sie auch kombiniert angewendet.
Einsatz von GM-CSF (Medikamente, die die Produktion weißer Blutkörperchen anregen). Diese Behandlung wird angewendet, wenn die Anzahl der weißen Blutkörperchen unter 2 x 10 g/l sinkt. In diesem Fall können auch Kortikosteroide eingesetzt werden.
Dabei kommen Anabolika zum Einsatz, die die Eiweißbildung anregen.
Zur Behandlung der Knochenmarkaplasie kommen folgende Methoden zum Einsatz:
- Transfusion von Blutbestandteilen.
Transfusionen werden mit gewaschenen roten Blutkörperchen (von Proteinen befreite rote Blutkörperchen des Spenders) durchgeführt. Diese Methode reduziert die Schwere und Anzahl negativer Reaktionen auf das Transfusionsverfahren. Solche Transfusionen werden nur durchgeführt, wenn eine Gefahr für das Leben des Patienten besteht. Dies sind die folgenden Bedingungen:
- der Patient fällt in ein anämisches Koma;
- schwere Anämie (in diesem Fall fällt der Hämoglobinspiegel unter 70 g/l).
Eine Transfusion von Spenderthrombozyten wird durchgeführt, wenn es beim Patienten zu Blutungen und einer deutlichen Abnahme der Thrombozytenzahl kommt.
Abhängig von der Stelle, an der die Blutung begann, wird eine hämostatische Therapie durchgeführt.
Bei infektiösen Komplikationen kommen folgende Behandlungsmethoden zum Einsatz:
- Antibakterielle Behandlung. Diese wird durchgeführt, nachdem Nasen-Rachen-Abstriche sowie Urin- und Blutkulturen entnommen wurden, um den Mikroorganismus zu bestimmen, der die Infektion verursacht hat, und um seine Empfindlichkeit gegenüber Antibiotika zu ermitteln;
- Eine systemische antimykotische Behandlung ist obligatorisch;
- Lokale antiseptische Behandlung von Bereichen, die zu Eintrittspforten für Infektionen werden können (d. h. die Stellen, durch die Bakterien, Pilze oder Viren in den Körper gelangen). Solche Eingriffe beinhalten in der Regel eine Mundspülung und die abwechselnde Anwendung verschiedener Medikamente.
Medikamente
Bei einer Knochenmarkaplasie ist eine medikamentöse Behandlung unerlässlich. Die am häufigsten eingesetzten Medikamente gehören zu drei Gruppen: Zytostatika (6-Mercaptopuril, Cyclophosphamid, Methotrexat, Cyclosporin A und Imuran), Immunsuppressiva (Dexamethason und Methylprednisolon) und Antibiotika (Makrolide, Cephalosporine, Chlorchinolone und Azalide). Manchmal werden auch Medikamente zur Korrektur von Darmflora-Störungen und Blutdruckproblemen, Enzympräparate usw. eingesetzt.
Methylprednisolon wird oral verschrieben. Bei Organtransplantationen – in einer Dosierung von nicht mehr als 0,007 g/Tag.
Nebenwirkungen des Medikaments: Wasser und Natrium können im Körper zurückgehalten werden, der Blutdruck steigt, es kann zu Kaliumverlust kommen, Osteoporose, Muskelschwäche, medikamenteninduzierte Gastritis; die Widerstandskraft gegen verschiedene Infektionen kann abnehmen; Unterdrückung der Nebennierenaktivität, einige psychische Störungen, Probleme mit dem Menstruationszyklus.
Das Medikament ist kontraindiziert bei schwerer Hypertonie; Kreislaufversagen im Stadium 3 sowie Schwangerschaft und akuter Endokarditis, sowie Nephritis, verschiedenen Psychosen, Osteoporose, Zwölffingerdarm- oder Magengeschwüren; nach einer kürzlich erfolgten Operation; im aktiven Stadium der Tuberkulose, Syphilis; bei älteren Menschen sowie bei Kindern unter 12 Jahren.
Methylprednisolon wird bei Diabetes mellitus mit Vorsicht verschrieben, nur bei absoluten Indikationen oder zur Behandlung von Patienten mit Insulinresistenz mit hohen Titern von Anti-Insulin-Antikörpern. Bei Tuberkulose oder Infektionskrankheiten kann das Medikament nur in Kombination mit Antibiotika oder Medikamenten zur Behandlung von Tuberkulose angewendet werden.
Imuran – am ersten Tag darf eine Dosis von nicht mehr als 5 mg pro 1 kg Körpergewicht pro Tag angewendet werden (muss in 2-3 Dosen eingenommen werden), die Dosierung hängt jedoch im Allgemeinen vom Immunsuppressionsschema ab. Die Erhaltungsdosis beträgt 1-4 mg/kg Körpergewicht pro Tag. Sie richtet sich nach der Verträglichkeit des Patienten und seinem klinischen Zustand. Studien zeigen, dass die Behandlung mit Imuran über einen längeren Zeitraum, auch mit kleinen Dosen, durchgeführt werden sollte.
Eine Überdosierung kann zu Halsgeschwüren, Blutungen und Blutergüssen sowie Infektionen führen. Diese Symptome treten häufiger bei chronischer Überdosierung auf.
Nebenwirkungen – Nach einer Knochenmarktransplantation treten bei Patienten, die mit Azathioprin in Kombination mit anderen Immunsuppressiva behandelt werden, häufig bakterielle, Pilz- oder Virusinfektionen auf. Weitere Nebenwirkungen sind Herzrhythmusstörungen, Anzeichen von Meningismus, Kopfschmerzen, Läsionen der Lippen und des Mundes, Parästhesien usw.
Cyclosporin A wird intravenös verabreicht. Die Tagesdosis wird in zwei Dosen aufgeteilt und 2–6 Stunden vorher verabreicht. Für die anfängliche Tagesdosis sind 3–5 mg/kg ausreichend. Die intravenöse Verabreichung ist optimal bei der Behandlung von Patienten, die sich einer Knochenmarktransplantation unterzogen haben. Vor der Transplantation (4–12 Stunden vor der Operation) erhält der Patient eine Dosis von 10–15 mg/kg oral. Anschließend wird die gleiche Tagesdosis für die nächsten 1–2 Wochen angewendet. Später wird die Dosis auf die übliche Erhaltungsdosis (ca. 2–6 mg/kg) reduziert.
Zu den Symptomen einer Überdosierung zählen Schläfrigkeit, starkes Erbrechen, Tachykardie, Kopfschmerzen und die Entwicklung eines schweren Nierenversagens.
Bei der Einnahme von Ciclosporin sind folgende Vorsichtsmaßnahmen zu beachten. Die Therapie muss in einem Krankenhaus von Ärzten durchgeführt werden, die über umfassende Erfahrung in der Behandlung von Patienten mit Immunsuppressiva verfügen. Es ist zu beachten, dass durch die Einnahme von Ciclosporin die Prädisposition für die Entwicklung maligner lymphoproliferativer Tumoren steigt. Deshalb muss vor Beginn der Einnahme entschieden werden, ob der positive Effekt der Behandlung alle damit verbundenen Risiken rechtfertigt. Während der Schwangerschaft darf das Medikament nur unter strengen Indikationen angewendet werden. Da bei intravenöser Verabreichung das Risiko anaphylaktoider Reaktionen besteht, sollten zur Prophylaxe Antihistaminika eingenommen und der Patient so schnell wie möglich auf die orale Verabreichung des Arzneimittels umgestellt werden.
Vitamine
Wenn der Patient zusätzlich zur Hämotherapie Blutungen hat, sollte eine 10%ige Calciumchloridlösung (oral) sowie Vitamin K (15–20 mg pro Tag) eingenommen werden. Zusätzlich werden Ascorbinsäure in großen Mengen (0,5–1 g / Tag) und Vitamin P (in einer Dosierung von 0,15–0,3 g / Tag) verschrieben. Es wird empfohlen, Folsäure in großen Dosen (maximal 200 mg / Tag) sowie Vitamin B6, vorzugsweise in Form von Injektionen (50 mg Pyridoxin täglich), einzunehmen.
Physiotherapeutische Behandlung
Zur Aktivierung des Knochenmarks wird Physiotherapie eingesetzt – Diathermie der Röhrenknochen im Schienbein- oder Brustbeinbereich. Der Eingriff sollte täglich 20 Minuten lang durchgeführt werden. Es ist zu beachten, dass diese Option nur möglich ist, wenn keine ausgeprägte Blutung vorliegt.
Chirurgische Behandlung
Bei schwerer Aplasie wird eine Knochenmarktransplantation durchgeführt. Die Wirksamkeit einer solchen Operation erhöht sich, wenn der Patient jung ist und nur wenige Transfusionen von Spenderblutelementen (maximal 10) erhalten hat.
Bei dieser Behandlung wird dem Spender Knochenmark entnommen und anschließend dem Empfänger transplantiert. Vor der Einbringung der Stammzellsuspension wird diese mit Zytostatika behandelt.
Nach der Transplantation wird der Patient einer längeren immunsuppressiven Behandlung unterzogen, die notwendig ist, um eine mögliche Abstoßung des Transplantats durch den Körper sowie andere negative Immunreaktionen zu verhindern.
Verhütung
Primäre Präventionsmaßnahmen bei Knochenmarkaplasie sind: Es ist notwendig, die Auswirkungen externer negativer Faktoren auf den Körper zu verhindern. Dazu ist es notwendig, Sicherheitsvorkehrungen beim Umgang mit Farbstoffen oder Gegenständen zu treffen, die ionisierende Strahlungsquellen sein können, und auch den Prozess der Medikamenteneinnahme zu kontrollieren.
Die Sekundärprävention, die notwendig ist, um eine mögliche Verschlechterung des Zustands einer Person mit einer bereits entwickelten Krankheit zu verhindern oder einen Rückfall zu verhindern, besteht aus folgenden Maßnahmen:
- Ambulante Überwachung. Die Überwachung sollte auch dann fortgesetzt werden, wenn der Patient Anzeichen einer Genesung zeigt;
- Langfristige unterstützende medikamentöse Therapie.
Prognose
Eine Knochenmarkaplasie hat meist eine ungünstige Prognose – wenn keine rechtzeitige Behandlung erfolgt, verstirbt der Patient in 90 % der Fälle.
Dank der Knochenmarktransplantation können 9 von 10 Patienten mehr als 5 Jahre überleben. Daher gilt diese Methode als die wirksamste Behandlungsmethode.
Manchmal ist eine Transplantation nicht möglich, aber auch moderne medikamentöse Therapien können Erfolge erzielen. Etwa die Hälfte der Patienten kann dank dieser Therapie mehr als fünf Jahre überleben. In den meisten Fällen überleben jedoch Patienten, die erst mit 40 Jahren erkrankten.
Liste maßgeblicher Bücher und Studien zum Thema Knochenmarkaplasie
- Buch: „Aplastische Anämie: Pathophysiologie und Behandlung“ Autor: Hubert Schrezenmeier und Andrea Bacigalupo Jahr: 2009
- Buch: „Aplastische Anämie und andere Knochenmarkversagenssyndrome“ Autor: Neal S. Young und Colin G. Steward Jahr: 2018
- Studie: „Diagnose und Behandlung der erworbenen aplastischen Anämie bei Kindern“ Autoren: Monica Bessler und Blanche P. Alter Jahr: 2016
- Studie: „Aplastische Anämie: Pathogenese, Diagnose und Behandlung“ Autor: Jaroslaw P. Maciejewski und Neal S. Young Jahr: 2018
- Buch: „Aplastische Anämie“ Autor: John W. Adamson Jahr: 2009

