Facharzt des Artikels
Neue Veröffentlichungen
Polyzystisches Ovarsyndrom.
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
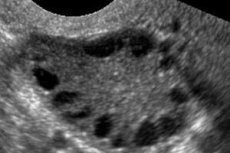
Das polyzystische Ovarialsyndrom ist eine multifaktorielle heterogene Erkrankung, die durch Menstruationszyklusstörungen, chronische Anovulation, Hyperandrogenismus, zystische Veränderungen in den Eierstöcken und Unfruchtbarkeit gekennzeichnet ist. Charakteristisch für das polyzystische Ovarialsyndrom sind moderates Übergewicht, unregelmäßige Perioden oder Amenorrhoe sowie Symptome eines Androgenüberschusses (Hirsutismus, Akne). Die Eierstöcke enthalten in der Regel zahlreiche Zysten. Die Diagnose basiert auf Schwangerschaftstests, Hormonspiegeln und Untersuchungen zum Ausschluss eines virilisierenden Tumors. Die Behandlung erfolgt symptomatisch.
Ursachen polyzystisches Ovarsyndrom
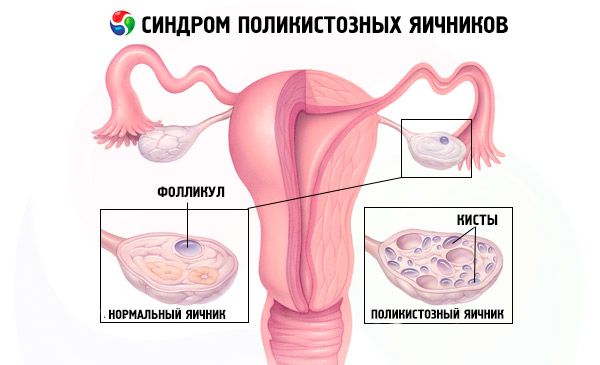
Das polyzystische Ovarialsyndrom ist eine häufige endokrine Erkrankung des Fortpflanzungssystems, die bei 5–10 % der Patientinnen auftritt. Es ist durch Anovulation und einen Überschuss an Androgenen unbekannter Ätiologie gekennzeichnet. Die Eierstöcke können normal groß oder vergrößert sein und eine glatte, verdickte Kapsel aufweisen. In der Regel enthalten die Eierstöcke viele kleine, 26 mm große Follikelzysten; gelegentlich finden sich auch große Zysten mit atretischen Zellen. Ein erhöhter Östrogenspiegel erhöht das Risiko einer Endometriumhyperplasie und letztlich eines Endometriumkarzinoms. Häufig sind die Androgenspiegel erhöht, was das Risiko für das Metabolische Syndrom und Hirsutismus erhöht.
 [ 13 ]
[ 13 ]
Pathogenese
Frauen mit polyzystischem Ovarialsyndrom (PCOS) weisen Störungen im Androgen- und Östrogenstoffwechsel sowie eine gestörte Androgensynthese auf. Die Erkrankung geht mit hohen Serumkonzentrationen von Androgenhormonen wie Testosteron, Androstendion, Dehydroepiandrosteronsulfat und (DHEA-S) einher. Manchmal können jedoch normale Androgenspiegel festgestellt werden.
PCOS wird auch mit Insulinresistenz, Hyperinsulinämie und Fettleibigkeit in Verbindung gebracht. Hyperinsulinämie kann auch zu einer Unterdrückung der SHBG-Synthese führen, was wiederum androgene Eigenschaften verstärken kann.
Darüber hinaus ist die Insulinresistenz bei PCOS mit Adiponektin verbunden, einem von Adipozyten abgesonderten Hormon, das den Fettstoffwechsel und den Blutzuckerspiegel reguliert.
Erhöhte Androgenspiegel gehen mit einer verstärkten stimulierenden Wirkung des von der Hypophyse ausgeschütteten luteinisierenden Hormons (LH) einher, was zum Wachstum der ovariellen Thekazellen führt. Diese Zellen wiederum steigern die Synthese von Androgenen (Testosteron, Androstendion). Aufgrund eines im Verhältnis zum LH verringerten Spiegels des follikelstimulierenden Hormons (FSH) können die ovariellen Granulazellen Androgene nicht zu Östrogenen aromatisieren, was zu einem Rückgang des Östrogenspiegels und anschließender Anovulation führt.
Einige Hinweise deuten darauf hin, dass bei den Patienten eine Funktionsstörung des Cytochroms P450c17, 17-Hydroxylase, vorliegt, die die Androgenbiosynthese hemmt.
Das polyzystische Ovarialsyndrom ist ein genetisch heterogenes Syndrom. Studien an Familienmitgliedern mit PCOS belegen einen autosomal-dominanten Erbgang. Kürzlich wurde ein genetischer Zusammenhang zwischen PCOS und Adipositas bestätigt. Eine Variante des FTO-Gens (rs9939609, die zu allgemeiner Adipositas prädisponiert) ist signifikant mit der Anfälligkeit für die Entwicklung von PCOS assoziiert. Es wurden Polymorphismen des 2p16-Locus (2p16.3, 2p21 und 9q33.3) identifiziert, die mit dem polyzystischen Ovarialsyndrom assoziiert sind, sowie das Gen, das den Rezeptor des luteinisierenden Hormons (LH) und des humanen Choriongonadotropins (hCG) kodiert.
Symptome polyzystisches Ovarsyndrom
Die Symptome des polyzystischen Ovarialsyndroms beginnen in der Pubertät und nehmen mit der Zeit ab. Eine regelmäßige Menstruation über einen längeren Zeitraum nach der Menarche schließt die Diagnose eines polyzystischen Ovarialsyndroms aus. Bei der Untersuchung zeigt sich in der Regel reichlich Zervixschleim (ein Hinweis auf einen hohen Östrogenspiegel). Die Diagnose eines polyzystischen Ovarialsyndroms kann vermutet werden, wenn eine Frau mindestens zwei typische Symptome aufweist (mäßiges Übergewicht, Hirsutismus, unregelmäßige Perioden oder Amenorrhoe).
Die häufigste Kombination klinischer Symptome ist:
- Menstruationszyklusstörungen (Oligomenorrhoe, dysfunktionale Gebärmutterblutung, sekundäre Amenorrhoe);
- Anovulation;
- Unfruchtbarkeit;
- Hirsutismus;
- Störung des Fettstoffwechsels (Adipositas und metabolisches Syndrom);
- Diabetes;
- obstruktives Schlafapnoe-Syndrom.
Was bedrückt dich?
Diagnose polyzystisches Ovarsyndrom
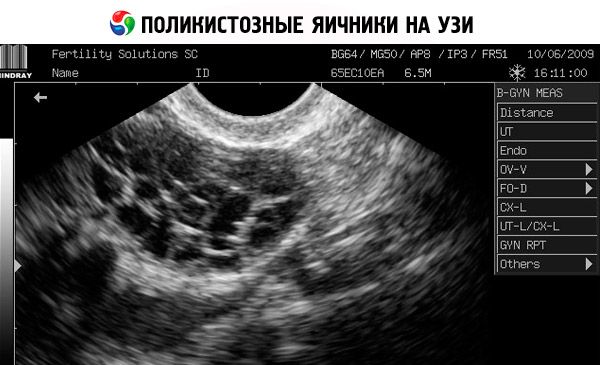
Die Diagnose basiert auf dem Ausschluss einer Schwangerschaft (Schwangerschaftstest) und der Untersuchung von Estradiol, FSH, TSH und Prolaktin im Blutserum. Die Diagnose wird durch eine Ultraschalluntersuchung bestätigt, die mehr als zehn Follikel im Eierstock zeigt; die Follikel befinden sich meist in der Peripherie und ähneln einer Perlenkette. Bei Follikeln in den Eierstöcken und Hirsutismus sollten die Testosteron- und DHEAS-Werte bestimmt werden. Pathologische Werte werden wie bei Amenorrhoe beurteilt.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
Anamnese und körperliche Untersuchung
Durch eine sorgfältige Anamnese werden erbliche Faktoren für die Entwicklung des polyzystischen Ovarialsyndroms identifiziert. Bei der Untersuchung werden der Body-Mass-Index und das Taille-Hüft-Verhältnis (normalerweise ≤ 0,8) berechnet, um Übergewicht und Fettleibigkeit zu diagnostizieren.
Das polyzystische Ovarialsyndrom ist durch einen Polymorphismus der klinischen und laborchemischen Symptome gekennzeichnet.
Spezielle Diagnosemethoden für das polyzystische Ovarialsyndrom
Am 3.–5. Tag der menstruationsähnlichen Reaktion ist eine Hormonuntersuchung obligatorisch: Die Blutwerte von LH, FSH, Prolaktin, Testosteron, Nebennierenandrogenen – DHEAS, 17-Hydroxyprogesteron – werden bestimmt. Das polyzystische Ovarialsyndrom ist durch einen hohen LH/FSH-Index -> 2,5–3 (aufgrund eines Anstiegs des LH-Spiegels) und Hyperandrogenismus gekennzeichnet.
Um die Ursache des Hyperandrogenismus zu klären, wird zur Differentialdiagnose eines Hyperandrogenismus, der durch eine Mutation des Gens verursacht wird, das das 21-Hydroxylase-Enzym in den Nebennieren kodiert (Diagnose latenter und latenter Formen des adrenogenitalen Syndroms), ein ACTH-Test durchgeführt. Vorgehensweise: Um 9 Uhr wird Blut aus der Kubitalvene entnommen, dann wird 1 mg des Medikaments Synacthen-Depot intramuskulär verabreicht, und nach 9 Stunden wird erneut Blut entnommen. Die Konzentration von Cortisol und 17-Hydroxyprogesteron wird in beiden Blutportionen bestimmt, dann wird mithilfe einer speziellen Formel ein Koeffizient berechnet, dessen Werte 0,069 nicht überschreiten sollten. In diesen Fällen ist der Test negativ und die Frau (oder der Mann) ist kein Träger der 21-Hydroxylase-Genmutation.
Der Diphenin-Test dient dem Nachweis zentraler Formen des polyzystischen Ovarialsyndroms und der Möglichkeit einer Behandlung mit Neurotransmittern. Testtechnik: Die Anfangskonzentrationen von LH und Testosteron im Blut werden bestimmt, anschließend wird drei Tage lang dreimal täglich eine Tablette Diphenin eingenommen. Anschließend wird die Konzentration dieser Hormone im Blut erneut bestimmt. Der Test gilt als positiv, wenn der LH- und Testosteronspiegel sinkt.
- Bei der Ultraschalluntersuchung der Geschlechtsorgane sind vergrößerte Eierstöcke (10 cm3 oder mehr), mehrere Follikel mit einem Durchmesser von bis zu 9 mm, eine Verdickung des Eierstockstromas und eine Verdickung der Kapsel erkennbar.
- Zusätzlich wird bei Verdacht auf eine Insulinresistenz ein Glukosetoleranztest durchgeführt, um den Insulin- und Glukosespiegel vor und nach dem Training zu bestimmen.
- Bei Verdacht auf eine Nebennierenentstehung des polyzystischen Ovarialsyndroms werden eine genetische Beratung und eine HLA-Genotypisierung empfohlen.
- Hysterosalpingographie.
- Laparoskopie.
- Beurteilung der Fruchtbarkeit des Spermas des Ehepartners.
Im November 2015 veröffentlichten die American Association of Clinical Endocrinologists (AACE), das American College of Endocrinology (ACE) und die Androgen Excess and PCOS Society (AES) neue Leitlinien zur Diagnose von PCOS. Diese Leitlinien lauten:
- Die Diagnosekriterien für PCOS müssen eines der folgenden drei Kriterien umfassen: chronische Anovulation, klinischer Hyperandrogenismus und polyzystisches Ovarialsyndrom.
- Zusätzlich zu den klinischen Befunden sollten zur Diagnose von PCOS die Serumspiegel von 17-Hydroxyprogesteron und Anti-Müller-Hormon gemessen werden.
- Der freie Testosteronspiegel ist bei der Erkennung eines Androgenüberschusses empfindlicher als der Gesamttestosteronspiegel.
Was muss untersucht werden?
Differenzialdiagnose
Wen kann ich kontaktieren?
Behandlung polyzystisches Ovarsyndrom
Frauen mit anovulatorischen Menstruationszyklen (Anamnese mit ausbleibender oder unregelmäßiger Menstruation und ohne Anzeichen einer Progesteronproduktion), ohne Hirsutismus und ohne Wunsch, schwanger zu werden, erhalten ein intermittierendes Gestagen (z. B. Medroxyprogesteron 5–10 mg oral einmal täglich für 10–14 Tage pro Monat über 12 Monate) oder orale Kontrazeptiva, um das Risiko einer Endometriumhyperplasie und eines Endometriumkarzinoms zu verringern und den zirkulierenden Androgenspiegel zu senken.
Bei Frauen mit polyzystischem Ovarialsyndrom, anovulatorischen Zyklen und Hirsutismus ohne Schwangerschaftswunsch zielt die Behandlung auf die Reduzierung des Hirsutismus und die Regulierung der Serumtestosteron- und DHEAS-Spiegel ab. Frauen mit Kinderwunsch unterziehen sich einer Fruchtbarkeitsbehandlung.
Die Behandlung der Unfruchtbarkeit beim polyzystischen Ovarialsyndrom erfolgt in 2 Phasen:
- Stufe 1 – vorbereitend;
- Stufe 2 – Stimulation des Eisprungs.
Die Therapie im Vorbereitungsstadium hängt von der klinischen und pathogenetischen Form des polyzystischen Ovarialsyndroms ab.
- Bei polyzystischem Ovarialsyndrom und Fettleibigkeit wird die Verschreibung von Medikamenten empfohlen, die zur Verringerung der Insulinresistenz beitragen: Das Mittel der Wahl ist Metformin, das 3–6 Monate lang dreimal täglich in einer Dosis von 500 mg oral eingenommen wird.
- Bei der ovariellen Form des polyzystischen Ovarialsyndroms und hohen LH-Werten werden Medikamente eingesetzt, die dazu beitragen, die Empfindlichkeit des Hypothalamus-Hypophysen-Systems gegenüber einer vollständigen Unterdrückung der Eierstockfunktion (Serumöstradiolspiegel < 70 pmol/l) zu verringern:
- Buserelin-Spray, 150 µg in jedes Nasenloch 3-mal täglich ab dem 21. oder 2. Tag des Menstruationszyklus, Kurs 1–3 Monate, oder
- Buserelin-Depot intramuskulär 3,75 mg einmal alle 28 Tage ab dem 21. oder 2. Tag des Menstruationszyklus, Kurs 1–3 Monate, oder
- Leuprorelin subkutan 3,75 mg einmal alle 28 Tage ab dem 21. oder 2. Tag des Menstruationszyklus, Kurs 1–3 Monate, oder
- Triptorelin subkutan 3,75 mg einmal alle 28 Tage oder 0,1 mg einmal täglich ab dem 21. oder 2. Tag des Menstruationszyklus, Behandlungsdauer 1–3 Monate.
Es spielt grundsätzlich keine Rolle, ab welchem Tag (21. oder 2.) des Menstruationszyklus GnRH-Agonisten verschrieben werden. Eine Verschreibung ab dem 21. Tag ist jedoch vorzuziehen, da sich in diesem Fall keine Eierstockzysten bilden. Bei einer Verschreibung ab dem 2. Zyklustag fällt die der Suppressionsphase vorausgehende Aktivierungsphase im Wirkmechanismus des GnRH-Agonisten mit der Follikelphase des Zyklus zusammen und kann zur Bildung von Eierstockzysten führen.
Alternative Medikamente:
- Ethinylestradiol/Dienogest oral 30 mcg/2 mg einmal täglich vom 5. bis zum 25. Tag des Menstruationszyklus, Kurs 3–6 Monate oder
- Ethinylestradiol/Cyproteronacetat oral 35 µg/2 mg einmal täglich vom 5. bis zum 25. Tag des Menstruationszyklus, Behandlungsdauer 3–6 Monate.
- Bei der adrenalen Form des polyzystischen Ovarialsyndroms ist die Gabe von Glukokortikoid-Medikamenten angezeigt:
- Dexamethason oral 0,25–1 mg einmal täglich, Kurs 3–6 Monate oder
- Methylprednisolon oral 2–8 mg einmal täglich, Kurs 3–6 Monate oder
- Prednisolon oral 2,5–10 mg einmal täglich, Behandlung 3–6 Monate.
- Bei der zentralen Form des polyzystischen Ovarialsyndroms werden Antikonvulsiva eingesetzt:
- Diphenin 1 Tablette oral 1-2 mal täglich;
- Carbamazepin oral 100 mg 2-mal täglich, Behandlungsdauer 3–6 Monate.
In der 2. Phase wird eine Eisprungstimulation durchgeführt.
Die Auswahl der Medikamente und ihre Verabreichungsschemata werden unter Berücksichtigung klinischer und Labordaten festgelegt. Während der Eisprunginduktion wird eine sorgfältige Ultraschall- und Hormonüberwachung des stimulierten Zyklus durchgeführt.
Es ist nicht zulässig, den Eisprung mit Medikamenten ohne Ultraschallüberwachung auszulösen. Bei zystischen Formationen in den Eierstöcken mit einem Durchmesser von > 15 mm und einer Endometriumdicke von > 5 mm ist eine Eisprunginduktion nicht ratsam.
Eine Ovulationsinduktion mit Clomifen ist bei jungen Frauen mit kurzer Krankheitsgeschichte und ausreichendem Östrogenspiegel (Serumöstradiol < 150 pmol/l) und niedrigem LH-Spiegel (> 15 IU/l) angezeigt.
Clomifen wird oral einmal täglich 100 mg vom 5. bis 9. Tag des Menstruationszyklus zur gleichen Tageszeit verschrieben.
Am 10. Zyklustag wird eine Kontroll-Ultraschalluntersuchung durchgeführt, bei der der Durchmesser des dominanten Follikels und die Dicke des Endometriums beurteilt werden. Die Untersuchungen werden jeden zweiten Tag, in der periovulatorischen Phase täglich durchgeführt. Nicht der Zyklustag ist entscheidend, sondern die Größe des Leitfollikels: Beträgt sein Durchmesser mehr als 16 mm, muss täglich eine Ultraschalluntersuchung durchgeführt werden, bis er eine Größe von 20 mm erreicht.
Alternative Behandlungsschemata (mit ausgeprägter antiöstrogener Wirkung):
Schema 1:
- Clomifen oral 100 mg 1-mal täglich vom 5. bis 9. Tag des Menstruationszyklus zur gleichen Tageszeit +
- Ethinylestradiol (EE) oral 50 mcg 2-mal täglich vom 10. bis zum 15. Tag des Menstruationszyklus oder
- Estradiol oral 2 mg 2-mal täglich vom 10. bis 15. Tag des Menstruationszyklus.
Schema 2:
- Clomifen oral 100 mg 1-mal täglich vom 3. bis 7. Tag des Menstruationszyklus zur gleichen Tageszeit +
- Menotropine intramuskulär 75–150 IE einmal täglich zur gleichen Zeit ab dem 7.–8. Tag des Menstruationszyklus oder
- Follitropin Alpha intramuskulär 75–150 IE einmal täglich zur gleichen Zeit ab dem 7.–8. Tag des Menstruationszyklus.
Eine Ovulationsinduktion mit Clomifencitrat ist in folgenden Situationen nicht angezeigt:
- bei Hypoöstrogenismus (Serumöstradiolspiegel < 150 pmol/l);
- nach vorläufiger Vorbereitung mit GnRH-Agonisten (aufgrund einer verminderten Empfindlichkeit des Hypothalamus-Hypophysen-Ovarialsystems entwickelt sich ein Hypoöstrogenismus);
- bei Frauen im fortgeschrittenen gebärfähigen Alter mit langer Krankheitsgeschichte und hohen LH-Serumspiegeln (> 15 IE/l). Eine Erhöhung der Clomifen-Dosis auf 150 mg/Tag während wiederholter Stimulationszyklen ist nicht sinnvoll, da sich der negative periphere antiöstrogene Effekt verstärkt.
Es wird nicht empfohlen, mehr als 3 aufeinanderfolgende Clomifen-Stimulationszyklen durchzuführen; wenn die Behandlung wirkungslos ist, sollten Gonadotropine verwendet werden.
Die Stimulation des Eisprungs mit Gonadotropinen ist angezeigt, wenn nach Stimulation mit Clomifen keine ausreichende Follikulogenese erfolgt, ein ausgeprägter peripherer antiöstrogener Effekt vorliegt und die Östrogensättigung unzureichend ist. Sie kann sowohl bei jungen Patientinnen als auch im späten reproduktiven Alter durchgeführt werden.
Medikamente der Wahl:
- Menotropine intramuskulär 150–225 IE einmal täglich vom 3.–5. Tag des Menstruationszyklus zur gleichen Zeit, Kurs 7–15 Tage oder
- Urofollitropin intramuskulär 150–225 IE einmal täglich vom 3.–5. Tag des Menstruationszyklus zur gleichen Zeit, Kur 7–15 Tage.
Alternative Medikamente (bei hohem Risiko für die Entwicklung eines ovariellen Überstimulationssyndroms):
- Follitropin Alpha intramuskulär 100–150 IE einmal täglich vom 3.–5. Tag des Menstruationszyklus zur gleichen Zeit, Verlauf 7–15 Tage. Die Induktion des Eisprungs mit Gonadotropinen unter Verwendung von GnRH-Analoga ist bei Vorliegen eines polyzystischen Ovarialsyndroms mit hohen LH-Spiegeln im Blutserum (> 15 IE/l) angezeigt.
Medikamente der Wahl:
- Buserelin in Form eines Sprays von 150 µg in jedes Nasenloch 3-mal täglich ab dem 21. Tag des Menstruationszyklus oder
- Buserelin-Depot 3,75 mg intramuskulär einmal am 21. Tag des Menstruationszyklus;
- Leuprorelin subkutan 3,75 mg einmal am 21. Tag des Menstruationszyklus;
- Triptorelin subkutan 3,75 mg einmal am 21. Tag des Menstruationszyklus oder 0,1 mg einmal täglich ab dem 21. Tag des Menstruationszyklus +
- Menotropine intramuskulär 225–300 IE einmal täglich ab dem 2.–3. Tag des darauffolgenden Menstruationszyklus zur gleichen Zeit.
Alternative Medikamente (bei hohem Risiko für die Entwicklung eines ovariellen Überstimulationssyndroms):
- Menotropine intramuskulär 150–225 IE einmal täglich ab dem 2.–3. Tag des Menstruationszyklus zur gleichen Zeit oder
- Follitropin alpha intramuskulär 150–225 IE einmal täglich ab dem 2.–3. Tag des Menstruationszyklus zur gleichen Zeit +
- Ganirelix subkutan 0,25 mg einmal täglich, beginnend ab dem 5.–7. Tag der Gonadotropinanwendung (wenn der dominante Follikel eine Größe von 13–14 mm erreicht);
- Cetrorelix subkutan 0,25 mg einmal täglich, beginnend ab dem 5.–7. Tag der Gonadotropinanwendung (wenn der dominante Follikel eine Größe von 13–14 mm erreicht).
Induktion des Eisprungs bei Patientinnen im späten reproduktiven Alter (mit schwacher Reaktion der Eierstöcke auf Gonadotropine).
Medikamente der Wahl:
- Menotropine intramuskulär 225 IE einmal täglich vom 3. bis 5. Tag des Menstruationszyklus zur gleichen Zeit +
- Triptorelin subkutan 0,1 mg einmal täglich ab dem 2. Tag des Menstruationszyklus.
Alternative Medikamente:
- Triptorelin subkutan 0,1 mg einmal täglich ab dem 2. Tag des Menstruationszyklus +
- Follitropin Alpha intramuskulär 200–225 IE einmal täglich vom 3. bis 5. Tag des Menstruationszyklus zur gleichen Zeit.
Bei allen Behandlungsschemata mit Gonadotropinen wird die Angemessenheit der Dosis anhand der Dynamik des Follikelwachstums (normalerweise 2 mm/Tag) beurteilt. Bei langsamem Follikelwachstum wird die Dosis um 75 IE erhöht, bei zu schnellem Wachstum wird sie um 75 IE reduziert.
Bei allen Behandlungsschemata wird die Therapie abgebrochen und humanes Choriongonadotropin in einer Einzeldosis von 10.000 IE intramuskulär verabreicht, wenn ein reifer Follikel von 18–20 mm Größe vorliegt und die Endometriumdicke mindestens 8 mm beträgt.
Nach Bestätigung des Eisprungs wird die Lutealphase des Zyklus unterstützt.
Medikamente der Wahl:
- Dydrogesteron oral 10 mg 1-3 mal täglich, Kurs 10-12 Tage oder
- Progesteron oral 100 mg 2-3 mal täglich oder vaginal 100 mg 2-3 mal täglich oder intramuskulär 250 mg 1 mal täglich, Kurs 10-12 Tage. Alternatives Medikament (bei fehlenden Symptomen einer ovariellen Überstimulation):
- humanes Choriongonadotropin intramuskulär 1500–2500 IE einmal täglich an den Tagen 3,5 und 7 der Lutealphase.
Andere Medikamente, die zur Behandlung von PCOS verwendet werden:
- Antiandrogene (z. B. Spironolacton, Leuprorelin, Finasterid).
- Hypoglykämische Medikamente (z. B. Metformin, Insulin).
- Selektive Östrogenrezeptormodulatoren (z. B. Clomifencitrat).
- Aknemedikamente (z. B. Benzoylperoxid, Tretinoincreme (0,02–0,1 %)/Gel (0,01–0,1 %)/Lösung (0,05 %), Adapalencreme (0,1 %)/Gel (0,1 %, 0,3 %)/Lösung (0,1 %), Erythromycin 2 %, Clindamycin 1 %, Natriumsulfetamid 10 %).
Nebenwirkungen der Behandlung
Bei der Anwendung von Clomifen entwickeln die meisten Patientinnen eine periphere antiöstrogene Wirkung, die darin besteht, dass das Endometriumwachstum hinter dem Follikelwachstum zurückbleibt und die Menge an Zervixschleim abnimmt. Bei der Anwendung von Gonadotropinen, insbesondere humanem Menopausengonadotropin (Menotropinen), kann sich ein ovarielles Überstimulationssyndrom (OHSS) entwickeln; bei der Anwendung von rekombinantem FSH (Follitropin Alpha) ist das Risiko eines ovariellen Überstimulationssyndroms geringer. Bei der Anwendung von Therapien, die GnRH-Agonisten (Triptorelin, Buserelin, Leuprorelin) enthalten, steigt das Risiko eines ovariellen Überstimulationssyndroms, und die Anwendung von GnRH-Agonisten kann Symptome eines Östrogenmangels verursachen – Hitzewallungen, trockene Haut und Schleimhäute.
Prognose
Die Wirksamkeit der Unfruchtbarkeitsbehandlung beim polyzystischen Ovarialsyndrom hängt von den klinischen und hormonellen Merkmalen des Krankheitsverlaufs, dem Alter der Frau, der Angemessenheit der vorbereitenden Therapie und der richtigen Auswahl des Schemas zur Ovulationsinduktion ab.
Bei 30 % der jungen Frauen mit kurzer Krankheitsgeschichte kann nach einer vorbereitenden Behandlung ohne Eisprunginduktion eine Schwangerschaft erreicht werden.
Die Wirksamkeit der Ovulationsstimulation mit Clomifen liegt bei höchstens 30 % pro Frau; 40 % der Patientinnen mit polyzystischem Ovarialsyndrom sind Clomifen-resistent.
Durch die Einnahme von Menotropinen und Urofollitropin können 45–50 % der Frauen schwanger werden, allerdings erhöhen diese Medikamente das Risiko, ein ovarielles Überstimulationssyndrom zu entwickeln.
Am wirksamsten sind die Schemata mit GnRH-Agonisten, die es ermöglichen, „parasitäre“ LH-Spitzen zu vermeiden: bis zu 60 % der Schwangerschaften pro Frau. Bei der Anwendung dieser Medikamente besteht jedoch das höchste Risiko für Komplikationen – schwere Formen des ovariellen Überstimulationssyndroms, Mehrlingsschwangerschaft. Die Anwendung von GnRH-Antagonisten ist nicht weniger wirksam, geht aber nicht mit einem hohen Risiko für ein ovarielles Überstimulationssyndrom einher.
 [ 34 ]
[ 34 ]

