Facharzt des Artikels
Neue Veröffentlichungen
Eierstock
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
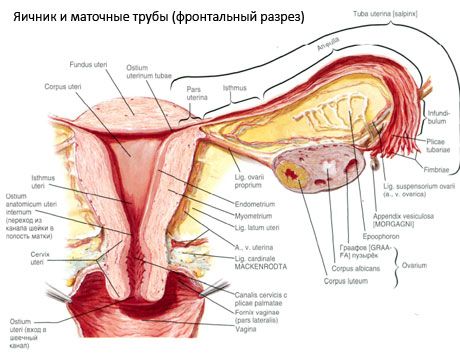
Der Eierstock (Ovarium; griechisch Oophoron) ist ein paariges Organ, eine weibliche Fortpflanzungsdrüse, die sich in der Beckenhöhle hinter dem breiten Band der Gebärmutter befindet. In den Eierstöcken entwickeln und reifen weibliche Fortpflanzungszellen (Eier), und es werden weibliche Sexualhormone gebildet, die in Blut und Lymphe gelangen. Der Eierstock hat eine eiförmige Form, die in anterior-posteriorer Richtung etwas abgeflacht ist. Die Farbe des Eierstocks ist rosa. Auf der Oberfläche des Eierstocks einer gebärenden Frau sind Vertiefungen und Narben sichtbar – Spuren des Eisprungs und der Umwandlung der Gelbkörper. Der Eierstock wiegt 5–8 g. Die Abmessungen des Eierstocks betragen: Länge 2,5–5,5 cm, Breite 1,5–3,0 cm, Dicke – bis zu 2 cm. Der Eierstock hat zwei freie Oberflächen: die mediale Oberfläche (Facies medialis), die der Beckenhöhle zugewandt ist und teilweise vom Eileiter bedeckt ist, und die laterale Oberfläche (Facies lateralis), die an die Seitenwand des Beckens angrenzt und zu einer leicht ausgeprägten Vertiefung - der Ovarialgrube - führt. Diese Grube befindet sich im Winkel zwischen den äußeren Beckengefäßen, die oben mit Peritoneum bedeckt sind, und den Uterus- und Obturatorarterien unten. Hinter dem Eierstock verläuft der Harnleiter der entsprechenden Seite retroperitoneal von oben nach unten.
Die Oberflächen des Eierstocks gehen in einen konvexen freien (hinteren) Rand (Margo liber) über, vorne in den Mesenterialrand (Margo mesovaricus), der durch eine kurze Falte des Peritoneums (Mesenterium des Eierstocks) mit dem hinteren Segel des Ligamentum latum der Gebärmutter verbunden ist. An diesem vorderen Rand des Organs befindet sich eine gerillte Vertiefung - der Hilus des Eierstocks (Hilum ovarii), durch den Arterie und Nerven in den Eierstock eintreten und Venen und Lymphgefäße austreten. Der Eierstock hat auch zwei Enden: das abgerundete obere röhrenförmige Ende (Extremitas tubaria), das dem Eileiter zugewandt ist, und das untere Gebärmutterende (Extremitas utenna), das durch das Eierstockband (Lig. ovarii proprium) mit der Gebärmutter verbunden ist. Dieses Band in Form einer runden Schnur mit einer Dicke von etwa 6 mm verläuft vom Gebärmutterende des Eierstocks zum seitlichen Winkel der Gebärmutter, der sich zwischen den beiden Blättern des breiten Uterusbandes befindet. Zum Bandapparat des Eierstocks gehört auch das Ligamentum suspensorium des Eierstocks (lig.suspensorium ovarii), eine Falte des Peritoneums, die von der Wand des kleinen Beckens zum Eierstock verläuft und die Eierstockgefäße und Bündel von Faserfasern enthält. Der Eierstock wird durch ein kurzes Mesenterium (Mesovarium) fixiert, eine Verdoppelung des Peritoneums, die vom hinteren Blatt des breiten Uterusbandes zum mesenterialen Rand des Eierstocks verläuft. Die Eierstöcke selbst sind nicht vom Peritoneum bedeckt. Der größte Eierstockrand des Eileiters ist am röhrenförmigen Ende des Eierstocks befestigt. Die Topographie des Eierstocks hängt von der Position der Gebärmutter und ihrer Größe (während der Schwangerschaft) ab. Die Eierstöcke sind sehr bewegliche Organe der kleinen Beckenhöhle.
Gefäße und Nerven des Eierstocks
Die Blutversorgung der Eierstöcke erfolgt über die Arteria ovaricae et uterinae. Beide Eierstockarterien (aa. ovaricae dextra et sinistra) entspringen an der Vorderseite der Aorta direkt unterhalb der Nierenarterien; die rechte entspringt normalerweise aus der Aorta und die linke aus der Nierenarterie. Jede Eierstockarterie verläuft nach unten und seitlich entlang der Vorderseite des Musculus psoas major, kreuzt vorne den Harnleiter (und gibt Äste ab), die äußeren Beckengefäße, die Grenzlinie und tritt in die Beckenhöhle ein, wo sie im Ligamentum suspensorium des Eierstocks liegt. In medialer Richtung verläuft die Eierstockarterie zwischen den Blättern des Ligamentum latum uteri unter dem Eileiter hindurch, gibt Äste ab und tritt dann in das Mesenterium des Eierstocks ein; sie tritt in den Hilus des Eierstocks ein.
Die Äste der Eierstockarterie anastomosieren weitgehend mit den Eierstockästen der Gebärmutterarterie. Der venöse Abfluss aus den Eierstöcken erfolgt hauptsächlich in den Eierstockvenenplexus im Bereich des Eierstockhilus. Von hier aus fließt das Blut in zwei Richtungen ab: durch die Gebärmutter- und Eierstockvenen. Die rechte Eierstockvene hat Klappen und mündet in die untere Hohlvene. Die linke Eierstockvene mündet in die linke Nierenvene, hat jedoch keine Klappen.
Der Lymphabfluss aus den Eierstöcken erfolgt über die Lymphgefäße, insbesondere im Bereich der Organpforte, wo sich der subovarielle Lymphplexus abgrenzt. Anschließend wird die Lymphe über die ovariellen Lymphgefäße zu den paraaortischen Lymphknoten abgeleitet.
Innervation der Eierstöcke
Sympathisch – bereitgestellt durch postganglionäre Fasern aus dem Plexus coeliacus (Solaris), dem Plexus mesentericus superior und dem Plexus hypogastricus; parasympathisch – durch die viszeralen Sakralnerven.
Aufbau des Eierstocks
Die Oberfläche des Eierstocks ist mit einem einschichtigen Keimepithel bedeckt. Darunter befindet sich eine dichte Bindegewebsproteinschicht (Tunica albuginea). Das Bindegewebe des Eierstocks bildet sein Stroma (Stroma ovarii), das reich an elastischen Fasern ist. Die Substanz des Eierstocks, sein Parenchym, ist in äußere und innere Schichten unterteilt. Die innere Schicht, die sich in der Mitte des Eierstocks, näher an seinem Tor, befindet, wird Medulla (Medulla ovarii) genannt. In dieser Schicht, in lockerem Bindegewebe, befinden sich zahlreiche Blut- und Lymphgefäße sowie Nerven. Die äußere Schicht des Eierstocks – die Rinde (Cortex ovarii) – ist dichter. Es enthält viel Bindegewebe, in dem sich die reifenden primären Eierstockfollikel (Folliculi ovarici primarii), sekundäre (vesikuläre) Follikel (Folliculi ovarici secundarii, s.vesiculosi) sowie reife Follikel, Graaf-Follikel (Folliculi ovarici maturis) sowie gelbe und atretische Körper befinden.
Jeder Follikel enthält eine weibliche Eizelle, die sogenannte Oozyte (Ovocytus). Die Eizelle hat einen Durchmesser von bis zu 150 µm, ist rund und enthält einen Zellkern sowie viel Zytoplasma, das neben Zellorganellen auch Protein-Lipid-Einschlüsse (Eigelb) und Glykogen enthält, das für die Ernährung der Eizelle notwendig ist. Die Eizelle verbraucht ihren Nährstoffvorrat in der Regel innerhalb von 12–24 Stunden nach dem Eisprung. Kommt es nicht zur Befruchtung, stirbt die Eizelle ab.
Die menschliche Eizelle ist von zwei Membranen umgeben. Im Inneren befindet sich das Zytolemma, die zytoplasmatische Membran der Eizelle. Außerhalb des Zytolemmas befindet sich eine Schicht sogenannter Follikelzellen, die die Eizelle schützen und eine hormonbildende Funktion erfüllen – sie scheiden Östrogene aus.
Die physiologische Position von Gebärmutter, Eileitern und Eierstöcken wird durch die Aufhänge-, Fixierungs- und Stützapparate gewährleistet, die Bauchfell, Bänder und Beckengewebe verbinden. Der Aufhängeapparat besteht aus paarigen Formationen und umfasst das runde und breite Gebärmutterband, das eigentliche Gebärmutterband und die Aufhängebänder der Eierstöcke. Das breite Gebärmutterband, das eigentliche Gebärmutterband und die Aufhängebänder der Eierstöcke halten die Gebärmutter in ihrer mittleren Position. Das runde Gebärmutterband zieht den Gebärmutterboden nach vorne und sorgt für seine physiologische Neigung.
Der Fixierapparat (Verankerungsapparat) sichert die Position der Gebärmutter in der Mitte des kleinen Beckens und verhindert praktisch ihre seitliche Verschiebung. Da der Bandapparat jedoch im unteren Bereich von der Gebärmutter abweicht, sind Neigungen der Gebärmutter in verschiedene Richtungen möglich. Der Fixierapparat umfasst Bänder, die sich im lockeren Gewebe des Beckens befinden und sich vom unteren Bereich der Gebärmutter bis zu den seitlichen, vorderen und hinteren Beckenwänden erstrecken: das sakromagische, das Kardinal-, das uterovesikale und das vesikopubische Band.
Neben dem Mesovarium unterscheidet man folgende Eierstockbänder:
- das Aufhängeband des Eierstocks, früher als Infundibulopelvinband bezeichnet. Es handelt sich um eine Falte des Bauchfells, durch die Blutgefäße (a. et v. ovarica) sowie Lymphgefäße und Nerven des Eierstocks verlaufen. Sie ist zwischen der seitlichen Beckenwand, der Lendenfaszie (im Bereich der Unterteilung der Arteria iliaca communis in äußere und innere) und dem oberen (Tuben-)Ende des Eierstocks gespannt.
- Das Ligamentum proprio des Eierstocks verläuft zwischen den Blättern des Ligamentum uteri latum, näher am hinteren Blatt, und verbindet das untere Ende des Eierstocks mit dem seitlichen Rand der Gebärmutter. Das Ligamentum proprio des Eierstocks ist zwischen dem Beginn des Eileiters und dem runden Band, dahinter und darüber, an der Gebärmutter befestigt. In der Dicke des Bandes verlaufen die rr. ovarii, die Endäste der Gebärmutterarterie;
- Ligamentum appendikulär-ovariell. Das Ligament verläuft vom Mesenterium des Blinddarms zum rechten Eierstock oder zum Ligamentum latum der Gebärmutter in Form einer Peritoneumfalte. Das Ligament ist inkonsistent und tritt bei der Hälfte bis einem Drittel aller Frauen auf.
Der Stützapparat wird durch die Muskeln und Faszien des Beckenbodens dargestellt, die in eine untere, mittlere und obere (innere) Schicht unterteilt sind.
Die kräftigste Muskelschicht ist die obere (innere) Schicht, die durch den paarigen Muskel dargestellt wird, der den After anhebt. Sie besteht aus Muskelbündeln, die sich fächerartig vom Steißbein in drei Richtungen (Musculus pubococcygeus, Musculus iliococcygeus und Musculus ischiococcygeus) zu den Beckenknochen ausbreiten. Diese Muskelschicht wird auch als Beckenboden bezeichnet.
Die mittlere Muskelschicht befindet sich zwischen Symphyse, Schambein und Sitzbein. Die mittlere Muskelschicht – das Urogenitaldiaphragma – nimmt die vordere Hälfte des Beckenausgangs ein, durch die Harnröhre und Vagina verlaufen. Im vorderen Abschnitt zwischen seinen Blättern befinden sich Muskelbündel, die den äußeren Schließmuskel der Harnröhre bilden, im hinteren Abschnitt befinden sich Muskelbündel, die in Querrichtung verlaufen – der tiefe Quermuskel des Perineums.
Die untere (äußere) Schicht der Beckenbodenmuskulatur besteht aus oberflächlichen Muskeln, deren Form der Zahl 8 ähnelt. Dazu gehören der Bulbocavernosus-, der Ischiocavernus-, der äußere Analsphinkter und der oberflächliche transversale Dammmuskel.
Ontogenese der Eierstöcke
Der Prozess des Follikelwachstums und der Atresie beginnt in der 20. Schwangerschaftswoche. Zum Zeitpunkt der Geburt verbleiben bis zu 2 Millionen Eizellen in den Eierstöcken des Mädchens. Bis zur Menarche sinkt ihre Zahl auf 300.000. Während der gesamten reproduktiven Phase erreichen nicht mehr als 500 Follikel die Reife und den Eisprung. Das anfängliche Follikelwachstum ist unabhängig von der FSH-Stimulation, ist begrenzt und es kommt schnell zur Atresie. Es wird angenommen, dass anstelle von Steroidhormonen lokale autokrine/parakrine Peptide die Hauptregulatoren des Wachstums und der Atresie der primären Follikel sind. Es wird angenommen, dass der Prozess des Follikelwachstums und der Atresie nicht durch physiologische Prozesse unterbrochen wird. Dieser Prozess setzt sich in jedem Alter fort, einschließlich der intrauterinen Phase und der Menopause, und wird durch Schwangerschaft, Eisprung und Anovulation unterbrochen. Der Mechanismus, der das Follikelwachstum und ihre Anzahl in jedem spezifischen Zyklus auslöst, ist noch unklar.
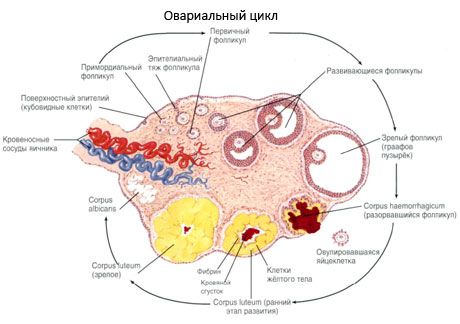
Während seiner Entwicklung durchläuft der Follikel mehrere Entwicklungsstadien. Urkeimzellen entstehen aus dem Endoderm des Dottersacks, der Allantois, und wandern in der 5.–6. Schwangerschaftswoche in den Genitalbereich des Embryos. Durch die schnelle mitotische Teilung, die von der 6.–8. bis zur 16.–20. Schwangerschaftswoche andauert, bilden sich in den Eierstöcken des Embryos bis zu 6–7 Millionen Eizellen, umgeben von einer dünnen Schicht Granulosazellen.
Präantraler Follikel – Die Eizelle ist von einer Membran (Zona pellucida) umgeben. Die die Eizelle umgebenden Granulosazellen beginnen zu proliferieren; ihr Wachstum hängt von Gonadotropinen ab und korreliert mit dem Östrogenspiegel. Granulosazellen sind das Ziel von FSH. Im präantralen Follikelstadium sind Granulosazellen in der Lage, drei Klassen von Steroiden zu synthetisieren: Es induziert vorwiegend die Aktivität der Aromatase, des Hauptenzyms, das Androgene in Estradiol umwandelt. Es wird angenommen, dass Estradiol die Anzahl seiner eigenen Rezeptoren erhöhen und so unabhängig von FSH eine direkte mitogene Wirkung auf Granulosazellen ausüben kann. Es gilt als parakriner Faktor, der die Wirkung von FSH verstärkt, einschließlich der Aktivierung von Aromatisierungsprozessen.
FSH-Rezeptoren erscheinen auf den Membranen von Granulosazellen, sobald das Follikelwachstum beginnt. Eine Abnahme oder Zunahme von FSH führt zu einer Veränderung der Anzahl seiner Rezeptoren. Diese Wirkung von FSH wird durch Wachstumsfaktoren moduliert. FSH wirkt über das G-Protein, das Adenylatcyclase-System. Obwohl die Steroidogenese im Follikel hauptsächlich durch FSH reguliert wird, sind viele Faktoren an diesem Prozess beteiligt: Ionenkanäle, Tyrosinkinase-Rezeptoren und das Phospholipase-System der sekundären Botenstoffe.
Die Rolle von Androgenen in der frühen Follikelentwicklung ist komplex. Granulosazellen besitzen Androgenrezeptoren. Diese dienen nicht nur als Substrat für die FSH-induzierte Aromatisierung zu Östrogenen, sondern können die Aromatisierung in niedrigen Konzentrationen auch verstärken. Steigen die Androgenspiegel, wählen präantrale Granulosazellen bevorzugt nicht den Aromatisierungsweg zu Östrogenen, sondern den einfacheren Androgenweg über 5α-Reduktase, um sich in ein Androgen umzuwandeln, das nicht in Östrogen umgewandelt werden kann. Dadurch wird die Aromataseaktivität gehemmt. Dieser Prozess hemmt auch die Bildung von FSH- und LH-Rezeptoren und stoppt so die Follikelentwicklung.
Während des Aromatisierungsprozesses durchläuft der Follikel mit hohem Androgenspiegel Atresieprozesse. Das Wachstum und die Entwicklung des Follikels hängen von seiner Fähigkeit ab, Androgene in Östrogene umzuwandeln.
In Gegenwart von FSH sind Östrogene die dominierende Substanz der Follikelflüssigkeit. In Abwesenheit von FSH - Androgene. LH fehlt normalerweise bis zur Zyklusmitte in der Follikelflüssigkeit. Sobald der LH-Spiegel ansteigt, nimmt die mitotische Aktivität der Granulosazellen ab, es treten degenerative Veränderungen auf und der Androgenspiegel im Follikel steigt an. Der Steroidspiegel in der Follikelflüssigkeit ist höher als im Plasma und spiegelt die funktionelle Aktivität der Eierstockzellen wider: Granulosa- und Thekazellen. Wenn Granulosazellen das einzige Ziel von FSH sind, hat LH viele Ziele - Thekazellen, Stroma- und Luteinzellen sowie Granulosazellen. Sowohl Granulosa- als auch Thekazellen besitzen die Fähigkeit zur Steroidogenese, jedoch überwiegt in Granulosazellen die Aromataseaktivität.
Als Reaktion auf LH produzieren Thekazellen Androgene, die dann von Granulosazellen durch FSH-induzierte Aromatisierung in Östrogene umgewandelt werden.
Während der Follikel wächst, beginnen Thekazellen, Gene für LH-Rezeptoren, P450 sec und 3beta-Hydroxysteroid-Dehydrogenase zu exprimieren. Der insulinähnliche Wachstumsfaktor (IGF-1) erhöht synergistisch mit LH die Genexpression, stimuliert jedoch nicht die Steroidogenese.
Die ovarielle Steroidogenese ist stets LH-abhängig. Während der Follikel wächst, exprimieren Thekazellen das Enzym P450c17, das aus Cholesterin Androgene bildet. Granulosazellen besitzen dieses Enzym nicht und sind auf Thekazellen angewiesen, um aus Androgenen Östrogene zu produzieren. Im Gegensatz zur Steroidogenese ist die Follikulogenese FSH-abhängig. Mit dem Wachstum des Follikels und steigendem Östrogenspiegel wird ein Rückkopplungsmechanismus aktiviert – die FSH-Produktion wird gehemmt, was wiederum zu einer Abnahme der Aromataseaktivität des Follikels und schließlich zur Follikelatresie durch Apoptose (programmierter Zelltod) führt.
Der Rückkopplungsmechanismus von Östrogenen und FSH hemmt die Entwicklung bereits zu wachsender Follikel, nicht jedoch des dominanten Follikels. Der dominante Follikel enthält mehr FSH-Rezeptoren, die die Proliferation von Granulosazellen und die Aromatisierung von Androgenen zu Östrogenen unterstützen. Darüber hinaus fungieren die parakrinen und autokrinen Signalwege als wichtige Koordinatoren der antralen Follikelentwicklung.
Der autokrine/parakrine Regulator besteht aus Peptiden (Inhibin, Activin, Follistatin), die von Granulosazellen als Reaktion auf FSH synthetisiert werden und in die Follikelflüssigkeit gelangen. Inhibin reduziert die FSH-Sekretion; Activin stimuliert die FSH-Freisetzung aus der Hypophyse und verstärkt die FSH-Wirkung im Ovar; Follistatin unterdrückt die FSH-Aktivität, möglicherweise durch Bindung von Activin. Nach dem Eisprung und der Entwicklung des Gelbkörpers steht Inhibin unter der Kontrolle von LH.
Das Wachstum und die Differenzierung von Eierstockzellen werden durch insulinähnliche Wachstumsfaktoren (IGE) beeinflusst. IGF-1 wirkt auf Granulosazellen und verursacht einen Anstieg von zyklischem Adenosinmonophosphat (cAMP), Progesteron, Oxytocin, Proteoglykan und Inhibin.
IGF-1 wirkt auf Thekazellen und führt zu einer erhöhten Androgenproduktion. Thekazellen wiederum produzieren den Tumornekrosefaktor (TNF) und den epidermalen Wachstumsfaktor (EGF), die ebenfalls durch FSH reguliert werden.
EGF stimuliert die Proliferation von Granulosazellen. IGF-2 ist der Hauptwachstumsfaktor in der Follikelflüssigkeit. Darüber hinaus kommen IGF-1, TNF-α, TNF-3 und EGF darin vor.
Eine Störung der parakrinen und/oder autokrinen Regulierung der Eierstockfunktion scheint bei Ovulationsstörungen und der Entwicklung polyzystischer Eierstöcke eine Rolle zu spielen.
Mit dem Wachstum des Antralfollikels steigt der Östrogengehalt in der Follikelflüssigkeit. Auf dem Höhepunkt ihres Anstiegs erscheinen Rezeptoren für LH auf den Granulosazellen, es kommt zur Luteinisierung der Granulosazellen und die Progesteronproduktion nimmt zu. So führt in der präovulatorischen Phase eine erhöhte Östrogenproduktion zur Bildung von LH-Rezeptoren, LH wiederum zur Luteinisierung der Granulosazellen und zur Progesteronproduktion. Ein Anstieg des Progesterons senkt den Östrogenspiegel, was offenbar einen zweiten FSH-Peak in der Zyklusmitte verursacht.
Der Eisprung erfolgt vermutlich 10–12 Stunden nach dem LH-Peak und 24–36 Stunden nach dem Östradiol-Peak. LH stimuliert vermutlich die Reduktionsteilung der Eizelle, die Luteinisierung der Granulosazellen sowie die Synthese von Progesteron und Prostaglandin im Follikel.
Progesteron verstärkt die Aktivität proteolytischer Enzyme, die zusammen mit Prostaglandin am Bruch der Follikelwand beteiligt sind. Der durch Progesteron induzierte FSH-Spitzenwert ermöglicht der Eizelle den Austritt aus dem Follikel durch die Umwandlung von Plasminogen in das proteolytische Enzym Plasmin und stellt eine ausreichende Anzahl von LH-Rezeptoren für die normale Entwicklung der Lutealphase bereit.
Innerhalb von drei Tagen nach dem Eisprung vergrößern sich die Granulosazellen und es bilden sich charakteristische, mit dem Pigment Lutein gefüllte Vakuolen. Theka-luteale Zellen differenzieren sich von Theka und Stroma und werden Teil des Gelbkörpers. Unter dem Einfluss von Angiogenesefaktoren entwickeln sich die in den Gelbkörper eindringenden Kapillaren sehr schnell, und mit der verbesserten Gefäßbildung steigt die Produktion von Progesteron und Östrogenen. Der LH-Spiegel bestimmt die Aktivität der Steroidogenese und die Lebensdauer des Gelbkörpers. Der Gelbkörper ist kein homogenes Zellgebilde. Neben zwei Arten von Gelbkörperzellen enthält er Endothelzellen, Makrophagen, Fibroblasten usw. Große Gelbkörperzellen produzieren Peptide (Relaxin, Oxytocin) und sind bei der Steroidogenese aktiver als kleine Zellen und weisen eine höhere Aromataseaktivität und Progesteronsynthese auf.
Der Progesteron-Höchstwert wird am achten Tag nach dem LH-Höchstwert erreicht. Es ist bekannt, dass Progesteron und Östradiol in der Lutealphase episodisch in Korrelation mit der pulsierenden LH-Produktion sezerniert werden. Mit der Bildung des Gelbkörpers geht die Kontrolle der Inhibinproduktion von FSH auf LH über. Inhibin steigt mit dem Anstieg des Östradiols vor dem LH-Höchstwert an und steigt auch nach dem LH-Höchstwert weiter an, obwohl der Östrogenspiegel sinkt. Obwohl Inhibin und Östradiol von Granulosazellen sezerniert werden, werden sie über unterschiedliche Mechanismen reguliert. Der Inhibin-Abfall am Ende der Lutealphase trägt zum Anstieg des FSH im nächsten Zyklus bei.
Der Gelbkörper nimmt sehr schnell ab – am 9.-11. Tag nach dem Eisprung.
Der Mechanismus der Degeneration ist unklar und hat weder mit der luteolytischen Rolle der Östrogene noch mit einem rezeptorbezogenen Mechanismus, wie er im Endometrium beobachtet wurde, zu tun. Für die Rolle der vom Corpus luteum produzierten Östrogene gibt es eine andere Erklärung. Bekanntlich werden Östrogene für die Synthese von Progesteronrezeptoren im Endometrium benötigt. Lutealphasenöstrogene sind wahrscheinlich für Progesteron-bedingte Veränderungen im Endometrium nach dem Eisprung erforderlich. Eine unzureichende Entwicklung von Progesteronrezeptoren infolge eines unzureichenden Östrogenspiegels ist möglicherweise ein zusätzlicher Mechanismus für Unfruchtbarkeit und frühe Fehlgeburten, eine weitere Form der Lutealphaseninsuffizienz. Man nimmt an, dass die Lebensdauer des Corpus luteum zum Zeitpunkt des Eisprungs festgelegt wird. Und es bildet sich mit Sicherheit zurück, wenn es aufgrund einer Schwangerschaft nicht durch humanes Choriongonadotropin unterstützt wird. Somit führt eine Rückbildung des Corpus luteum zu einer Abnahme der Estradiol-, Progesteron- und Inhibinspiegel. Ein Rückgang von Inhibin hebt dessen unterdrückende Wirkung auf FSH auf; ein Rückgang von Estradiol und Progesteron ermöglicht eine sehr schnelle Wiederherstellung der GnRH-Sekretion und die Beseitigung des Rückkopplungsmechanismus der Hypophyse. Ein Rückgang von Inhibin und Estradiol, zusammen mit einem Anstieg von GnRH, führt zu einem Anstieg von FSH gegenüber LH. Ein Anstieg von FSH führt zu Follikelwachstum mit anschließender Selektion eines dominanten Follikels, und wenn keine Schwangerschaft eintritt, beginnt ein neuer Zyklus. Steroidhormone spielen eine führende Rolle in der Reproduktionsbiologie und der allgemeinen Physiologie. Sie bestimmen den menschlichen Phänotyp, beeinflussen das Herz-Kreislauf-System, den Knochenstoffwechsel, die Haut, das allgemeine Wohlbefinden und spielen eine Schlüsselrolle bei einer Schwangerschaft. Die Wirkung von Steroidhormonen spiegelt die intrazellulären und genetischen Mechanismen wider, die notwendig sind, um ein extrazelluläres Signal an den Zellkern zu übertragen und eine physiologische Reaktion auszulösen.
Östrogene dringen diffus in die Zellmembran ein und binden an Rezeptoren im Zellkern. Der Rezeptor-Steroid-Komplex bindet dann an die DNA. In Zielzellen führen diese Interaktionen zur Genexpression, Proteinsynthese und spezifischen Zell- und Gewebefunktionen.


 [
[