Facharzt des Artikels
Neue Veröffentlichungen
Malaria
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Malaria (engl. malaria; frz. paludisme) ist eine akute, durch Menschen übertragene Protozoenerkrankung mit übertragbarem Infektionsmechanismus, die durch ausgeprägte Vergiftungserscheinungen, einen zyklischen Verlauf mit abwechselnden Fieberschüben und Phasen der Fieberlosigkeit, eine Vergrößerung von Milz und Leber, die Entwicklung einer hämolytischen Anämie mit progradientem Verlauf sowie Krankheitsschübe gekennzeichnet ist.
Epidemiologie
Die Quelle des Infektionserregers ist eine erkrankte Person oder ein Parasitenträger, dessen Blut Gametozyten enthält. Malaria ist eine übertragbare Infektion, die durch einen Mückenstich übertragen wird. Gametozyten von P. vivax, P. ovale und P. malariae finden sich in den ersten Krankheitstagen im Blut; ihre Anzahl steigt nach mehreren Zyklen erythrozytärer Schizogonie an. Bei einer Infektion mit P. falciparum wird eine Person 10–12 Tage nach Beginn der Parasiteninfektion zur Infektionsquelle und kann dies für zwei Monate oder länger bleiben.
Bei Malaria sind verschiedene Mechanismen der Infektionsübertragung möglich:
Übertragungsmechanismus (Mückenstich)
Dieser Mechanismus ist der wichtigste, der die Existenz von Plasmodien als biologische Spezies sicherstellt. Infektionsquelle ist ein Mensch (Malariakranker oder Parasitenträger), in dessen Blut sich reife Gametozyten (männliche und weibliche Keimzellen des Parasiten) befinden. Malariaüberträger sind ausschließlich weibliche Mücken der Gattung Anopheles.
Im Magen der Mücke, wo die männlichen und weiblichen Gametozyten in den Erythrozyten zusammen mit dem Blut eindringen, kommt es nach der Lyse der Erythrozyten zu ihrer weiteren Reifung, Verschmelzung und Mehrfachteilung unter Bildung von Sporozoiten, die sich in den Speicheldrüsen der Mücke ansammeln. Asexuelle Formen des Parasiten (Trophozoiten, Schizonten) sterben nach dem Eindringen in den Magen der Mücke ab.
So findet im menschlichen Körper ein ungeschlechtlicher Verlauf der Parasitenentwicklung (Schizogonie) mit Bildung und Ansammlung von Gametozyten statt, und im Körper der Mücke findet ein geschlechtlicher Verlauf (Sporogonie) statt, bei dem es zur Verschmelzung männlicher und weiblicher Gametozyten mit ihrer weiteren Entwicklung und Bildung von Sporozoiten kommt.
 [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
[ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
Vertikaler Übertragungsmechanismus
Vertikaler Übertragungsmechanismus (von der Mutter zum Fötus) oder von der Mutter zum Neugeborenen (während der Geburt - parenteraler Mechanismus). Bei vertikaler Übertragung wird der Fötus selten über die Plazenta infiziert. Häufiger tritt eine Infektion während der Geburt auf, wenn eine bestimmte Menge mütterlichen Blutes in den Blutkreislauf des Neugeborenen gelangt, in dessen Erythrozyten sich asexuelle Formen des Parasiten befinden.
Parenteraler Übertragungsmechanismus
Der parenterale Infektionsmechanismus führt zur Entwicklung der sogenannten Schizontenmalaria. Sie tritt bei Bluttransfusionen oder seltener bei Verletzungen der Asepsis bei Injektionen auf (z. B. bei Drogenabhängigen, die dieselbe Spritze verwenden). Im Falle einer Infektion während einer Bluttransfusion ist die Infektionsquelle ein Spender-Parasitenträger, oft mit sublatenter Parasitenämie (die Anzahl der Parasiten beträgt weniger als fünf in einem μl Blut). Daher ist es in Regionen der Welt, in denen Malaria endemisch ist, notwendig, neben parasitologischen Methoden (Nachweis des Parasiten in dicken Tropfenpräparaten und Blutausstrichen) auch serologische (immunologische) Methoden der Labordiagnostik von Malaria (RNIF, ELISA usw.) zur Kontrolle des Spenderbluts anzuwenden. Wenn man bedenkt, dass bei einer parenteralen Infektion in der Regel nur wenige Parasiten eingeschleppt werden (insbesondere bei Injektionen), kann sich die Inkubationszeit auf 3 Monate verlängern (bei einer massiven Infektion kann die Inkubationszeit dagegen sehr kurz sein – mehrere Tage), was bei der Diagnose von Malaria bei Patienten, die sich einer Operation unterzogen haben, und Drogenabhängigen wichtig zu wissen ist.
Bedingungen der Malariaverbreitung
Damit sich Malaria in einer bestimmten Region (Land, Territorium, Gebiet) ausbreiten kann, sind folgende Bedingungen erforderlich:
- Infektionsquelle (ein Patient mit Malaria oder ein Parasitenträger).
- Das Vorhandensein eines wirksamen Überträgers (Mücken der Gattung Anopheles). Die Anfälligkeit für Malariaparasiten ist die Haupteigenschaft einer bestimmten Mückenart der Gattung Anopheles. Die Anzahl der Mücken der Gattung Anopheles in Populationen anderer Arten ist geringer als bei Nicht-Malariamücken, und sie stechen selten ernsthaft. Aber auch kleine Arten können unter anderen günstigen Umständen (Nähe von Mückenbrutstätten zu menschlichen Behausungen) eine ernstzunehmende Rolle spielen. Mehr als 70 Mückenarten der Gattung Anopheles (von über 200 bekannten Arten) können als wirksame Überträger von Malaria dienen.
- Günstige klimatische Bedingungen: durchschnittliche Tagestemperatur über 16 °C und Vorhandensein von Brutstätten für Mücken: Gewässer, Wasserreservoirs, Bewässerungsanlagen usw. Die für die Entwicklung im Körper der Mücke Pl. vivax erforderliche minimale durchschnittliche Tagestemperatur beträgt 16 °C, die von Pl. falciparum 18 °C, bei niedrigeren Temperaturen tritt keine Sporogonie auf. Die Dauer der Sporogonie ist umso kürzer, je höher die Temperatur ist (bis zu einem bestimmten Niveau, da eine durchschnittliche Tagestemperatur von 30 °C und mehr für die Sporogonie ungünstig ist). Bei einer optimalen durchschnittlichen Tagestemperatur (25–26 °C) dauert die Sporogonie bei Pl. vivax 8–9 Tage, bei Pl. falciparum 10–11 Tage.
Das gesamte Verbreitungsgebiet der Malaria auf der Erde (zwischen 45° N und 40° S bis 64° N und 45° S in verschiedenen Jahren) wird von der Malaria tertiana eingenommen. Die Gebiete der Malaria falciparum und der Malariae malariae sind aufgrund der höheren Temperatur, die für eine effektive Sporogonie erforderlich ist, etwas kleiner; das Gebiet der Malaria ovale erstreckt sich über zwei Regionen, die territorial nicht miteinander verbunden sind: das tropische Afrika und die Staaten des westlichen Teils des Pazifischen Ozeans (Indonesien, Vietnam, die Philippinen, Neuguinea usw.). In Gebirgsländern können sich Malariaherde in Höhen von bis zu 1000 m in der gemäßigten Klimazone und bis zu 1500-2500 m in der subtropischen und tropischen Zone bilden, wobei in großen Höhen (1000-1500 m und höher) nur Herde der Malaria tertiana auftreten.
Malaria ist durch eine ausgeprägte Saisonalität gekennzeichnet. In gemäßigten und subtropischen Klimazonen ist die Malariasaison in Perioden effektiver Mückeninfektion, Infektionsübertragung und Massenmanifestationen der Krankheit unterteilt. Der Beginn der Periode effektiver Mückeninfektion (bei Vorhandensein einer Infektionsquelle – Patienten, Parasitenträger) fällt mit dem Zeitpunkt eines stabilen Anstiegs der durchschnittlichen Tagestemperatur auf 16 °C zusammen. Der Beginn der Übertragungsperiode ist mit dem Abschluss der Sporogonie im Körper der Mücke verbunden, was von den spezifischen durchschnittlichen Tagestemperaturen eines bestimmten Jahres abhängt. In der Region Moskau kann die Übertragungsperiode der Malaria tertiana 1,5–2 Monate oder mehr bis zu den ersten Herbstfrösten betragen. Die Grenzen der Periode der Massenmanifestationen sind weniger klar definiert. In Herden, in denen Malaria nur drei Tage lang übertragen wird, kann die Massenmorbidität lange vor Beginn der Übertragungsperiode einsetzen. Bei den beobachteten Fällen handelt es sich um primäre Manifestationen der Malaria tertiana mit einer langen Inkubationszeit (3–10 Monate) aufgrund einer Infektion in der vorherigen Saison und der Erhaltung von Hypnozoiten in der Leber (ohne primäre Manifestationen mit einer kurzen Inkubationszeit) sowie um entfernte exoerythrozytäre Rückfälle (nach einer Reihe von Malariaanfällen mit einer kurzen Inkubationszeit in der vorherigen Saison, ohne ausreichende Anti-Rückfall-Therapie).
Die Anfälligkeit für Malaria ist universell. Der Ausgang der Infektion nach Eintritt des Erregers in die Blutbahn und der klinische Verlauf der Erkrankung werden durch den individuellen Immunstatus, die Aktivität unspezifischer angeborener Resistenzfaktoren, die Intensität der postinfektiösen Immunität und bei Neugeborenen durch die Menge spezifischer Antikörper der Klasse G der Mutter bestimmt. Eine Ausnahme bilden die Ureinwohner Westafrikas und Neuguineas, die weitgehend immun gegen eine Infektion mit Pl. vivax sind. Dies ist auf das genetisch bedingte Fehlen von Erythrozyten-Isoantigenen der Duffy-Gruppe zurückzuführen, die als Rezeptoren für Pl. vivax-Merozoiten fungieren. Dementsprechend sind Infektionen mit Vivax-Malaria in dieser Region deutlich seltener als in anderen Regionen des tropischen Afrikas.
Menschen mit abnormalem Hämoglobin (Thalassämie, Sichelzellenanämie, Hämoglobin E, C usw.), mit Anomalien in der Struktur des Erythrozytenzytoskeletts (hereditäre Sphärozytose, südöstliche Ovalozytose, hereditäre Elliptozytose) oder mit einem Mangel des Enzyms Glucose-6-phosphat-Dehydrogenase der Erythrozyten weisen eine relative Resistenz gegen Infektionen mit allen Arten von Plasmodien auf. Im Falle einer Malariainfektion verlaufen sie leicht, die Anzahl der Parasiten im Blut bleibt relativ gering, und Fälle von malignem Verlauf (zerebrale Malaria - falciparum) treten praktisch nicht auf. Andererseits besteht bei Menschen mit einem Mangel an Glucose-6-phosphat-Dehydrogenase das Risiko, bei der Anwendung einer Reihe von Malariamedikamenten (Primaquin, Chinin usw.) eine akute Hämolyse zu entwickeln. Die Mechanismen der natürlichen Resistenz gegen verschiedene Malariaarten sind noch weitgehend unklar und werden weiterhin untersucht.
Neugeborene verfügen zudem über eine gewisse Resistenz gegen alle Formen der Malaria. Dies ist auf folgende Faktoren zurückzuführen:
- das Vorhandensein einer passiven Immunität aufgrund von Antikörpern der Klasse G, die das Neugeborene von einer hyperimmunen Mutter erhalten hat (in Gebieten mit einer hohen Malaria-Inzidenz);
- Aufrechterhaltung der spezifischen Immunität nach der Geburt aufgrund von Antikörpern der Klasse A, die das Neugeborene mit der Muttermilch erhält;
- das Vorhandensein von fetalem Hämoglobin beim Neugeborenen, das für die Ernährung des Malariaparasiten kaum von Nutzen ist.
Nach den ersten drei bis sechs Lebensmonaten besteht bei Neugeborenen ein deutlich erhöhtes Risiko, an schweren, bösartigen Formen der Malaria tropica zu erkranken (Umwandlung der roten Blutkörperchen mit fetalem Hämoglobin in rote Blutkörperchen mit normalem Hämoglobin; Umstellung auf Mischernährung – Aufnahme von Para-Aminobenzoesäure, die für die Entwicklung des Parasiten notwendig ist und in der Muttermilch nicht vorkommt).
 [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 10 ], [ 11 ], [ 12 ], [ 13 ]
Immunität bei Malaria
Die Immunität gegen Malaria ist unsteril, spezies- und stammspezifisch, instabil und kurzlebig. Um das schützende Antikörperniveau aufrechtzuerhalten, ist eine ständige Antigenstimulation in Form wiederholter Malariainfektionen notwendig. Die Immunität gegen Pl. malariae und Pl. vivax wird früher aufgebaut und hält länger an als gegen Pl. falciparum. Die antimalariatische Immunität umfasst zelluläre und humorale Reaktionen. Die Immunprozesse, die die Antikörpersynthese stimulieren, beginnen mit der Phagozytose von Malariaparasiten durch Makrophagen. Dies manifestiert sich in einer Hyperplasie des histiophagozytischen Systems von Milz, Leber und Knochenmark.
Prävalenz von Malaria
Von den vier Arten menschlicher Malariaerreger ist P. vivax die weltweit am häufigsten vorkommende. In den Subtropen und Tropen überwiegen Sporozoiten im Genpool der P. vivax-Population. Sie lösen die Erkrankung nach kurzer Inkubationszeit (10–21 Tage) aus. Auf dem afrikanischen Kontinent kommt P. vivax in den Ländern Ostafrikas häufig unter Arabern, Indern, Äthiopiern und Europäern vor. In den überwiegend von Negroiden bewohnten Ländern Westafrikas kommt P. vivax nicht vor, was durch die genetisch bedingte angeborene Immunität afrikanischer Schwarzer gegen P. vivax erklärt wird [Erythrozyten fehlt ein Rezeptor für P. vivax-Merozoiten – Duffy-Isoantigene (Fy d oder Fy b )]. Das Verbreitungsgebiet von P. ovale ist klein und besteht aus zwei Teilen. Der afrikanische Hauptteil nimmt das tropische Afrika von Gambia im Norden bis Kongo im Süden des Kontinents ein. Der zweite Teil des Verbreitungsgebiets umfasst die Länder des Westpazifiks und Südostasiens. Das geografische Verbreitungsgebiet der tropischen Malaria erstreckt sich bis zum 40. nördlichen und 20. südlichen Breitengrad. P. falciparum verursacht bis zu 50 % der Malariafälle weltweit. Vier-Tage-Malaria kommt derzeit in Afrika, einigen Gebieten Mittel- und Südamerikas sowie der Karibik und Südostasiens vor.
Die meisten Menschen sind anfällig für Malaria. Eine Ausnahme bildet die indigene Bevölkerung Westafrikas. Hyperendemische Gebiete im tropischen Afrika, in denen P. falciparum vorherrscht, zeichnen sich durch eine relativ stabile Immunstruktur der indigenen Bevölkerung aus:
- Kinder unter 6 Monaten erkranken aufgrund der passiven Immunität der Mutter nicht:
- Die meisten Kinder im Alter von 6 bis 24 Monaten sind mit P. falciparum infiziert; die passive Immunität ist geschwächt, die aktive Immunität hat sich noch nicht entwickelt; diese Gruppe weist die höchste Sterblichkeitsrate durch Malaria auf:
- Bei Kindern über 2 Jahren wird P. falciparum seltener nachgewiesen, der Verlauf der Malaria ist aufgrund der erworbenen Immunität gemildert und die Intensität der Parasitenbefall nimmt mit zunehmendem Alter ab:
- Bei Erwachsenen wird P. falciparum aufgrund der hohen Immunspannung selten nachgewiesen; bei einer Infektion treten keine klinischen Manifestationen auf.
Tropische Malaria wird auch von Trägern von abnormalem Hämoglobin S (Sichelzellenanämie) und Menschen mit bestimmten anderen genetisch bedingten Anomalien des Hämoglobins und der roten Blutkörperchenenzyme (G-6-PDH-Mangel) gut vertragen.
Geschichte der Malariaforschung
Die Erforschung der Malaria (eine der ältesten menschlichen Krankheiten) ist untrennbar mit der Geschichte der menschlichen Zivilisation verbunden. Es wird angenommen, dass sich Malaria vor etwa 10.000 Jahren aufgrund der intensiven Entwicklung von Landwirtschaft, Handel und der Erforschung neuer Länder auf der Erde (aus dem afrikanischen Mittelmeerraum) auszubreiten begann. In altägyptischen Papyri, der altchinesischen Literatur und den Kanonen der klassischen altindischen Medizin (Ayurveda) sind Beschreibungen des Krankheitsbildes und der Malaria-Epidemien bis heute überliefert; schon damals wurde ein möglicher Zusammenhang zwischen der Entstehung der Krankheit und Mückenstichen vermutet. Später (5.-6. Jahrhundert v. Chr.) beschrieben altgriechische Ärzte wie Hippokrates, Heradot und Empedokles das Krankheitsbild der Malaria ausführlich. Hippokrates wird die Unterscheidung zwischen Malaria und der Gruppe der Fieberkrankheiten zugeschrieben. Er schlug vor, drei Formen der Krankheit zu unterscheiden: „quotidian“ (tägliche Anfälle), „tertian“ (Anfälle jeden zweiten Tag) und „quartan“ (Anfälle alle zwei Tage).
Der Beginn der Ära wissenschaftlicher Entdeckungen in der Malariaforschung geht auf das Jahr 1640 zurück, als der spanische Arzt und Konquistador Juan del Vego erstmals einen Aufguss aus Chinarinde zur Behandlung von Malariapatienten verwendete, der zuvor von den Indianern Perus und Ecuadors als fiebersenkendes Mittel verwendet wurde. Die Namensgebung der Krankheit „Malaria“ (italienisch: „mal aria“ – schlechte Luft) geht auf den Italiener Lancisi (1717) zurück, der die Ansteckung von Menschen mit Malaria durch „giftige“ Dämpfe aus Sümpfen in Verbindung brachte. 1880 beschrieb der in Algerien tätige französische Arzt A. Laveran detailliert die Morphologie des Malariaerregers. 1897 stellte der englische Militärarzt Ronald Ross in Indien den Übertragungsmechanismus der Malaria fest.
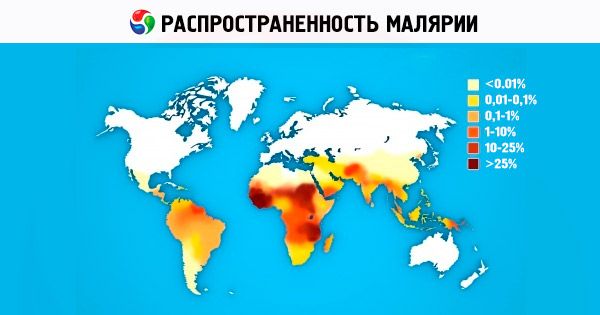
Malaria ist derzeit in über 100 Ländern Afrikas, Asiens und Südamerikas eines der schwerwiegendsten Gesundheitsprobleme. Etwa die Hälfte der Weltbevölkerung ist gefährdet, an Malaria zu erkranken. Fast alle Länder Europas und Nordamerikas registrieren jährlich Hunderte importierter Malariafälle bei Menschen, die aus weit verbreiteten Regionen einreisen. Die Zahl der sogenannten Flughafenmalaria-Fälle nimmt zu. Laut WHO erkranken weltweit jährlich 200 bis 250 Millionen Menschen an Malaria. Mindestens 80 % aller Malariafälle werden in afrikanischen Ländern südlich der Sahara registriert. Jährlich sterben 1 bis 2 Millionen Menschen an Malaria, hauptsächlich Kinder unter 5 Jahren. Die sozialen und wirtschaftlichen Verluste allein in Afrika werden auf 2 Milliarden US-Dollar pro Jahr geschätzt. Seit 1998 wird unter der Schirmherrschaft der WHO, der Weltbank und UNICEF ein wissenschaftlich-praktisches Programm (Roll Back Malaria Initiative) zur Malariabekämpfung (vor allem in Entwicklungsländern) umgesetzt. Die Laufzeit des Programms ist für den Zeitraum 2010 bis 2015 geplant. Die Entwicklung eines wirksamen Malariaimpfstoffs ist in vollem Gange, wird aber noch mindestens 10–15 Jahre dauern. Die Suche, Entwicklung und Verbesserung von Medikamenten zur Behandlung von Malaria gehört zu den vorrangigen Programmen der WHO, verschiedener Pharmaunternehmen und Forschungsinstitute weltweit. In den letzten Jahren verzeichnete Russland aufgrund zunehmender Migration und der intensiven Entwicklung des internationalen Tourismus einen Anstieg importierter Malariafälle.
Ursachen Malaria
Der Name der Krankheit „Malaria“ verallgemeinert eigentlich vier verschiedene Protozoenerkrankungen, die jeweils durch vier Arten von Krankheitserregern verursacht werden.
Malaria wird durch Parasiten der Gattung Protozoa, Klasse Sporozoa, Familie Plasmodiidae und Gattung Plasmodium verursacht. Vier Arten des Erregers parasitieren den Menschen: P. vivax verursacht Drei-Tage-Malaria, P. malariae verursacht Vier-Tage-Malaria, P. falciparum verursacht tropische Malaria; P. ovale verursacht Drei-Tage-Malaria ovale.
Malaria-Erreger
Erreger |
Form der Malaria (nach ICD-10) |
Plasmodium (Laverania) falciparum |
Malaria verursacht durch Plasmodium falciparum (Falciparum-Malaria) |
Plasmodium (Plasmodium) vivax |
Malaria verursacht durch Plasmodium vivax (Malaria vivax) |
Plasmodium (Plasmodium) ovale |
Malaria verursacht durch Plasmodium ovale (Malaria-ovale) |
Plasmodium (Plasmodium) malariae |
Malaria verursacht durch Plasmodium malariae (Malaria-Malariae) |
In den meisten inländischen Veröffentlichungen (Lehrbücher, Handbücher, Nachschlagewerke) werden die früheren Namen der Malariaformen beibehalten: tropische Malaria (Malaria-falciparum), Dreitage-Malaria (Malaria-vivax), Ovale Malaria (Malaria-ovale) und Viertage-Malaria (Malaria-malariae).
Jede der vier Malariaformen zeichnet sich durch ihre eigenen klinischen, pathogenetischen und epidemiologischen Merkmale aus. Den wichtigsten Platz nimmt die Falciparum-Malaria ein, die 80-90 % aller Malariafälle weltweit ausmacht und deren Erreger zu einer speziellen Untergattung (Laverania) gehört. Nur die Falciparum-Malaria kann bösartig verlaufen und zum Tod führen.
Malariaerreger durchlaufen im Laufe ihres Lebenszyklus folgenden Entwicklungszyklus mit Wirtswechsel:
- Die ungeschlechtliche Entwicklung (Schizogonie) findet im Körper des Zwischenwirts, des Menschen, statt.
- Die sexuelle Entwicklung (Sporogonie) findet im Körper des Endwirts statt, der weiblichen Mücke der Gattung Anopheles.
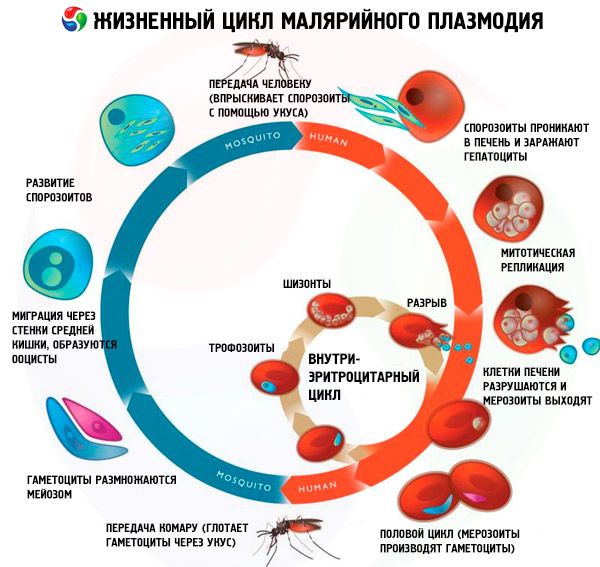
Sporozoiten gelangen durch den Stich einer infizierten Malariamücke in den menschlichen Körper. Nach dem Eintritt ins Blut dringen Sporozoiten innerhalb von 15–45 Minuten aus den Sinusgefäßen der Leber in die Hepatozyten ein und beginnen den exoerythrozytischen Zyklus (Gewebeschizogonie). Die Selektivität und Geschwindigkeit der Invasion beruhen auf dem Vorhandensein spezifischer Rezeptoren auf den Membranen der Hepatozyten. Die Parasiten vergrößern sich, teilen sich wiederholt und bilden viele kleine mononukleäre Gebilde – Merozoiten. Die Mindestdauer des exoerythrozytischen Zyklus beträgt 5–7 Tage für P. falciparum, 6–8 Tage für P. vivax, 9 Tage für P. ovale und 14–16 Tage für P. malariae. Anschließend verlassen die Merozoiten die Hepatozyten ins Blut und dringen in die Erythrozyten ein, wo eine Erythrozytenschizogonie auftritt. Dreitägige und ovale Malaria zeichnen sich durch eine besondere Art der exoerythrozytären Entwicklung aus: Alle Parasiten oder einige von ihnen können lange Zeit (7-14 Monate oder länger) in einem "ruhenden" Zustand (Hypnozoiten) in Hepatozyten verbleiben und beginnen erst nach dieser Zeit, sich in Merozoiten zu verwandeln, die Erythrozyten infizieren können. Dies bestimmt somit die Möglichkeit einer Langzeitinkubation und das Auftreten von Fernrezidiven bis zu 3 Jahren.
Die Erythrozytenschizogonie geht mit einer zyklischen Entwicklung und Mehrfachteilung der Parasiten einher. Malariaplasmodien durchlaufen dabei folgende Stadien: junger Trophozoit (ringförmig); sich entwickelnder Trophozoit; reifer Trophozoit (großer Kern); sich entwickelnder Schizont; reifer Schizont. Nach Abschluss der Schizogonie wird der Erythrozyt zerstört. Freie Merozoiten dringen aktiv in neue Erythrozyten ein, sterben jedoch meist an den Auswirkungen der schützenden Immunmechanismen des Wirtes ab. Die Dauer der Erythrozytenschizogonie beträgt bei P. vivax, P. ovale und P. falciparum 48 Stunden und bei P. malariae 72 Stunden. Während des Erythrozytenzyklus wandeln sich einige Merozoiten in weibliche (Makrogametozyten) oder männliche (Mikrogametozyten) Geschlechtsformen um.
Gametozyten gelangen in den Körper der Mücke, wenn diese sich vom Blut eines Malariapatienten oder Parasitenträgers ernährt. Diese enthalten reife Gametozyten. Im Magen der Mücke stößt der männliche Gametozyt nach 9–12 Minuten acht dünne, bewegliche Flagellen aus. Freie Flagellen (Mikrogameten) dringen in die weibliche Zelle (Makrogameten) ein. Nach der Kernfusion entsteht eine Zygote, eine runde befruchtete Zelle. Anschließend entwickeln sich nacheinander Ookineten, Oozysten mit Sporozoiten; ihre Reifung erfolgt in den Speicheldrüsen der Mücke. Bei optimaler Umgebungstemperatur (25 °C) dauert die Sporogonie bei P. vivax 10 Tage, bei P. falciparum 12 Tage und bei P. malariae und P. ovale 16 Tage. Bei Lufttemperaturen unter 15 °C entwickeln sich keine Sporozoiten.
Krankheitserreger
Pathogenese
Alle Symptome der Malaria werden durch erythrozytäre Schizogonie verursacht – das Wachstum und die Vermehrung ungeschlechtlicher erythrozytärer Formen des Parasiten im Blut. Eine Gewebeschizogonie ist klinisch nicht manifest.
Ein Malariaanfall ist mit dem Abschluss der erythrozytären Schizogonie, dem Massenzerfall von Erythrozyten und dem Eintritt einer großen Anzahl von Merozoiten in das Blut verbunden. Merozoiten sind Stoffwechselprodukte von Parasiten mit pyrogenen und toxischen Eigenschaften, die die Entwicklung einer Fieberreaktion hervorrufen. Aufgrund der zyklischen Natur der erythrozytären Schizogonie wiederholen sich Fieberanfälle bei dreitägiger, ovaler und tropischer Malaria alle 48 Stunden und bei viertägiger Malaria alle 72 Stunden. Wenn eine Person infiziert ist, dringt eine heterogene Population von Malariaparasiten in den Körper ein, und die Schizogonie verläuft in der Anfangsphase asynchron, wodurch die Art des Fiebers unregelmäßig sein kann. Mit der Entwicklung von Immunreaktionen bleibt die Fähigkeit zur Parasitenbesiedlung in Erythrozyten in einer Hauptgeneration von Plasmodien erhalten, die den für diese Art charakteristischen Fieberrhythmus bestimmt. Nur bei der tropischen Malaria können mehrere (2-3) Hauptgenerationen von Plasmodien vorhanden sein, daher ist das Fieber oft unregelmäßig.
Die für Malaria charakteristische Anämie ist eine Folge der Zerstörung roter Blutkörperchen durch darin lebende Parasiten. Es ist bekannt, dass P. vivax und P. ovale hauptsächlich in junge rote Blutkörperchen eindringen, P. malariae in reife. P. falciparum infiziert rote Blutkörperchen unterschiedlichen Reifegrades, was zu deren stärkerer Schädigung und Hämolyse beiträgt. Daher spielt die Hämolyse bei tropischer Malaria eine führende Rolle bei der Entstehung von Anämie. Weitere Faktoren bei der Hämolyse roter Blutkörperchen sind auch Autoimmunmechanismen, die nicht infizierte rote Blutkörperchen schädigen. Eine bei Malaria auftretende Hyperplasie der retikuloendothelialen Elemente der Milz hemmt die Hämatopoese, was zu einer verstärkten Anämie und Thrombozytopenie führt.
Die Vergrößerung von Leber und Milz wird zunächst durch eine Stauung in den Organen verursacht, bald jedoch kommt es dort zu lymphatischer und retikuloendothelialer Hyperplasie. Infolge der Hämolyse der Erythrozyten sowie der Schädigung der Hepatozyten entwickelt sich Gelbsucht. Eine verminderte Kohlenhydrataufnahme und eine Hemmung der Gluconeogenese in der Leber führen zu Hypoglykämie. Die Aktivierung der anaeroben Glykolyse führt zur Ansammlung von Laktat im Blut, im Liquor und zum Auftreten einer Laktatazidose, die eine der Ursachen für schwere tropische Malaria ist.
Bei der tropischen Malaria verändern sich die Eigenschaften der Erythrozyten, was zu einer Störung der Mikrozirkulation führt (Zytoadhäsion, Sequestrierung, Rosettenbildung). Zytoadhäsion ist die Adhäsion infizierter Erythrozyten an Endothelzellen und verursacht die Sequestrierung in Kapillaren und postkapillären Venolen. Die Hauptrolle bei der Zytoadhäsion spielen spezifische Ligandenproteine (deren Expression auf der Oberfläche der Erythrozyten durch den Parasiten induziert wird) und Rezeptoren auf der äußeren Oberfläche der Endothelzellen. Der Verschluss von Blutgefäßen führt zur Ischämie der betroffenen Organe. Auf den Membranen der Erythrozyten bilden sich Ausstülpungen (Knubbel), die mit pseudopodenförmigen Auswüchsen auf Endothelzellen in Kontakt kommen. Einige P. falciparum-Sorten bewirken die Adhäsion gesunder Erythrozyten an infizierten, was zur Bildung von „Rosetten“ führt. Die roten Blutkörperchen versteifen sich, wodurch sich die rheologischen Eigenschaften des Blutes verschlechtern und die Mikrozirkulationsstörung verschlimmert wird. Ein wichtiger schädigender Faktor ist die Hypoxie, die durch den unzureichenden Sauerstofftransport der infizierten roten Blutkörperchen verursacht wird. Das Hirngewebe ist am wenigsten resistent gegen Hypoxie, die zur Entstehung von zerebraler Malaria beiträgt. Es treten Störungen des Blutgerinnungssystems auf: Bei schwerer tropischer Malaria werden Anzeichen eines DIC-Syndroms, Thrombozytopenie und Hypofibrinogenämie beobachtet. Eine gewisse Rolle in der Pathogenese der tropischen Malaria kommt der generalisierten unspezifischen Entzündungsreaktion zu. Gefäßschäden werden hauptsächlich durch die Wirkung von Entzündungsmediatoren verursacht. Am aktivsten sind Lipidperoxidationsprodukte und von Granulozyten abgesonderte Proteasen. In der Pathogenese schwerer Malaria wird den Zytokinen, insbesondere TNF und IL (IL-2 und IL-6), große Aufmerksamkeit geschenkt. Die charakteristischsten Veränderungen bei schwerer tropischer Malaria treten im Gehirn auf. Ödeme, Schwellungen der Hirnsubstanz sowie perivaskuläre und periangliöse Neuroglia-Wucherungen (Durk-Granulome) werden beobachtet. Kapillaren werden durch eingedrungene Erythrozyten und Parasiten blockiert; es kommt zu einer ausgeprägten Hämostase. Es entwickelt sich ein perivaskuläres Ödem mit Blutungen und fokaler Nekrose. Aus dem pathologischen Bild lässt sich schließen, dass sich im Falle eines Malariakomas eine spezifische Meningoenzephalitis entwickelt.
Eine Malariainfektion kann die Immunantwort des Wirtes stören und eine Kaskade immunpathologischer Reaktionen auslösen. Die Fixierung von Immunglobulinen und Komplement an den glomerulären Basalmembranen führt zu einer akuten Nephropathie. Das nephrotische Syndrom, das bei Patienten mit Vier-Tage-Malaria auftritt, wird als Immunkomplex-Glomerulopathie klassifiziert.
Lebenszyklus aller Malaria-Erreger
Der Lebenszyklus aller Malariaerreger umfasst zwei Wirte: den Menschen (Schizogonie – ungeschlechtlicher Entwicklungszyklus) und Mücken der Gattung Anopheles (Sporogonie – geschlechtlicher Entwicklungszyklus).
Traditionell werden im Schizogoniezyklus aller Arten von Malariaparasiten drei Stadien unterschieden: exoerythrozytäre Schizogonie (EESh), erythrozytäre Schizogonie (ESH) und Gametozytogonie. Darüber hinaus wird in den Lebenszyklen von Pl. vivax und Pl. ovale ein separates Stadium unterschieden – der Winterschlaf – aufgrund der möglichen Einführung einer morphologisch heterogenen Gruppe von Sporozoiten (Tachysporozoiten und Bradysporozoiten oder nur Bradysporozoiten) in den menschlichen Körper während eines Mückenstichs. In diesen Fällen bleiben Bradysporozoiten (Hypnozoiten) in Hepatozyten lange Zeit in einem inaktiven Zustand erhalten, bis das EES einsetzt.
 [ 19 ], [ 20 ], [ 21 ], [ 22 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ]
Exoerythrozytäre Schizogonie
Sporozoiten, die mit Mückenspeichel in den menschlichen Körper gelangen, gelangen sehr schnell (innerhalb von 15–30 Minuten) mit dem Blutkreislauf in die Leber, wo sie aktiv in die Hepatozyten eindringen, ohne diese zu schädigen. Sporozoiten von Pl. falciparum, Pl. malariae und Tachysporozoiten von Pl. vivax und Pl. ovale beginnen sofort mit dem EES mit der Bildung einer großen Anzahl exoerythrozytärer Merozoiten (bis zu 40.000 aus einem Sporozoiten bei Malaria falciparum). Hepatozyten werden zerstört und Merozoiten gelangen erneut in den Blutkreislauf, gefolgt von schnellem (innerhalb von 15–30 Minuten) Eindringen in die Erythrozyten. Die Dauer des EES beträgt bei Malaria falciparum üblicherweise 6 Tage, bei Malaria vivax 8 Tage, bei Malaria ovafe 9 Tage und bei Malariae 15 Tage.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
Ruhephase
Bei Malaria vivax und Malaria ovale verwandeln sich Bradysporozoiten, die in Hepatozyten eingedrungen sind, in inaktive Formen - Hypnozoiten, die mehrere Monate oder sogar Jahre lang ohne Teilung verbleiben können, bis sie anschließend reaktiviert werden (Teilung und Bildung von Merozoiten). Daher sind Hypnozoiten mit einer langen Inkubation (bis zu 3-10 Monate oder länger) und der Entwicklung von entfernten exoerythrozytären Rückfällen verbunden, die nur für diese Malariaformen charakteristisch sind.
Erythrozytenschizogonie
Nach der Einschleusung von Merozoiten in Erythrozyten durchlaufen Malariaparasiten wiederholt (zyklisch) die Stadien: Trophozoit (fressende, mononukleäre Zelle), Schizont (teilende, multinukleäre Zelle) und Morula (gebildeter Parasit im Erythrozyten). Nach der Zerstörung der Erythrozyten gelangen Merozoiten anschließend ins Blutplasma. Die größte Anzahl von Tochtermerozoiten wird bei der tropischen Malaria gebildet – bis zu 40 in einem Erythrozyt. Das ES-Stadium dauert eine genau definierte Zeit: 48 Stunden bei Malaria tropica, Malaria vivax und Malaria ovale und 72 Stunden bei Malariae.
Merkmale des Erythrozytenschizogoniezyklus und die wichtigsten pathogenetischen Mechanismen der Entwicklung schwerer und komplizierter Formen der Malaria tropica:
- Ansammlung (Sequestrierung) eingedrungener Erythrozyten, die adulte Trophozoiten (aus dem amöboiden Trophozoitenstadium), Schizonten enthalten, in den Gefäßen innerer Organe, vor allem des Gehirns, sowie der Nieren, der Leber, des Darms, des Knochenmarks, der Plazenta usw.;
- die Bildung sogenannter Rosetten, bestehend aus befallenen und nicht infizierten Erythrozyten;
- Entwicklung von Mikrozirkulationsstörungen, Gewebehypoxie, metabolischer Azidose (signifikante Ansammlung von Milchsäure);
- Aktivierung des MFS (vorwiegend Th-1-Immunantwort) mit erhöhter Synthese von Tumornekrosefaktor-a, y-Interferon, Interleukin-1 und anderen Zytokinen, die das Gefäßendothel schädigen und eine Adhäsion von Erythrozyten am Endothel der Blutgefäße verursachen.
In den letzten Jahren wurde die besondere Rolle der erhöhten Synthese von Stickstoffmonoxid (NO) durch zerebrale vaskuläre Endothelzellen bei der Entwicklung der zerebralen Form der Malaria tropica in Betracht gezogen.
Ein wichtiger pathophysiologischer Mechanismus bei der Entwicklung schwerer Formen der Malaria tropica im Vergleich zu anderen Malariaformen ist die Hypoglykämie, die Mikrozirkulations- und Stoffwechselstörungen (metabolische Azidose) bei Patienten, insbesondere bei Kindern und Schwangeren, verschlimmert. Drei Hauptfaktoren werden bei der Entwicklung einer Hypoglykämie bei Malaria tropica unterschieden: verminderte Glucogenese in der Leber, Glukoseverwertung durch Parasiten und Stimulation der Insulinsekretion. Gleichzeitig kann Hypoglykämie eine Folge einer Hyperinsulinämie sein, die sich nach der Gabe von Chinin zur Unterdrückung von Malaria tropica-Anfällen entwickelt.
Als Folge einer längeren Persistenz des Parasiten (ohne adäquate Therapie) bei Malaria-Erkrankten kann sich aufgrund eines Immunmechanismus (Ablagerung von Immunkomplexen mit Parasitenantigenen auf der Basalmembran der Nierenglomeruli) ein nephrotisches Syndrom entwickeln.
Es ist zu beachten, dass die wichtigsten klinischen Manifestationen aller Formen von Malaria (Intoxikation, vergrößerte Leber und Milz, Anämie) mit dem Stadium der Erythrozytenschizogonie (wiederholte ungeschlechtliche Vermehrung von Parasiten in Erythrozyten) verbunden sind. Je höher der Parasitengehalt in 1 µl Blut eines Patienten, ermittelt durch Dickfilmmikroskopie, ist, desto schwerer verläuft die Malaria normalerweise. Daher ist es in der Labordiagnostik von Malaria wichtig, nicht nur den Typ des Malariaplasmodiums festzustellen, sondern auch den Grad der Parasiteninfektion. Nach dem maximalen Grad der Parasiteninfektion werden die Malariaformen in absteigender Reihenfolge verteilt: Malaria tropica (bis zu 100.000 µl oder mehr), Malaria vivax (bis zu 20.000 µl, seltener mehr), Malaria ovale und Malariae (bis zu 10-15.000 µl). Bei der Malaria tropica, die mit einer hohen Parasitenbelastung (100.000 pro µl und mehr) einhergeht, steigt das Risiko für die Entwicklung schwerer, tödlicher Komplikationen erheblich an, was die Taktik der intensiven (parenteralen) Malariatherapie bestimmt.
Das Auftreten von Fieberkrämpfen bei Malaria wird durch die Hämolyse der Erythrozyten, die Freisetzung von Merozoiten ins Plasma, die Zerstörung einiger von ihnen (der andere Teil der Merozoiten wird wieder in die Erythrozyten eingeführt), die Aktivierung des MFS und eine erhöhte Synthese von Interleukin-1, -6, Tumornekrosefaktor a und anderen endogenen Pyrogenen (entzündlichen Zytokinen) verursacht, die das Thermoregulationszentrum des Hypothalamus beeinflussen.
Bei Vorhandensein einer Plasmodiengeneration im Blut kommt es ab den ersten Krankheitstagen zu regelmäßig wechselnden Paroxysmen. Bei Malaria tropica und Malaria vivax (in hyperendemischen Regionen mit intensiver Malariaübertragung) kommt es bei nichtimmunen Personen häufig zu einem anfänglichen (Start-)Fieber, das mit der gleichzeitigen Entwicklung mehrerer Erregergenerationen in den Erythrozyten der Patienten mit unterschiedlichen Zeitpunkten für das Ende des Entwicklungszyklus verbunden ist, was zu einer Schichtung der Anfälle, einer Glättung der Fieberperiode und einer Verzerrung des typischen Paroxysmus führt.
Im Verlauf der Krankheit nehmen spezifische und unspezifische Abwehrfaktoren zu (bis zum Ende der 1.–2. Woche), einige Generationen sterben ab und es bleiben eine (zwei) führende Parasitengenerationen übrig, die jeden zweiten Tag (oder jeden Tag) typische Paroxysmen entwickeln.
Die Vergrößerung von Leber und Milz bei allen Formen der Malaria ist mit einer erheblichen Blutfüllung, Ödemen und Hyperplasie des metastatischen Gelenks verbunden.
Malaria führt in der Regel immer zu einer hämolytischen hypochromen Anämie, bei deren Pathogenese eine Reihe von Faktoren wichtig sind:
- intravaskuläre Hämolyse infizierter Erythrozyten;
- Phagozytose sowohl infizierter als auch nicht infizierter Erythrozyten durch retikuloendotheliale Zellen der Milz;
- Sequestrierung (Ansammlung) von Erythrozyten, die reife Parasiten enthalten, im Knochenmark, Unterdrückung der Hämatopoese;
- Immunmechanismus (Zerstörung nicht betroffener Erythrozyten durch Adsorption von Immunkomplexen, die die C-3-Fraktion des Komplements enthalten, an die Erythrozytenmembran).
Das Stadium der Gametozytogonie ist eine Art Ableger des ES-Stadiums. Einige der Merozoiten (ein genetisch bedingter Prozess) entwickeln sich nach der Einführung in den Erythrozyten nicht zu einer Wiederholung des ungeschlechtlichen Entwicklungszyklus, sondern zu geschlechtlichen Formen – Gametozyten (männlich und weiblich).
Merkmale des Gametozytogonialstadiums bei Malaria tropica:
- Gametozyten erscheinen im peripheren Blut frühestens 10-12 Tage nach der Krankheit;
- Im Verlauf der Erkrankung akkumulierte Gametozyten können über einen langen Zeitraum (bis zu 4–6 Wochen oder länger) im Blutkreislauf zirkulieren.
Bei anderen Malariaformen (vivax, ovale, malariae) sind bereits ab den ersten Krankheitstagen Gametozyten im peripheren Blut nachweisbar und sterben schnell (innerhalb weniger Stunden bis Tage) ab.
Symptome Malaria
Unter Berücksichtigung der Artmerkmale der Malariaparasiten und der entsprechenden Symptome der Malaria werden vier Krankheitsformen unterschieden: Dreitage-Malaria (Vivax-Malaria, Malaria tertiana), Viertage-Malaria (Malaria quartana), tropische Malaria (Falciparum-Malaria, Malaria tropica), dreitägige ovale Malaria (Ovale-Malaria).
Der Verlauf der primären Malaria umfasst die Anfangsphase der Krankheit, die Phase des Krankheitshöhepunkts und die Genesung. Ohne Behandlung oder mit unzureichender etiotroper Therapie geht Malaria in eine Rückfallphase über. Je nach Entwicklungszeitpunkt gibt es exoerythrozytäre und erythrozytäre Rückfälle - früh und spät. Erythrozytäre Rückfälle werden bei Infektionen mit allen Arten von Plasmodien beobachtet. Frühe treten innerhalb von 2 Monaten nach den primären Anfällen auf; Rückfälle, die sich zu einem späteren Zeitpunkt entwickeln, gelten als spät. Ohne Behandlung oder bei unsachgemäßer Behandlung der Drei-Tage- und Ovale-Malaria tritt eine 6-11 Monate dauernde "Flaute" mit dem Verschwinden der Parasiten aus dem Blut und klinischem Wohlbefinden ein. Dann kommen späte Rückfälle (verursacht durch die Aktivierung von Hypnozoiten in der Leber), wieder ersetzt durch eine Latenzzeit ohne Behandlung, nach der die Krankheit erneut auftritt.
P. falciparum lebt im menschlichen Körper (ohne Behandlung) bis zu 1,5 Jahre, P. vivax und P. ovale bis zu 3 Jahre, P. malariae viele Jahre, manchmal lebenslang.
Was bedrückt dich?
Formen
Nach den Empfehlungen der WHO wird Malaria in unkomplizierte, schwere und komplizierte Formen unterteilt. Bösartige Formen und Komplikationen sind vor allem bei einer Infektion mit P. falciparum charakteristisch. Die durch P. vivax, P. ovale und P. malariae verursachte Erkrankung verläuft in der Regel gutartig.
Dreitägige Malaria
Die Inkubationszeit der dreitägigen Malaria beträgt 10–21 Tage bis 6–14 Monate. Prodromale Symptome der Malaria vor dem primären Malariaanfall werden selten beobachtet, gehen jedoch häufig Rückfällen voraus und äußern sich in allgemeinem Unwohlsein, Schwäche, Müdigkeit, Schmerzen in der Lendengegend, den Gliedmaßen, leichtem Anstieg der Körpertemperatur, Appetitlosigkeit und Kopfschmerzen. Die Dauer der Prodromalperiode beträgt durchschnittlich 1–5 Tage.
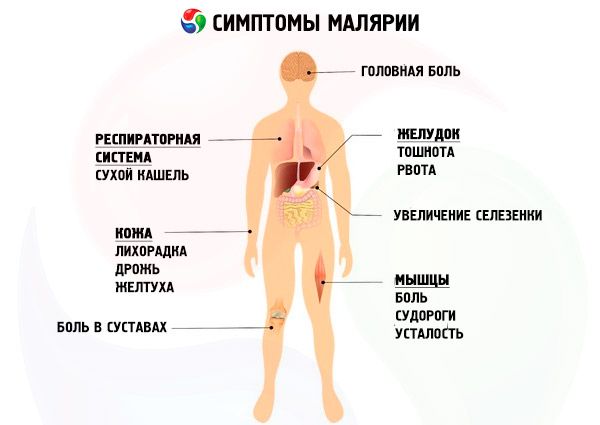
Zunächst ist der Temperaturverlauf unregelmäßig (Anfangsfieber), was mit der asynchronen Freisetzung mehrerer Generationen von P. vivax ins Blut einhergeht. Anschließend beginnen typische Malariaanfälle mit intermittierendem dreitägigem Fieber, was auf die Bildung der Hauptparasitengeneration im Blut hinweist. Bei einem Malaria-Fieberanfall sind drei Phasen klinisch deutlich ausgeprägt, die unmittelbar aufeinander folgen: Schüttelfrost, Hitze und Schweißausbrüche. Ein Malariaanfall beginnt mit Schüttelfrost, dessen Intensität variieren kann – von leichtem Zittern bis hin zu rasendem Schüttelfrost. Zu diesem Zeitpunkt geht der Patient zu Bett und versucht vergeblich, sich aufzuwärmen, doch der Schüttelfrost nimmt zu. Die Haut fühlt sich trocken, rau oder gänseartig an, ist kalt, die Extremitäten und sichtbaren Schleimhäute sind zyanotisch. Folgende Malariasymptome werden beobachtet: starke Kopfschmerzen, gelegentlich Erbrechen, Gelenk- und Lendenschmerzen. Das Schüttelfroststadium dauert einige Minuten bis ein bis zwei Stunden und wird durch das Fieberstadium ersetzt. Der Patient zieht Kleidung und Unterwäsche aus, was ihm jedoch keine Linderung verschafft. Die Körpertemperatur erreicht 40–41 °C, die Haut wird trocken und heiß, das Gesicht rötet sich. Kopfschmerzen, Schmerzen im Lenden- und Gelenkbereich verstärken sich, Delirium und Verwirrtheit sind möglich. Das Fieberstadium dauert eine bis mehrere Stunden und wird von einer Schweißphase abgelöst. Die Temperatur sinkt kritisch, das Schwitzen ist oft stark, sodass der Patient wiederholt seine Unterwäsche wechseln muss. Durch den Anfall geschwächt, schläft er bald ein. Die Anfallsdauer beträgt 6–10 Stunden. Typischerweise treten die Krankheitsanfälle in den Morgen- und Nachmittagsstunden auf. Nach dem Anfall beginnt eine etwa 40 Stunden andauernde Phase der Fieberlosigkeit. Nach 2–3 Temperaturanfällen sind Leber und Milz deutlich vergrößert. Veränderungen im Blut: Anämie, die sich ab der zweiten Krankheitswoche allmählich entwickelt, Leukopenie, Neutropenie mit einer Verschiebung der Bandzellen nach links, relative Lymphozytose, Aneosinophilie und erhöhte BSG.
Im natürlichen Krankheitsverlauf ohne etiotrope Behandlung nimmt nach 12–14 Anfällen (4–6 Wochen) die Fieberintensität ab, die Anfälle klingen allmählich ab und die Größe von Leber und Milz nimmt ab. Nach 2 Wochen bis 2 Monaten treten jedoch frühe Rückfälle auf, die durch einen synchronen Temperaturverlauf, eine Vergrößerung von Leber und Milz sowie Anämie gekennzeichnet sind. Anschließend verschwinden die Parasiten mit zunehmender Immunität aus dem Blut und eine Latenzzeit beginnt. Wird zu diesem Zeitpunkt keine Behandlung mit histoschizotropen Arzneimitteln durchgeführt, kommt es nach 6–8 Monaten (manchmal auch nach 1–3 Jahren) zur Aktivierung der „ruhenden“ Gewebeformen der Parasiten und es entwickeln sich verzögerte Rückfälle. Sie sind gekennzeichnet durch einen akuten Beginn, einen milderen Verlauf, eine frühe Vergrößerung der Milz, eine geringe Anzahl von Anfällen (bis zu 7–8), eine geringere Intensität und Dauer der Parasiteninfektion sowie das Vorhandensein von Gametozyten im Blut.
Ovale Malaria
In vielen klinischen und pathogenetischen Merkmalen ähnelt die ovale Malaria der dreitägigen Malaria vivax. Die Inkubationszeit der ovalen Malaria beträgt 11–16 Tage. Bei ovaler Malaria neigt der Erreger zur primären Latenz. Die Inkubationszeit kann 2 Monate bis 2 Jahre oder länger dauern. Zu den Symptomen der Malaria gehört intermittierendes dreitägiges Fieber, seltener täglich. Fieberanfälle treten häufig in den Abendstunden auf und nicht in der ersten Tageshälfte, wie es für andere Malariaformen typisch ist. Die ovale Malaria ist hauptsächlich durch einen milden Verlauf mit wenigen Anfällen gekennzeichnet, die ohne ausgeprägten Schüttelfrost und mit niedrigerer Temperatur auf dem Höhepunkt der Anfälle auftreten. Charakteristisch ist, dass die Anfälle während des primären Anfalls sehr oft spontan aufhören. Dies erklärt sich durch die schnelle Ausbildung einer stabilen Immunität. Ohne Behandlung mit histoschizotropen Medikamenten sind 1–3 Rückfälle mit einem Intervall zwischen den Rückfällen von 17 Tagen bis 7 Monaten möglich.
Quartan
Die Erkrankung verläuft in der Regel gutartig. Die Inkubationszeit beträgt 3 bis 6 Wochen. Prodromale Symptome der Malaria werden selten beobachtet. Die Krankheit beginnt akut. Ab dem ersten Anfall entwickelt sich intermittierendes Fieber mit einer Periodizität von Anfällen alle 2 Tage. Der Anfall beginnt in der Regel mittags und dauert durchschnittlich etwa 13 Stunden. Die Schüttelfrostphase ist lang und ausgeprägt. Die Hitzeperiode dauert bis zu 6 Stunden und wird von Kopfschmerzen, Myalgie, Arthralgie, manchmal Übelkeit und Erbrechen begleitet. Manchmal sind die Patienten unruhig und delirieren. In der interiktalen Phase ist der Zustand der Patienten zufriedenstellend. Anämie und Hepatosplenomegalie entwickeln sich langsam – frühestens 2 Wochen nach Ausbruch der Krankheit. Ohne Behandlung werden 8–14 Anfälle beobachtet, aber der Prozess der erythrozytären Schizogonie auf niedrigem Niveau dauert viele Jahre. Am häufigsten erfolgt die Infektion in Form einer Parasitenbesiedlung ohne Aktivierung der Erythrozytenschizogonie, was solche Personen zu potenziell gefährlichen Spendern macht. In endemischen Herden verursacht die Vier-Tage-Malaria bei Kindern ein nephrotisches Syndrom mit ungünstiger Prognose.
Tropische Malaria
Die schwerste Form der Malariainfektion. Die Inkubationszeit beträgt 8–16 Tage. Nach Ablauf dieser Zeit treten bei manchen nicht immunisierten Personen Prodromalsymptome der Malaria auf, die mehrere Stunden bis ein bis zwei Tage anhalten: Unwohlsein, Schwäche, Müdigkeit, Gliederschmerzen, Myalgie und Arthralgie sowie Kopfschmerzen. Bei den meisten Patienten beginnt die tropische Malaria akut, ohne Prodromalphase, mit einem Anstieg der Körpertemperatur auf 38–39 °C. Wenn die Zyklen der erythrozytären Schizogonie mehrerer Generationen von P. falciparum in einem infizierten Organismus nicht gleichzeitig enden, äußert sich dies klinisch häufig durch das Fehlen einer zyklischen Periodizität von Fieberanfällen. Die Anfälle, die in abwechselnden Phasen auftreten, beginnen mit Schüttelfrost, der 30 Minuten bis eine Stunde anhält. Während dieser Zeit ist die Haut bei der Untersuchung blass, fühlt sich kalt an und weist oft eine Rauheit wie bei einer Gänsehaut auf. Der Schüttelfrost geht mit einem Anstieg der Körpertemperatur auf 38–39 °C einher. Mit dem Aufhören des Schüttelfrosts beginnt die zweite Phase des Anfalls – das Fieber. Die Patienten verspüren ein leichtes Wärmegefühl, manchmal sogar echte Hitze. Die Haut fühlt sich heiß an, das Gesicht ist hyperämisch. Diese Phase dauert etwa 12 Stunden und wird durch leichtes Schwitzen ersetzt. Die Körpertemperatur sinkt auf normale und unternormale Werte und steigt nach 1-2 Stunden wieder an. In einigen Fällen geht der Ausbruch der tropischen Malaria mit Übelkeit, Erbrechen und Durchfall einher. Manchmal werden katarrhalische Symptome der Malaria der oberen Atemwege festgestellt: Husten, laufende Nase, Halsschmerzen. In einem späteren Stadium werden herpetische Eruptionen an den Lippen und Nasenflügeln beobachtet. Im akuten Stadium bemerken die Patienten eine Hyperämie der Bindehaut, in schweren Fällen kann diese von petechialen oder größeren subkonjunktivalen Blutungen begleitet sein.
Während des Höhepunktes der tropischen Malaria sind Schüttelfrostanfälle weniger ausgeprägt als in den ersten Krankheitstagen, ihre Dauer beträgt 15-30 Minuten. Das Fieber hält tagelang an, Phasen der Fieberlosigkeit werden selten beobachtet. Bei einem milden Krankheitsverlauf erreicht die Körpertemperatur an ihrem Höhepunkt 38,5 °C, die Fieberdauer beträgt 3-4 Tage; bei mäßigem Schweregrad - 39,5 °C bzw. 6-7 Tage. Ein schwerer Krankheitsverlauf ist durch einen Anstieg der Körpertemperatur auf 40 °C und mehr gekennzeichnet und dauert acht oder mehr Tage. Die Dauer einzelner Anfälle (und tatsächlich der Schichtung mehrerer) bei tropischer Malaria erreicht 30-40 Stunden. Der unregelmäßige Typ der Temperaturkurve überwiegt, seltener werden remittierende, gelegentlich intermittierende und konstante Typen beobachtet.
Eine Lebervergrößerung wird in der Regel am 3. Krankheitstag festgestellt, eine Milzvergrößerung ebenfalls ab dem 3. Tag, wird aber meist nur durch Perkussion erfasst; eine deutliche Palpation ist erst am 5.-6. Tag möglich. Bei der Ultraschalluntersuchung der Bauchorgane wird eine Leber- und Milzvergrößerung bereits am 2.-3. Tag nach Auftreten der klinischen Manifestationen der tropischen Malaria festgestellt. Störungen des Pigmentstoffwechsels werden nur bei Patienten mit schwerer und seltener mittelschwerer tropischer Malaria beobachtet. Ein mehr als dreifacher Anstieg der Serum-Aminotransferase-Aktivität gilt als Indikator für eine ungünstige Prognose. Stoffwechselstörungen bei tropischer Malaria umfassen Veränderungen des Hämostasesystems und Hypoglykämie. Herz-Kreislauf-Erkrankungen sind funktioneller Natur und äußern sich in Tachykardie, gedämpften Herztönen und Hypotonie. Gelegentlich ist ein vorübergehendes systolisches Herzgeräusch an der Herzspitze zu hören. Bei schweren Formen der Erkrankung zeigen sich Veränderungen im EKG in Form einer Deformation des terminalen Teils des Ventrikelkomplexes: Abflachung und inverse Konfiguration der T-Welle, Absenkung des ST-Segments. Gleichzeitig nimmt die Spannung der R-Wellen in Standardableitungen ab. Bei Patienten mit der zerebralen Form sind die Veränderungen der P-Welle vom P-pulmonalen Typ.
Bei der tropischen Malaria werden häufig ZNS-Störungen beobachtet, die mit hohem Fieber und Intoxikation einhergehen: Kopfschmerzen, Erbrechen, Meningismus, Krämpfe, Schläfrigkeit, manchmal ein deliriumähnliches Syndrom, aber das Bewusstsein des Patienten bleibt erhalten.
Charakteristische Anzeichen einer mittelschweren und schweren Malariainfektion sind hämolytische Anämie und Leukopenie, Eosinophilie und Neutropenie. Die Leukozytenformel weist eine relative Lymphozytose auf. Bei schweren Formen der Erkrankung ist eine neutrophile Leukozytose möglich; die BSG ist konstant und signifikant erhöht. Thrombozytopenie ist ein typisches Symptom für alle Malariaarten. Wie bei anderen Infektionskrankheiten kommt es auch bei Patienten zu einer vorübergehenden Proteinurie.
Rezidivierende tropische Malaria wird entweder durch eine unzureichende etiotrope Behandlung oder eine Resistenz von P. falciparum gegen die verwendeten Chemotherapeutika verursacht. Der natürliche Verlauf der tropischen Malaria mit günstigem Ausgang dauert nicht länger als 2 Wochen. Ohne etiotrope Therapie treten Rückfälle nach 7–10 Tagen auf.
Eine Schwangerschaft ist ein allgemein anerkannter Risikofaktor für tropische Malaria. Dies liegt an der höheren Schwangerschaftsrate, der Neigung zu schweren Krankheitsverläufen, dem Risiko für Gesundheit und Leben des Kindes und dem begrenzten therapeutischen Arsenal. Tropische Malaria bei Kindern unter fünf Jahren sollte als potenziell tödliche Erkrankung angesehen werden. Bei Kindern jüngerer Altersgruppen (bis 3–4 Jahre), insbesondere bei Säuglingen, weist Malaria ein einzigartiges Krankheitsbild auf: Das auffälligste klinische Symptom – der Malariaanfall – fehlt. Gleichzeitig treten Malariasymptome wie Krämpfe, Erbrechen, Durchfall und Bauchschmerzen auf, wobei sich der Zustand des Kindes rasch verschlechtert. Das Auftreten von Krämpfen und anderen zerebralen Symptomen bedeutet nicht unbedingt die Entwicklung einer zerebralen Malaria – dies ist oft eines der Symptome einer Neurotoxikose. Die Parasitenbefallrate bei Kleinkindern ist in der Regel hoch: P. falciparum kann bis zu 20 % der roten Blutkörperchen befallen. Die Krankheit kann schnell bösartig werden und zum Tod des Kindes führen.
Komplikationen und Konsequenzen
Registriert in allen Stadien der tropischen Malaria. Prognostisch ungünstige Malariasymptome, die auf die Möglichkeit der Entwicklung einer malignen Form hinweisen: tägliches Fieber, fehlende Fieberlosigkeit zwischen den Anfällen, starke Kopfschmerzen, generalisierte Krämpfe mit mehr als zwei Wiederkehrzeiten innerhalb von 24 Stunden, Dezerebrationsstarre, hämodynamischer Schock (systolischer Blutdruck unter 70 mmHg bei Erwachsenen und unter 50 mmHg bei Kindern). Dies wird auch durch eine hohe Parasitenzahl (mehr als 100.000 P. falciparum in 1 µl Blut), den Nachweis verschiedener Altersstadien des Parasiten im peripheren Blut, das Vorhandensein von Gametozyten und eine zunehmende Leukozytose (mehr als 12,0 x 10 9 /l) belegt. Auch eine Hypoglykämie unter 2,2 mmol/L, eine dekompensierte metabolische Azidose, eine mehr als dreifach erhöhte Serum-Aminotransferase-Aktivität sowie ein Abfall des Glukosespiegels im Liquor und ein Laktatspiegel über 6 μmol/L sind prognostisch ungünstig.
Schwere ZNS-Läsionen bei tropischer Malaria werden unter dem Namen „zerebrale Malaria“ zusammengefasst. Ihr Hauptsymptom ist die Entwicklung eines komatösen Zustands. Das Malariakoma kann eine Komplikation der primären, wiederholten und wiederkehrenden Malaria sein, wird jedoch häufiger bei primärer Malaria beobachtet, hauptsächlich bei Kindern, schwangeren Frauen sowie jungen und mittleren Menschen.
Die zerebrale Form ist die häufigste Komplikation der schweren Malaria tropica. Unter modernen Bedingungen entwickelt sich die zerebrale Form in 10 % aller Fälle von Malaria tropica weltweit, und 60–80 % aller Todesfälle sind mit dieser Komplikation verbunden. Die zerebrale Form kann sich bereits in den ersten Tagen entwickeln, wird aber aufgrund fehlender oder unzureichender Therapie häufiger in der zweiten Krankheitswoche beobachtet. Ein tödlicher Ausgang kann innerhalb von 1–2 Tagen eintreten. Im Krankheitsbild der zerebralen Malaria werden drei Phasen unterschieden: Betäubung, Stupor und echtes Koma.
Das Stadium der Betäubung ist durch geistige und körperliche Lethargie des Patienten sowie schnelle Erschöpfung gekennzeichnet. Er orientiert sich in Zeit und Raum, nimmt aber widerwillig Kontakt auf, beantwortet Fragen einsilbig und wird schnell müde. Sehnenreflexe bleiben erhalten.
Das Sopor-Stadium äußert sich in tiefer Erschöpfung des Patienten mit seltenen Bewusstseinsblitzen. Ataxie, Amnesie und Krämpfe, manchmal epileptiformer Natur, sind möglich. Die Hornhautreflexe bleiben erhalten, die Pupillen sind normal. Die Sehnenreflexe sind verstärkt, es treten pathologische Reflexe auf.
Im Koma ist der Patient bewusstlos und reagiert nicht auf äußere Reize. Konvergenzstörung, divergenter Strabismus, schwebende Bewegungen der Augäpfel bei geöffneten Augenlidern (als ob der Patient an die Decke schaut), horizontaler und vertikaler Nystagmus, Lähmung des sechsten Hirnnervenpaares werden beobachtet; Sehnen- und Bauchreflexe fehlen, vegetative Funktionen sind stark beeinträchtigt. Meningeale Symptome von Malaria und pathologische Reflexe von Babinski, Rossolimo usw. treten auf. Es wird Inkontinenz von Urin und Stuhl festgestellt. Eine Lumbalpunktion zeigt einen Anstieg des Hirndrucks ohne ausgeprägte Störungen der Protein- und Zellzusammensetzung der Zerebrospinalflüssigkeit. Ein hoher Grad an Parasitenbefall mit P. falciparum in verschiedenen Altersstadien wird in einem dicken Tropfen und einem Blutausstrich von Patienten mit komatöser Malaria festgestellt. Gleichzeitig sind Fälle tödlicher Verläufe von zerebraler Malaria mit sehr geringer Parasitenbelastung bekannt. Zerebrale Malaria bei Kindern geht häufig mit Anämie einher. Anämie verschlechtert den neurologischen und somatischen Zustand des Kindes. Bei wirksamer Behandlung kehrt das Bewusstsein meist plötzlich zurück.
Bei zerebraler Malaria können sich Psychosen als Folge dystrophischer Veränderungen im Hirnparenchym entwickeln. In der akuten Phase treten Psychosen in Form von Delirium, Amentia, epileptischen Anfällen und manischen Zuständen auf. Postmalaria-Psychosen sind gekennzeichnet durch Depressionen, geistige Schwäche, Hysterie, schizophrenieähnliche Syndrome und bei Kindern eine vorübergehende geistige Entwicklungsverzögerung. Manchmal treten Langzeitfolgen der zerebralen Malaria auf: Hemiplegie, Ataxie, fokale Symptome der Hirnnerven, extrapyramidale Störungen, Mono- und Polyneuritis.
Eine häufige Komplikation aller Formen einer Malariainfektion ist die hypochrome Anämie. Eine schwere Anämie wird diagnostiziert, wenn der Hämatokrit unter 20 % und der Hämoglobinwert unter 50 g/l fällt. Der Grad der Anämie hängt von der Art des Parasiten sowie von der Intensität und Dauer der Infektion ab. Der Schweregrad der Malaria bei indigenen Völkern tropischer Länder wird oft durch einen Mangel an Eisen und Folsäure in der Ernährung verschlimmert. Nach den ersten Malariaanfällen kann sich eine Anämie entwickeln, die bei tropischer Malaria stärker ausgeprägt ist als bei anderen Formen.
Der infektiös-toxische Schock (ITS) mit der Entwicklung eines DIC-Syndroms ist eine charakteristische Komplikation der Malaria falciparum und tritt bei hoher Parasitenbelastung auf. Charakteristisch ist die Entwicklung einer akuten Nebenniereninsuffizienz. In heißen Klimazonen geht der infektiös-toxische Schock mit Hypovolämie einher.
Die Entwicklung eines akuten Nierenversagens wird üblicherweise bei malignen, komplizierten Verläufen der Malaria tropica beobachtet. Charakteristisch ist die Entwicklung von Oligurie und Anurie mit einem Anstieg von Kreatinin und Harnstoff im Blut; die Urinanalyse zeigt ausgeprägte Proteinurie, Zylindrurie, Pyurie und Mikrohämaturie.
Das nephrotische Syndrom ist eine charakteristische Komplikation der Malaria, die durch einen langsamen, stetig fortschreitenden Verlauf gekennzeichnet ist, der von Ödemen, arterieller Hypertonie, Proteinurie und der Entwicklung eines Nierenversagens begleitet wird.
Hämoglobinurisches Fieber ist eine Folge massiver intravaskulärer Hämolyse sowohl bei starker Invasion als auch infolge der Einnahme bestimmter Malariamedikamente (Chinin, Primaquin, Sulfonamide) bei Personen mit einem Mangel des Enzyms Glucose-6-phosphat-Dehydrogenase. In seiner schweren Form entwickeln sich starker Ikterus, schweres hämorrhagisches Syndrom, Anämie und Anurie, begleitet von Schüttelfrost, Fieber (40 °C), Schmerzen im Lendenbereich, wiederholtem Erbrechen von Galle sowie Myalgie und Arthralgie. Der Urin färbt sich dunkelbraun, was auf das Vorhandensein von Oxyhämoglobin zurückzuführen ist. In schweren Fällen sinkt die Zahl der Erythrozyten auf 1 × 10 12 /l und der Hämoglobinspiegel auf 20–30 g /l. Bei Malariahämoglobinurie sind nur sehr wenige Parasiten im Blut vorhanden oder sie werden überhaupt nicht nachgewiesen. Mit dem schnellen Absetzen des Malariamedikaments, das die Hämolyse der roten Blutkörperchen verursacht hat, verbessert sich der Zustand des Patienten ohne schwerwiegende Folgen. In schweren Fällen kann die Prognose aufgrund der Entwicklung eines akuten Nierenversagens ungünstig sein. In den letzten Jahren wurde der Autoimmuncharakter der Entwicklung einer akuten Hämolyse im Zusammenhang mit der langfristigen und häufigen Einnahme von Malariamedikamenten - Chinin und Primaquin - berücksichtigt. Es wird hohes Fieber festgestellt (mit geringer Parasitenbefall), der Urin wird schwarz, Anämie, Leukozytose, beschleunigte BSG werden im Bluttest festgestellt, das Nierenversagen schreitet schnell voran, was ohne adäquate Therapie zum Tod führt.
Die Malaria-Algide ist durch die für einen infektiösen toxischen Schock typischen klinischen Manifestationen gekennzeichnet: hämodynamische und Mikrozirkulationsstörungen, Störungen des Hämostasesystems, Multiorganversagen und Hypothermie. Im Gegensatz zur zerebralen Malaria bleibt das Bewusstsein erhalten, obwohl später ein Koma auftreten kann. Algide kann sich vor dem Hintergrund eines Lungenödems, einer metabolischen Azidose und schwerer Dehydratation entwickeln. Es wird ein hohes Maß an Parasitenbefall festgestellt. Die Prognose hängt maßgeblich von einer rechtzeitigen und korrekten Behandlung ab.
Ein akutes Lungenödem bei Patienten mit tropischer Malaria führt häufig zum Tod. Der Mechanismus dieser schweren Komplikation ist noch nicht vollständig erforscht. Ein Lungenödem kann durch übermäßige Rehydratation ausgelöst werden, sich aber auch bei normalem Druck im Lungenkreislauf entwickeln. Derzeit betrachten die meisten Forscher akutes Atemversagen bei tropischer Malaria als Manifestation des Atemnotsyndroms bei Erwachsenen.
Eine seltene, aber schwerwiegende Komplikation jeder klinischen Form von Malaria mit oder ohne hyperreaktive Splenomegalie ist die Milzruptur. Die Ruptur kann durch eine Torsion des Milzstiels mit akuter Blutstauung und der Entwicklung eines subkapsulären Hämatoms verursacht werden.
Bei tropischer Malaria sind Hornhautschäden, Iritis, Iridozyklitis, Glaskörpertrübung, Optikusneuritis, Chorioretinitis und Netzhautblutungen möglich; es gibt Berichte über Lähmungen der Augenmuskulatur durch Läsionen des III., IV. und VI. Hirnnervenpaares sowie über Akkommodationslähmungen.
Malaria-Rückfälle
Der Parasitenbefall ist bei einem Rückfall normalerweise geringer als bei primären Malariasymptomen. Aufgrund der erhöhten pyrogenen Schwelle im Verlauf der Infektion treten klinische Manifestationen bei einem Rückfall normalerweise mit einem höheren Parasitenbefall auf. Rückfälle verlaufen in der Regel gutartig, mit einem mäßig ausgeprägten toxischen Syndrom und einem regelmäßigen Wechsel von Malariaanfällen von Beginn an; die Anzahl der Anfälle ist deutlich geringer als bei primären Manifestationen der Krankheit. Je nach Zeitpunkt des Auftretens werden frühe (Entwicklung klinischer Manifestationen innerhalb der ersten 2 Monate nach den primären Manifestationen der Malaria) und späte (nach 2 Monaten) Rückfälle unterschieden. Je nach Ursprung werden Rückfälle in erythrozytäre (alle Formen der Malaria) und exoerythrozytäre (nur bei Malaria vivax und ovale) unterteilt.
Diagnose Malaria
Die Diagnose einer Malaria basiert auf epidemiologischen Daten (Aufenthalt in einem Malariaherd, Fehlen oder Unzulänglichkeit einer Chemoprophylaxe), auf dem klinischen Bild der Krankheit (charakteristische Anfälle) und wird durch Labortests bestätigt.
Bei der Diagnose von Malaria sollten folgende Punkte berücksichtigt werden:
- akuter Krankheitsbeginn, ausgeprägte Vergiftungserscheinungen, zyklischer Verlauf mit abwechselnden Fieberschüben und Fieberlosigkeitsphasen, Vergrößerung von Leber und Milz, Entwicklung einer progressiven hämolytischen Anämie;
- epidemiologische Vorgeschichte (Aufenthalt in einem Gebiet mit hohem Malariarisiko, Bluttransfusionen, Drogenabhängigkeit);
Dauer der Malaria unter Berücksichtigung der Entwicklung von Rückfällen bei einmaliger Infektion und ohne adäquate etiotrope Therapie
Form der Malaria |
Dauer der Infektion |
|
Normal |
Maximal |
|
Malaria falciparum |
Bis zu 1 Jahr |
Bis zu 3 Jahre |
Malaria-malariae |
Bis zu 2-3 Jahre |
Ein Leben lang möglich |
Malaria-vivax und ovale |
Bis zu 1,5-2 Jahre |
Bis zu 4-5 Jahre |
- Labortestergebnisse:
- Ergebnisse des Hämogramms: verringerte Hämoglobinwerte, Leukopenie, Lymphomonozytose, erhöhte BSG;
- Ergebnisse der Mikroskopie eines dicken Blutstropfens (bei geringer Parasitenbelastung mindestens 100 Sichtfelder betrachten): Nachweis von Plasmodien und Bestimmung der Parasitenbelastung in 1 µl Blut (100 Sichtfelder = 0,2 µl Blut).
Dies ist notwendig:
- Zur Auswahl des Intensitätsgrades einer spezifischen Malariatherapie (bei einem hohen Grad an Parasitenbefall bei Patienten mit tropischer Malaria ist die parenterale Verabreichung von Arzneimitteln vorzuziehen).
- Zur Überwachung der Wirksamkeit einer bestimmten Therapie.
Der Grad der Parasitenbefall kann auch durch Zählen des Prozentsatzes der befallenen Erythrozyten pro 100 Leukozyten in einem dicken Blutstropfen beurteilt werden (in diesem Fall muss zur Bestimmung der Parasitenzahl in 1 μl die Gesamtzahl der Leukozyten und Erythrozyten in 1 μl beim Patienten bekannt sein).
- Mikroskopische Daten eines Blutausstrichs zur Bestimmung des Plasmodium-Typs. Der dicke Tropfen und der Blutausstrich werden mit der Romanovsky-Giemsa-Methode gefärbt.
Aufgrund der Ansammlung befallener Erythrozyten mit adulten Trophozoiten und Schizonten in den Gefäßen innerer Organe werden bei der Untersuchung eines dicken Tropfenpräparats bei leichter Malaria tropica nur junge (juvenile) Trophozoiten im Ringstadium in Erythrozyten nachgewiesen. Das Auftreten befallener Erythrozyten mit adulten Stadien der Parasitenentwicklung (adulte oder amöboide Trophozoiten, Schizonten) im peripheren Blut ist ein ungünstiges Laborzeichen für einen schweren (komplizierten) Verlauf der Malaria tropica.
Grad der Parasitenbefall bei Malaria
Grad der Parasitenbefall |
Konventionelle Bezeichnung |
Anzahl der Parasiten im Gesichtsfeld |
Die Anzahl der Parasiten in 1 µl Blut |
IV |
+ |
1-20 in 100 Feldern |
5-50 |
III |
+ + |
10-100 in 100 Feldern |
50-500 |
II |
+ + + |
1-10 in 1 Feld |
500-5000 |
ICH |
+ + + + |
Mehr als 10 in 1 Feld |
Mehr als 5000 |
Bei Personen, die den ersten Kontakt (keine Immunität) mit dieser Infektion hatten, wie etwa kleinen Kindern, können die ersten Anfälle mit einer sehr geringen Parasitenzahl auftreten, die manchmal mikroskopisch nicht nachweisbar ist. Dies erfordert eine erneute Blutuntersuchung (dicker Tropfen) nach 6–12 Stunden, jedoch nicht später als 24 Stunden.
Die Labordiagnostik von Malaria umfasst die mikroskopische Untersuchung von Blutproben (Dicktropfen- und Dünnausstrichmethode), die nach Romanovsky-Giemsa gefärbt wurden.
Folgende Patienten werden auf Malaria untersucht: Fieberpatienten mit unklarer Diagnose, die während der Epidemiesaison drei Tage lang und im Rest des Jahres fünf Tage lang anhalten; Patienten mit anhaltendem periodischem Anstieg der Körpertemperatur trotz Behandlung gemäß der etablierten Diagnose; Blutempfänger mit erhöhtem Temperaturanstieg in den letzten drei Monaten nach der Transfusion; Personen, die in einem aktiven Fokus leben und bei denen ein Anstieg der Körpertemperatur festgestellt wurde. Es ist zu berücksichtigen, dass bei den ersten Malariaanfällen die Anzahl der Parasiten im peripheren Blut gering ist, sodass eine gründliche Untersuchung erforderlich ist. Malaria mit geringer Parasitenbefall tritt auch bei Personen auf, die vor der Erkrankung prophylaktisch Malariamedikamente (suppressive Therapie) oder Medikamente (Tetracyclin, Sulfonamide) mit unterdrückender Wirkung auf Malariaplasmodien eingenommen haben. Es wird empfohlen, Blutentnahmen sowohl bei Fieber als auch bei Fieberlosigkeit durchzuführen. Zum Nachweis von Parasiten wird ein dicker Tropfen untersucht, da das Blutvolumen darin 30- bis 40-mal größer ist als in einem dünnen Ausstrich. Bei hoher Parasitenbelastung lässt sich der Malariaerreger schon bei der Untersuchung eines dünnen Ausstrichs nachweisen. Die morphologischen Merkmale und Färbeeigenschaften (Anfärbbarkeit) verschiedener Altersstadien ungeschlechtlicher Formen in Erythrozyten sind in einem dünnen Ausstrich deutlich unterscheidbar. Die Bestimmung des Parasitentyps ist notwendig: Dies ist besonders wichtig bei P. falciparum. Bei unkomplizierter tropischer Malaria wird P. falciparum im peripheren Blut nur im Stadium junger ringförmiger Trophozoiten beobachtet. Im Falle einer Primärinfektion lassen sich bei einem schweren malignen Krankheitsverlauf reifere Stadien des Parasiten im peripheren Blut nachweisen. Die Parasitenbelastung nimmt schneller zu als bei Infektionen mit anderen Erregerarten. Die Gametozyten von P. falciparum reifen langsam, leben aber lange (bis zu 6 Wochen), während Gametozyten anderer Arten mehrere Stunden nach ihrer Reifung absterben. Bei tropischer Malaria nachgewiesene Gametozyten helfen bei der Bestimmung des Krankheitszeitraums: In der Frühphase (bei unkompliziertem Verlauf) werden nur ringförmige Trophozoiten nachgewiesen, während der Spitzenphase Ringe und Gametozyten (bei einer Primärinfektion ohne Behandlung deutet dies darauf hin, dass die Malaria mindestens 10-12 Tage andauert); in der Erholungsphase werden nur Gametozyten gefunden. Während der Behandlung wird der Grad der Parasiteninfektion im peripheren Blut dynamisch bestimmt. Einen Tag nach Beginn der etiotropen Behandlung sollte er um 25 % oder mehr abnehmen und am 3. Tag 25 % des ursprünglichen Wertes nicht überschreiten. Das Vorhandensein von Parasiten im Blutpräparat am 4. Tag nach Behandlungsbeginn ist unter allen Bedingungen einer erfolgreichen Behandlung ein Zeichen für die Resistenz des Erregers gegen das verwendete Medikament.
In den letzten Jahren wurden Schnelltests (immunchromatographische Methoden), die auf dem Nachweis des spezifischen Proteins HRP-2a und des Enzyms pLDH von P. falciparum basieren, in endemischen Herden eingesetzt, um rasch eine vorläufige Antwort zu erhalten. Tests mit einem der bekannten Schnelltests KAT-PF (KAT MEDICAL, Südafrika) haben eine hohe Effizienz und Spezifität in Bezug auf P. falciparum gezeigt. Ein Vergleich der Ergebnisse von Schnelltest, Mikroskopie und PCR ergab, dass die diagnostische Effizienz 95 – 98 % erreicht. Mit Schnelltests steht das Ergebnis in nur 10 Minuten fest. Laborpersonal kann die Reaktion in 1 – 2 Stunden beherrschen. Schnellmethoden ermöglichen Menschen, die in Endemiegebieten leben oder reisen, eine Selbstdiagnose; sie können vor Ort durchgeführt werden. In Russland ist die Schnelldiagnostik von Malaria derzeit auf einzelne klinische Studien beschränkt.
Unter modernen Bedingungen, insbesondere in Massenstudien, ist die PCR-Methode, die auf dem Nachweis von Malariaparasiten-DNA basiert, von besonderer Bedeutung. Die Methode kann verwendet werden, um die Besiedelung bei geringer Parasitendichte und Mischinfektionen mit verschiedenen Plasmodientypen zu bestimmen sowie den Rückfall einer medikamentenresistenten Malaria falciparum von einer Reinfektion mit P. falciparum zu unterscheiden. Derzeit wird sie hauptsächlich in epidemiologischen Studien eingesetzt.
Welche Tests werden benötigt?
Differenzialdiagnose
Die differenzialdiagnostische Suche nach Malaria erfolgt in Abhängigkeit von der Schwere der klinischen Manifestationen der Krankheit und ihrer Dauer. Malaria wird zunächst von Erkrankungen unterschieden, die mit anhaltendem Fieber, vergrößerter Leber, Milz und möglicher Anämieentwicklung einhergehen: Typhus und Paratyphus, Brucellose, Leptospirose, Sepsis, Lymphogranulomatose. In den ersten fünf Tagen nach Krankheitsbeginn ist Influenza (oder andere akute respiratorische Virusinfektionen) eine häufige Fehldiagnose für Malaria in nicht-endemischen Regionen.
In tropischen Ländern Südamerikas, Afrikas, Südostasiens und Indiens wird eine Differentialdiagnose von Malaria mit hämorrhagischen Virusfiebererkrankungen (Gelbfieber, Denguefieber usw.) durchgeführt.
Bei der zerebralen Form der Malaria falciparum erfolgt die Differentialdiagnostik der Malaria mit der Entwicklung einer Enzephalopathie (Koma) bei dekompensiertem Diabetes mellitus, Leber- und Nierenversagen sowie Ödemen und Schwellungen des Gehirns bei Meningitis oder Meningoenzephalitis bakterieller oder viraler Ätiologie.
Wen kann ich kontaktieren?
Behandlung Malaria
Zur Behandlung von Malaria gehört das Unterbinden akuter Krankheitsschübe, die Verhinderung von Rückfällen und Keimzellübertragung sowie die Wiederherstellung beeinträchtigter Körperfunktionen.
Medikamente gegen Malaria werden je nach ihrer Wirkung auf ein bestimmtes Stadium der Parasitenentwicklung in die folgenden Gruppen eingeteilt: Hämatoschizotrope Mittel, die gegen die asexuellen Erythrozytenstadien von Plasmodien wirksam sind; histoschizotrope Mittel, die gegen die asexuellen Gewebestadien von Plasmodien wirksam sind; Gamotrope Mittel, die das Absterben der Gametozyten im Blut des Patienten verursachen oder die Reifung der Gametozyten und die Bildung von Sporozoiten im Körper der Mücke stören.
Ätiotrope Behandlung
Bei Patienten mit Malaria sollte unmittelbar nach der Erstellung einer klinischen und epidemiologischen Diagnose und der Blutentnahme zur parasitologischen Untersuchung eine etiotrope Behandlung der Malaria verordnet werden.
Die derzeit verwendeten Medikamente gehören zu sechs Gruppen chemischer Verbindungen: 4-Aminochinoline (Chloroquin - Delagyl, Chloroquinphosphat, Nivaquin), Chinolinmethanole (Chinin - Chinindihydrochlorid, Chininsulfat, Quinimax, Mefloquin), Phenanthrenmethanole (Halfan, Halofantrin), Artemisinin-Derivate (Artesunat, Artemether, Arteether), Antimetaboliten (Proguanil), 8-Aminochinoline (Primaquin, Tafenoquin). Darüber hinaus werden kombinierte Malariamedikamente verwendet: Savarin (Chloroquin + Proguanil), Malaron (Atovaquon + Proguanil), Coartem oder Riamet (Artemether + Lumefantrin).
Wenn beim Patienten P. vivax, P. ovale oder P. malariae nachgewiesen werden, werden Medikamente aus der Gruppe der 4-Aminochinolinen verwendet, am häufigsten Chloroquin (Delagyl). Die Behandlung von Malaria erfolgt wie folgt: In den ersten beiden Tagen wird das Medikament in einer Tagesdosis von 10 mg/kg der Base (vier Delagyl-Tabletten auf einmal) verwendet, am dritten Tag einmalig 5 mg/kg (zwei Delagyl-Tabletten). Es gibt vereinzelte Berichte über Resistenzen von P. vivax-Stämmen gegen Chloroquin aus Burma, Indonesien, Papua-Neuguinea und Vanuatu. In solchen Fällen sollte die Behandlung mit Mefloquin oder Chinin gemäß dem Behandlungsschema für unkomplizierte Malaria erfolgen. Die Anfälle hören nach 24–48 Stunden auf und die Parasiten verschwinden 48–72 Stunden nach Beginn der Chloroquin-Einnahme aus dem Blut.
Zur radikalen Heilung (Verhinderung späterer Rückfälle) von Malaria, die durch P. vivax oder P. ovale verursacht wird, wird nach Abschluss der Chloroquin-Behandlung ein Gewebeschizontozid, Primaquin, eingesetzt. Es wird 14 Tage lang in einer Dosis von 0,25 mg/kg (Basis) pro Tag eingenommen. Gegen Primaquin resistente P. vivax-Stämme (die sogenannten Chesson-Stämme) kommen auf den pazifischen Inseln und in den Ländern Südostasiens vor. In diesen Fällen besteht eine der empfohlenen Behandlungsschemata darin, Primaquin in einer Dosis von 0,25 mg/kg pro Tag über 21 Tage einzunehmen.
Wird P. falciparum in leichten Fällen im Blut nicht immuner Personen nachgewiesen, sind gemäß den Empfehlungen der WHO Mefloquin und Artemisininderivate (Artemether, Artesunat, Arteether) die Medikamente der Wahl; auch Halofantrin kann verwendet werden. In Abwesenheit von Mefloquin und Halofantrin und/oder bei Vorliegen von Kontraindikationen für die Verwendung dieser Medikamente wird Chinin in Kombination mit Antibiotika (Tetracyclin, Doxycyclin) verschrieben. Tetracyclin wird 7–10 Tage lang zweimal täglich 0,5 g eingenommen; es kann durch Doxycyclin in einer Tagesdosis von 0,1 g ersetzt werden; die Einnahmedauer beträgt 7–10 Tage. In Regionen, in denen P. falciparum gegen Mefloquin und Chinin resistent ist, wird zur Behandlung der unkomplizierten tropischen Malaria eine Kombination aus Mefloquin- und Artemisininpräparaten (Artesunat, Artemether) empfohlen. Eine Kombination aus Fansidar und Artesunat ist wirksam bei der Behandlung unkomplizierter tropischer Malaria. Artemisininpräparate werden häufig zur Behandlung multiresistenter tropischer Malaria in Südostasien, einigen Ländern Südamerikas und Afrikas eingesetzt. Sie wirken sehr schnell sowohl auf die Blutstadien als auch auf die Gametozyten. Diese Medikamente werden jedoch schnell aus dem Körper ausgeschieden, weshalb es zu Malariarückfällen kommt. Es ist sinnvoller, sie in Kombination mit Mefloquin in folgenden Dosierungen zu verschreiben:
- Artesunat: 4 mg/kg zweimal täglich für 3 Tage; Mefloquin: 15 mg/kg einmal am Tag 2 oder 25 mg/kg in zwei Dosen an den Tagen 2 und 3;
- Artemether: 3,2 mg/kg einmal täglich für 3 Tage; Mefloquin: 15 mg/kg einmal am Tag 2 oder 25 mg/kg in zwei Dosen am Tag 2 und 3.
Behandlungsschemata für unkomplizierte Malaria
Bewerbungsschemata |
|||
Vorbereitung |
Erste Dosis, mg/kg |
Nachfolgende Dosen, mg/kg (Intervall, h) |
Kursdauer, Tage |
Chloroquin |
10 (Gründe) |
10 - 1-2 Tage 5 - 3 Tage |
3 |
Fansidar (Sulfadoxin + Pyrimethamin) |
2,50-1,25 |
- |
1 |
Chinin, Kinimax, Kinoform |
10 (Gründe) |
7,5 (8) |
7-10 |
Mefloquin |
15 (Gründe) |
- |
1 |
Halofantrin |
8 (Salz) |
8 (6) |
1 |
Artesunat |
4 |
2 (12) |
7 |
Artemether |
3.2 |
1,6 (24) |
7,0 |
Chinin-Tetracyclin |
10,0-1,5 |
10,0 (8)+5,0 (6) |
10,0+7,0 |
Coartem (Artemether + Lumefantrin) |
1,3+8 0 |
1,3-8,0 (8) |
3.0 |
Wenn der Erregertyp nicht bekannt ist, wird eine Behandlung gemäß den Behandlungsschemata für tropische Malaria empfohlen. Erbricht der Patient früher als 30 Minuten nach Einnahme des verschriebenen Malariamittels, sollte die gleiche Dosis erneut eingenommen werden. Tritt 30–60 Minuten nach Einnahme der Tabletten Erbrechen auf, wird zusätzlich die halbe Dosis dieses Arzneimittels verschrieben.
Patienten mit schwerer Tropenmalaria sollten auf einer Intensivstation oder Reanimationsstation stationär behandelt werden. Chinin ist nach wie vor das Mittel der Wahl zur Behandlung der schweren Tropenmalaria. Bei der Behandlung komplizierter Formen (zerebrale Malaria, Algide) wird die erste Dosis (7 mg/kg) Chininbase über 30 Minuten intravenös verabreicht. Anschließend werden weitere 10 mg/kg über 4 Stunden intravenös per Infusion verabreicht. Somit erhält der Patient in den ersten 4,5 Stunden nach Behandlungsbeginn 17 mg/kg Chininbase. Nach einem anderen Schema wird die Anfangsdosis von 20 mg/kg Chininbase über 4 Stunden verabreicht. Beide Schemata werden von den Patienten – ohne Herz-Kreislauf- oder andere Erkrankungen – zufriedenstellend vertragen. Eine Erhaltungsdosis von 10 mg/kg Chininbase wird in 8-stündigen Abständen verabreicht, die Verabreichungsdauer beträgt 1,5–2 Stunden. Es empfiehlt sich, Chinin mit Tetracyclin (250 mg viermal täglich über 7 Tage) oder Doxycyclin (0,1 g täglich über 7–10 Tage) zu kombinieren. Zur Behandlung von Kindern wird empfohlen, eine Initialdosis (15 mg/kg) Chininbase in einer 5%igen Glucoselösung über 4 Stunden intravenös zu verabreichen. Eine Erhaltungsdosis (10 mg/kg) wird über 2 Stunden in 12-stündigen Abständen verabreicht. Die gleiche Dosis wird für die intramuskuläre Verabreichung verwendet, jedoch wird empfohlen, Chinin fünffach in destilliertem Wasser zu verdünnen und auf zwei Injektionen in unterschiedliche Körperteile aufzuteilen.
Artemether wird als alternatives Medikament zur Behandlung der komplizierten tropischen Malaria eingesetzt. Die Tagesdosis beträgt 3,2 mg/kg am ersten Behandlungstag. In den folgenden sechs Tagen wird es in einer Dosis von 1,6 mg/kg intramuskulär in Kombination mit einer Dosis Mefloquin verabreicht.
Patienten mit schweren und komplizierten Malariaformen wird eine intensive pathogenetische Therapie verschrieben. Bei der Rehydratation ist auf Lungen- und Hirnödeme zu achten, eine Hypovolämie ist jedoch nicht weniger gefährlich. Bei erfolgloser Rehydratation können bei diesen Patienten Durchblutungsstörungen, Azidose, Hypotonie, Schock und Nierenversagen auftreten. Eine Anämie ist in der Regel nicht lebensbedrohlich. Sinkt der Hämatokrit jedoch auf 15–20 %, sollten Erythrozyten oder Vollblut transfundiert werden. Beim DIC-Syndrom wird die Transfusion von frischem Vollblut oder Konzentraten von Gerinnungsfaktoren und Thrombozyten eingesetzt. Bei Hypoglykämie sollte eine 40%ige Glucoselösung intravenös verabreicht werden.
Die Grundlage der Behandlung eines Hirnödems sind Entgiftung, Dehydratation, Kontrolle der zerebralen Hypoxie und Atemwegserkrankungen (Sauerstofftherapie, künstliche Beatmung). Antikonvulsiva werden nach Bedarf verabreicht. Erfahrungen in der Behandlung von zerebraler Malaria haben die Unwirksamkeit und sogar Gefährlichkeit osmotischer Diuretika bewiesen: niedermolekulare Dextrane; Adrenalin; Prostacyclin; Pentoxifyllin; Cyclosporin; Hyperimmunseren. Auch eine hyperbare Sauerstofftherapie wird nicht empfohlen.
Bei akutem Nierenversagen oder akutem Nieren-Leber-Versagen sollte die tägliche Chinindosis aufgrund möglicher Arzneimittelakkumulation auf 10 mg/kg reduziert und die Lösungen mit einer Geschwindigkeit von 20 Tropfen pro Minute verabreicht werden. In der Anfangsphase des akuten Nierenversagens wird eine forcierte Diurese durchgeführt. Bei fehlender Wirkung und zunehmender Azotämie wird eine Hämodialyse oder Peritonealdialyse eingesetzt, die in der Regel gute Ergebnisse liefert. Bei hämoglobinurischem Fieber wird das Medikament, das die Hämolyse verursacht hat, abgesetzt. Bei Bedarf wird es durch andere Malariamedikamente ersetzt, gleichzeitig werden Glukokortikosteroide (Prednisolon 1–2 mg/kg) und eine Entgiftungstherapie verordnet.
Bei einer Milzruptur, die meist bei einer schnellen und starken Vergrößerung des Organs auftritt, ist ein notfallmäßiger chirurgischer Eingriff angezeigt.
Zur Behandlung von Rückfällen der tropischen Malaria wird ein bisher nicht verwendetes Medikament ausgewählt oder das vorherige verwendet, jedoch in Kombination mit anderen Malariamedikamenten. Die Gametenbeförderung wird mit Primaquin in normalen therapeutischen Dosen für 1-3 Tage eliminiert.
Die Wirksamkeit der Malariabehandlung wird durch die Untersuchung eines dicken Blutstropfens mit Parasitenzählung in 1 μl überwacht. Diese Untersuchungen werden täglich vom 1. bis zum 7. Tag nach Beginn der etiotropen Behandlung durchgeführt. Verschwinden die Parasiten in dieser Zeit, werden am 14., 21. und 28. Tag nach Behandlungsbeginn weitere Untersuchungen der Blutpräparate durchgeführt.
Bewertung der Wirksamkeit
Die Wirksamkeit der etiotropen Behandlung von Malaria bei Patienten mit Malaria wird anhand von drei Parametern beurteilt: frühes Versagen (EF), spätes Versagen (LF) und wirksame Behandlung.
Nach der Einnahme eines Malariamedikaments kann es beim Patienten zu Erbrechen kommen (insbesondere bei Kindern). Es ist wichtig zu beachten, dass bei Erbrechen weniger als 30 Minuten nach Einnahme des Arzneimittels die gleiche Dosis erneut eingenommen werden sollte und nach 30-60 Minuten die Hälfte der verwendeten Dosis des Arzneimittels.
Bewertung der Wirksamkeit der Malariabehandlung (WHO, 1996)
Frühversagen (EF) |
Verschlechterung oder Persistenz der klinischen Symptome einer Malaria bei Vorhandensein einer Parasiteninfektion während der ersten 3 Tage nach Beginn der spezifischen Therapie |
Spätversagen (LF) |
Wiederauftreten der charakteristischen klinischen Symptome der Malaria (einschließlich der Entwicklung eines schweren Krankheitsverlaufs) bei Vorliegen einer Parasiteninfektion vom 4. bis zum 14. Tag nach Beginn der spezifischen Therapie |
Wirksamkeit der Behandlung |
Abwesenheit einer Parasiteninfektion 14 Tage nach Beginn der spezifischen Therapie, wenn die RN- und PN-Kriterien nicht erfüllt sind |
Radikale Behandlung von Malaria
Die radikale Behandlung der Malaria wird gleichzeitig mit der Stoppbehandlung oder unmittelbar danach durchgeführt.
- Zur Vorbeugung exoerythrozytärer Rückfälle der Malaria vivax und der Malaria ovale wird zur Beeinflussung der Hypozoiten Primaquin in einer Dosierung von 45 mg (27 mg Base) pro Tag (3 Tabletten) verschrieben – eine Kur von 14 Tagen oder 6 Tabletten – einmal wöchentlich – 6–8 Wochen (bei Glucose-6-Phosphat-Dehydrogenase-Mangel). Das Medikament Tafenoquin – ein Analogon von Primaquin, jedoch mit höherer klinischer Wirksamkeit und geringerer Nebenwirkungshäufigkeit – befindet sich derzeit in klinischen Studien.
- Um die Übertragung von Malaria tropica (durch Beeinflussung der Gametozyten) zu verhindern, wird Primaquin 3 Tage lang in einer Dosierung von 45 mg (27 mg Base) pro Tag (3 Tabletten) angewendet. Die Behandlung erfolgt in endemischen Regionen der tropischen Malaria. Bei der Anwendung von Fansidar zur Behandlung von Patienten mit Malaria tropica wird Primaquin aufgrund der wirksamen Wirkung von Pyrimethamin, das Bestandteil von Fansidar ist, auf die Gametozyten von Malaria tropica nicht verschrieben.
Die Behandlung einer schweren und/oder komplizierten Malaria tropica erfolgt auf Intensivstationen. Ist eine orale Gabe von Medikamenten nicht möglich, erfolgt eine parenterale Therapie mit einem der folgenden Medikamente:
- Chinindihydrochlorid – 10–20 mg/kg (bis zu 2,0 g pro Tag) intravenös in 500 ml 5%iger Glucoselösung, langsam, 2–3 Mal pro Tag, bis sich der Patient von einer schweren Erkrankung erholt hat, dann eines der oralen Arzneimittel gemäß dem Behandlungsschema für unkomplizierte Malaria tropica;
- Unter modernen Bedingungen werden in einigen Ländern neue Kräuterpräparate zur Behandlung schwerer Formen der Malaria tropica eingesetzt (diese Präparate sind in Russland nicht zugelassen): Artemether (Artenam) – 160 mg intramuskulär am ersten Tag, dann 80 mg für 6 Tage; Artesunat – 50 mg intramuskulär (intravenös) 2-mal täglich für 7 Tage; Artemisinin – 1200 mg intramuskulär für 7 Tage.
Die pathogenetische Behandlung der Malaria hängt vom Schweregrad der Erkrankung und dem Auftreten von Komplikationen ab. Es werden Entgiftungstherapien, Korrektur der metabolischen Azidose, Hypoglykämie, Diuretika, Antihistaminika, Glukokortikosteroide (je nach Indikation), Vitaminpräparate, Herz-Kreislauf-Medikamente und weitere Medikamente verschrieben. Bei Anurie kann eine Peritonealdialyse durchgeführt werden. Bei der Behandlung von hämoglobinurischem Fieber werden zunächst die Medikamente, die die Hämolyse verursacht haben, abgesetzt und eine Erythrozyten-Massentransfusion durchgeführt.
Rekonvaleszenten werden nach Abschluss einer vollständigen etiotropen parasitologischen Behandlung (Absetzen der Therapie) und bei 2–3 negativen Ergebnissen von Bluttests (dicker Tropfen) entlassen. Patienten mit Malaria tertiva oder Malaria ovale können ambulant eine weitere Behandlung mit Primaquin erhalten. Patienten mit Malaria werden 1–1,5 Monate lang überwacht, wobei alle 7–10 Tage wiederholte parasitologische Tests mit einem dicken Blutstropfen durchgeführt werden. Patienten mit Malaria tertiva, Malaria ovale und Malariae werden zwei Jahre lang überwacht, wobei bei jedem Temperaturanstieg parasitologische Tests mit einem dicken Blutstropfen obligatorisch sind.
Verhütung
Die WHO bekämpft Malaria weltweit im Rahmen des 1998 verabschiedeten Roll Back Malaria-Programms. Aktuell hat sich die WHO ein neues Ziel für die Europäische Region gesetzt: die Ausrottung der Dreitage-Malaria (P. vivax) bis 2010 und der tropischen Malaria bis 2015. Das wichtigste Glied in diesem Maßnahmenkomplex ist die rechtzeitige Erkennung und Behandlung von Infektionsquellen.
Präventive Maßnahmen bei einem Ausbruch zielen auf die rechtzeitige Erkennung und Behandlung von Malaria sowie von Parasitenträgern (Infektionsquellen) sowie auf die Bekämpfung von Malariaüberträgern ab. Derzeit gibt es keine wirksamen Impfstoffe zur aktiven Immunisierung gegen Malaria.
Die individuelle Malariaprophylaxe während des Aufenthalts in einem Endemiegebiet zielt darauf ab, eine Infektion zu verhindern und einen Malariaanfall zu vermeiden. Die Infektionsprävention besteht in Maßnahmen zum Schutz vor Mückenstichen (Verwendung von Abwehrmitteln, Netzen an Fenstern und Türen, Bettvorhängen, Kleidung, die Arme und Beine beim Aufenthalt im Freien abends und nachts bedeckt). Gemäß den Empfehlungen der WHO besteht die Vorbeugung eines Malariaanfalls in der Einnahme von Malariamedikamenten. Sie wird nur nicht immunen Personen empfohlen, die in Gebiete mit hohem Malariarisiko und mangelnder medizinischer Versorgung (Entfernung medizinischer Einrichtungen, Unmöglichkeit eines schnellen Bluttests auf Malaria) reisen.
Die Notwendigkeit der Anwendung, Dauer und Häufigkeit der Einnahme der Medikamente wird erst nach Rücksprache mit einem Spezialisten für Infektionskrankheiten bestimmt. Es ist wichtig, Kontraindikationen für die Einnahme von Chemotherapeutika und das Vorhandensein schwerer Begleiterkrankungen zu identifizieren. Schwangere, nicht immunisierte Frauen und kleine Kinder sollten keine Malaria-Endemiegebiete besuchen.
Aufgrund der hohen Resistenz von Malaria falciparum gegenüber Chloroquin ist Mefloquin laut WHO-Standardprävention derzeit 250 mg einmal wöchentlich, zwei Wochen vor der Abreise in ein Endemiegebiet und vier Wochen nach der Rückkehr. Die Anwendung weiterer Medikamente (Doxycyclin, Chloroquin in Kombination mit Proguanil, Atovaquin in Kombination mit Proguanil, Primaquin u. a.) wird von einem Spezialisten für Infektionskrankheiten unter Berücksichtigung der epidemiologischen Situation in der Aufenthaltsregion und weiterer oben genannter Faktoren festgelegt.
Prognose
In den meisten Fällen ist die tropische Malaria, genauer gesagt ihre zerebrale Form, die bei 10 % der schweren Fälle von Malaria tropica auftritt, für den Tod verantwortlich. Tödliche Verläufe bei anderen Malariaarten sind sehr selten. Bei rechtzeitiger Diagnose und angemessener Behandlung führt die tropische Malaria jedoch zu einer vollständigen Genesung.
Bei Patienten mit tropischer Malaria wird eine 1- bis 1,5-monatige Beobachtung in der Ambulanz empfohlen. Im Abstand von 1-2 Wochen werden parasitologische Blutuntersuchungen durchgeführt. Patienten mit Malaria durch P. vivax, P. ovale oder P. malariae sollten zwei Jahre lang in der Ambulanz beobachtet werden. Bei jedem Anstieg der Körpertemperatur sind Blutuntersuchungen im Labor erforderlich, um Malariaplasmodien frühzeitig zu identifizieren.

