Facharzt des Artikels
Neue Veröffentlichungen
Medikamente
Neuroleptika, oder Antipsychotika
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Antipsychotika (Neuroleptika) sind eine Klasse psychotroper Medikamente, die hauptsächlich zur Behandlung von Schizophrenie eingesetzt werden. Heutzutage unterscheidet man üblicherweise zwei Gruppen (oder Kategorien) von Medikamenten: typische und atypische Antipsychotika. Nachfolgend finden Sie Informationen zu den pharmakologischen Eigenschaften, Anwendungsgebieten und Nebenwirkungen der Therapie für jede dieser Medikamentengruppen.
Indikationen für den Einsatz typischer Antipsychotika
Derzeit sind die Hauptindikationen für die Verschreibung herkömmlicher Neuroleptika gemäß den Empfehlungen namhafter Forscher auf dem Gebiet der Psychopharmakotherapie die folgenden.
- Linderung psychomotorischer Unruhe und Verhaltensstörungen aufgrund schwerer psychotischer Symptome. In diesen Fällen ist die Anwendung oraler oder parenteraler Arzneimittel mit antipsychotischer Wirkung sowohl global (Clopromazin, Levomepromazin, Thioproperazin, Zuclopenthixol) als auch selektiv – in Form einer Wirkung auf halluzinatorisch-paranoide Störungen (Haloperidol, Trifluoperazin) – angezeigt.
- Anti-Rückfall-Therapie (präventive Therapie). Zu diesem Zweck werden Depotformen von Arzneimitteln verschrieben, insbesondere bei Patienten mit schlechter Medikamenten-Compliance (Haloperidol-Decanoat, verlängerte Form von Flupentixol), oder kleine oder mittlere Dosen von Arzneimitteln zur Erzielung einer enthemmenden (antinegativen) Wirkung, darunter Arzneimittel, deren hohe Dosen zur Linderung akuter psychotischer Störungen eingesetzt werden (Flupentixol, Zuclopenthixol). Bei dieser Therapieform wird auch die Verschreibung sogenannter kleiner Neuroleptika (Thioridazin, Chlorprothixen, Sulpirid) empfohlen, deren psychotrope Wirkung in der Beeinflussung der Manifestationen des depressiven Pols und von Schlafstörungen besteht.
- Überwindung der therapeutischen Resistenz gegen atypische Antipsychotika bei der Behandlung akuter psychotischer Zustände. Zu diesem Zweck werden üblicherweise parenterale Formen traditioneller Antipsychotika mit globaler (Chlorpromazin, Levomepromazin usw.) und selektiver (Haloperidol) antipsychotischer Wirkung verwendet.
Diese Medikamente verursachen verschiedene Nebenwirkungen, deren Art vom pharmakologischen Profil des jeweiligen Medikaments abhängt. Antipsychotika mit ausgeprägter cholinolytischer Wirkung verursachen häufiger Akkommodationsstörungen, Verstopfung, Mundtrockenheit und Harnverhalt. Eine sedierende Wirkung ist eher typisch für Antipsychotika mit ausgeprägter antihistaminischer Wirkung, und eine orthostatische Hypotonie ist eher typisch für Medikamente, die α1-adrenerge Rezeptoren blockieren. Die Blockade der cholinergen, nordrenergen und dopaminergen Übertragung durch typische Neuroleptika kann zu einer Reihe von Störungen im Sexualbereich führen, wie z. B. Amenorrhoe oder Dysmenorrhoe, Anorgasmie, Galaktorrhoe, Schwellung und Schmerzen der Brustdrüsen sowie verminderter Potenz. Nebenwirkungen im Sexualbereich sind hauptsächlich mit den cholinolytischen und adrenoblockierenden Eigenschaften dieser Medikamente sowie mit einer erhöhten Prolaktinsekretion aufgrund der Blockade des Dopaminstoffwechsels verbunden. Die schwerwiegendsten Nebenwirkungen typischer Neuroleptika sind motorische Störungen. Sie sind der häufigste Grund für das Absetzen der Medikamente. Zu den drei wichtigsten Nebenwirkungen der Therapie, die mit der Beeinflussung der motorischen Sphäre verbunden sind, zählen frühe extrapyramidale Syndrome, Spätdyskinesien und NMS.
Extrapyramidale Syndrome stehen vermutlich mit einer Blockade von D2-Rezeptoren in den Basalganglien im Zusammenhang. Dazu gehören Dystonie, neuroleptischer Parkinsonismus und Akathisie. Manifestationen einer akuten dystonischen Reaktion (Frühdyskinesie) umfassen plötzlich auftretende Hyperkinese, okulogyrische Krisen, Kontraktionen der Gesichts- und Rumpfmuskulatur sowie Opisthotonus. Diese Störungen sind dosisabhängig und treten häufig nach 2-5 Tagen Therapie mit hochwirksamen Neuroleptika wie Haloperidol und Fluphenazin auf. Zur Linderung der Frühdyskinesie wird die Neuroleptikadosis reduziert und Anticholinergika (Biperiden, Trihexyphenidyl) verschrieben. Spätdyskinesien betreffen meist die Nackenmuskulatur und sprechen im Gegensatz zur akuten dystonischen Reaktion weniger gut auf eine Behandlung mit Anticholinergika an. Neuroleptischer Parkinsonismus ist gekennzeichnet durch verminderte spontane motorische Fähigkeiten, Hypo- und Amimie, Ruhetremor und Rigidität. Es ist wichtig, diese Symptome von den äußerlich ähnlichen negativen Störungen bei Schizophrenie zu unterscheiden, die sich durch emotionale Entfremdung, Abstumpfung des Affekts und Anergie äußern. Um diese Nebenwirkungen zu korrigieren, ist die Einnahme von Anticholinergika, eine Dosisreduktion des Neuroleptikums oder dessen Ersatz durch ein atypisches Antipsychotikum angezeigt. Akathisie äußert sich in innerer Angst, der Unfähigkeit, lange an einem Ort zu bleiben, und dem Bedürfnis, Arme oder Beine ständig zu bewegen. Zur Linderung werden Anticholinergika und zentral wirksame Betablocker (Propranolol) eingesetzt.
Spätdyskinesien äußern sich in unwillkürlichen Bewegungen beliebiger Muskelgruppen, meist der Zungen- und Mundmuskulatur. Klinisch werden verschiedene Formen unterschieden: Dyskinesien der Wangen-, Zungen- und Mundmuskulatur (periodische Kontraktionen der Kaumuskulatur, die den Eindruck einer Grimasse erwecken; die Zunge kann unwillkürlich aus dem Mund des Patienten herausragen); Spätdystonie und Spätakathisie; (der Patient führt choreoathetoide Bewegungen von Kopf, Rumpf, oberen und unteren Extremitäten aus). Diese Form der Störung tritt hauptsächlich während der Langzeitbehandlung mit herkömmlichen Neuroleptika auf und wird bei etwa 15–20 % der Patienten festgestellt, die diese als Erhaltungstherapie einnehmen. Wahrscheinlich ist bei einigen Patienten das Risiko für die Entwicklung von Dyskinesiesymptomen erhöht, da einige von ihnen bereits vor der „Neuroleptika-Ära“ in der Schizophrenieklinik beobachtet wurden. Darüber hinaus wurden Spätdyskinesien bei älteren Frauen und Patienten mit affektiven Störungen beschrieben. Es wird angenommen, dass Spätdyskinesien mit einer Zunahme der Dopaminrezeptoren im Striatum einhergehen, obwohl auch GABAerge und andere Neurotransmittersysteme wahrscheinlich an ihrer Pathogenese beteiligt sind. Es gibt keine wirksame universelle Behandlung für diese Nebenwirkungen. Es wird vermutet, dass niedrig dosierte hochwirksame Neuroleptika mit Dopaminblocker oder Vitamin E bei diesen Erkrankungen einen mäßig positiven Effekt haben können. Die wirksamste Maßnahme bei Spätdyskinesien ist eine Dosisreduktion eines typischen Neuroleptikums oder dessen Ersatz durch ein atypisches Antipsychotikum.
Nach aktuellen Daten tritt das maligne neuroleptische Syndrom in etwa 0,5 % der Fälle einer Psychopharmakotherapie auf. Das seltene Auftreten einer solchen lebensbedrohlichen Komplikation lässt sich wahrscheinlich derzeit durch die flächendeckende Einführung atypischer Antipsychotika erklären, da das Risiko, während der Behandlung mit diesen Arzneimitteln ein NMS zu entwickeln, vernachlässigbar ist. Es ist allgemein anerkannt, dass die Hauptursache für die Entwicklung eines NMS eine übermäßige Blockade des dopaminergen Systems während der Therapie mit Neuroleptika ist, insbesondere nach einer Dosiserhöhung eines hochwirksamen Antipsychotikums. Die Hauptsymptome des NMS sind Hyperthermie, erhöhter Tonus der Skelettmuskulatur und Sehnenreflexe sowie Bewusstseinsstörungen mit Übergang ins Koma. Blutuntersuchungen zeigen Leukozytose, erhöhte Blutsenkungsgeschwindigkeit und Lebertransaminaseaktivität; Urinuntersuchungen weisen auf eine Albuminurie hin. Es kommt schnell zu Störungen des Wasser- und Elektrolythaushalts, was die Voraussetzungen für die Bildung eines Hirnödems schafft. Das NMS ist ein akuter Zustand, der eine dringende Krankenhauseinweisung des Patienten zur intensiven Infusionstherapie erfordert. Bei der Behandlung von NMS sind Flüssigkeitszufuhr und symptomatische Therapie von größter Bedeutung. In dieser Situation müssen alle verschriebenen Neuroleptika sofort abgesetzt werden. In einigen Fällen haben Dopaminrezeptoragonisten (z. B. Bromocriptin) oder Muskelrelaxantien eine positive Wirkung, deren Wirksamkeit jedoch nicht untersucht wurde. Nach Absetzen von NMS sollte die Einnahme des Neuroleptikums mindestens zwei Wochen lang ausgesetzt werden. Anschließend kann ein niedrig wirksames Antipsychotikum, vorzugsweise ein Medikament der neuen Generation, verschrieben werden. Die Dosis des neu verschriebenen Medikaments sollte äußerst vorsichtig erhöht werden, wobei der Zustand der Vitalfunktionen und Laborwerte (Blut- und Urinuntersuchungen) überwacht werden sollten.
Typische Neuroleptika verursachen selten gefährliche tödliche Komplikationen. Überdosierungserscheinungen hängen hauptsächlich mit dem individuellen antiadrenergen und anticholinergen Wirkungsprofil des Arzneimittels zusammen. Da diese Medikamente eine starke antiemetische Wirkung haben, ist zur Elimination aus dem Körper eine Magenspülung anstelle der Gabe von Brechmitteln angezeigt. Arterielle Hypotonie ist in der Regel eine Folge einer adrenergen Rezeptorblockade und sollte durch die Gabe von Dopamin und Noradrenalin korrigiert werden. Bei Herzrhythmusstörungen ist die Anwendung von Lidocain angezeigt.
Wirkmechanismus und pharmakologische Effekte typischer Antipsychotika
Mit der Entwicklung der Psychopharmakologie wurden verschiedene Optionen für die Wirkung von Antipsychotika auf Neurorezeptoren vorgeschlagen. Die Haupthypothese bleibt, dass sie Dopamin-Neurostrukturen (vor allem D2-Rezeptoren) beeinflussen, basierend auf Daten zur Störung des normalen Dopaminstoffwechsels in Gehirnstrukturen bei Psychosen. Dopamin-D2-Rezeptoren befinden sich in den Basalganglien, dem Nucleus accumbens und dem Frontalkortex; sie spielen eine führende Rolle bei der Regulierung des Informationsflusses zwischen Großhirnrinde und Thalamus.
Die Abbildung zeigt ein detaillierteres Verständnis der Störungen der Dopaminübertragung in den kortikalen und subkortikalen Bereichen des Gehirns und der Rolle dieser Störungen bei der Entwicklung von Schizophreniesymptomen (angepasst aus der Monographie von Jones RB, Buckley PF, 2006).
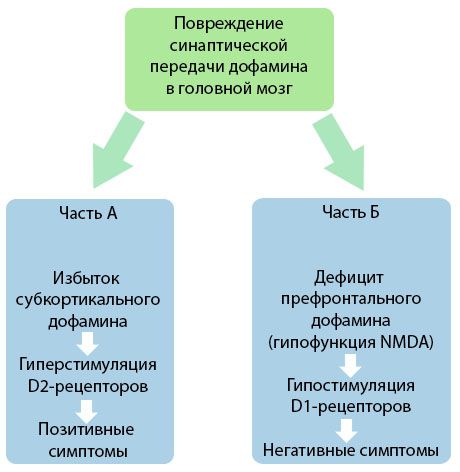
Teil A spiegelt die klassische, frühe Dopamintheorie wider und postuliert einen Dopaminüberschuss in subkortikalen Bereichen und eine Überstimulation der D2-Rezeptoren, was zur Entstehung produktiver Symptome führt. Teil B zeigt die spätere Modernisierung der Theorie Anfang der 1990er Jahre. Die bis dahin erhaltenen Daten zeigten, dass ein Dopaminmangel in den D-Rezeptoren zusammen mit einer unzureichenden Stimulation dieser Rezeptoren im präfrontalen Kortex zur Entstehung negativer Symptome und kognitiver Defizite führt. Daher sind nach modernem Verständnis beide Arten von Störungen der dopaminergen Übertragung – ein Überschuss an subkortikalem Dopamin und sein Mangel im präfrontalen Kortex – das kombinierte Ergebnis einer Störung der synaptischen Übertragung im präfrontalen Bereich und stehen in Zusammenhang mit einer Unterfunktion von N-Methyl-N-Aspartat. Neben dem zunächst isolierten Dopamin wurden später weitere an der Pathogenese der Schizophrenie beteiligte Neurotransmitter wie Serotonin, Gamma-Aminobuttersäure, Glutamat, Noradrenalin, Acetylcholin und verschiedene Neuropeptide identifiziert. Obwohl die Rolle dieser Mediatoren noch nicht vollständig erforscht ist, wird mit zunehmendem Wissen deutlich, dass sie sich in zahlreichen neurochemischen Veränderungen im Körper manifestieren. Daher ist die klinische Wirkung eines Antipsychotikums eine Summierung der Wirkungen auf verschiedene Rezeptorformationen und führt zur Beseitigung von Homöostasestörungen.
In den letzten Jahren wurden dank neuer Forschungsmethoden wie der Radioisotopenligandenbindung und der PET-Untersuchung bedeutende Fortschritte bei der Aufklärung des feinen biochemischen Wirkmechanismus von Neuroleptika erzielt. Insbesondere wurden die relative Stärke und der Tropismus von Arzneimitteln zur Bindung an einzelne Neurorezeptoren in verschiedenen Hirnarealen und -strukturen bestimmt. Es zeigte sich eine direkte Abhängigkeit der Stärke der antipsychotischen Wirkung eines Arzneimittels von der Stärke seiner blockierenden Wirkung auf verschiedene dopaminerge Rezeptoren. Kürzlich wurden vier Typen solcher Rezeptoren identifiziert:
- D1 befinden sich überwiegend im Bereich der Substantia nigra und des Striatums (der sogenannten nigrostriatalen Region) sowie der präfrontalen Region;
- D2 – in den nigrostriatalen, mesolimbischen Regionen und der Hypophyse (Prolaktinsekretion);
- D3 (präsynaptisch) – steuert in verschiedenen Gehirnstrukturen die dopaminerge Aktivität gemäß dem Gesetz der negativen Rückkopplung;
- D4 (präsynaptisch) – vorwiegend in den nigrostriatalen und mesolimbischen Bereichen.
Gleichzeitig gilt es als erwiesen, dass die Blockade der D2-Rezeptoren die Entwicklung antipsychotischer, sekundärer sedierender Wirkungen sowie extrapyramidaler Nebenwirkungen verursacht. Weitere klinische Manifestationen der Blockade dieser Rezeptoren sind die analgetische und antiemetische Wirkung von Neuroleptika (Verringerung von Übelkeit und Erbrechen durch Unterdrückung des Brechzentrums) sowie eine Abnahme des Wachstumshormonspiegels und eine Erhöhung der Prolaktinproduktion (neuroendokrine Nebenwirkungen, einschließlich Galaktorrhoe und Menstruationsstörungen). Eine langfristige Blockade nigrostriataler D2-Rezeptoren führt zum Auftreten ihrer Überempfindlichkeit, die für die Entwicklung von Spätdyskinesien und „Überempfindlichkeitspsychosen“ verantwortlich ist. Mögliche klinische Manifestationen der Blockade präsynaptischer D3- und D4-Rezeptoren sind hauptsächlich mit der stimulierenden Wirkung von Neuroleptika verbunden. Aufgrund der teilweisen Blockade dieser Rezeptoren in den nigrostriatalen und mesolimbokortikalen Bereichen können aktivierende und inzidive (starke, hochaktive) Neuroleptika in kleinen Dosen die dopaminerge Übertragung stimulieren und in hohen Dosen unterdrücken.
In den letzten Jahren hat das Interesse an der Funktion der serotonergen Systeme des Gehirns, einschließlich der Serotoninrezeptoren, stark zugenommen. Tatsächlich hat das serotonerge System in verschiedenen Teilen des Gehirns eine modulierende Wirkung auf dopaminerge Strukturen. Insbesondere im mesokortikalen Bereich hemmt Serotonin die Dopaminausschüttung, und dementsprechend führt die Blockade postsynaptischer 5-HT-Rezeptoren zu einem Anstieg des Dopaminspiegels. Bekanntlich ist die Entwicklung negativer Symptome bei Schizophrenie mit einer Unterfunktion dopaminerger Neuronen in den präfrontalen Strukturen der Großhirnrinde verbunden. Derzeit sind etwa 15 Typen zentraler 5-HT-Rezeptoren bekannt. Experimentell wurde festgestellt, dass Neuroleptika hauptsächlich an 5-HT-Rezeptoren der ersten drei Typen binden.
Diese Medikamente wirken hauptsächlich stimulierend (agonistisch) auf 5-HT1a-Rezeptoren. Mögliche klinische Folgen: erhöhte antipsychotische Aktivität, verringerte Schwere kognitiver Störungen, Korrektur negativer Symptome, antidepressive Wirkung und verringerte Inzidenz extrapyramidaler Nebenwirkungen.
Die Wirkung von Neuroleptika auf 5-HT2-Rezeptoren, insbesondere auf 5-HT2a-Subtypen, ist von erheblicher Bedeutung. Sie befinden sich hauptsächlich in der Großhirnrinde und ihre Empfindlichkeit ist bei Patienten mit Schizophrenie erhöht. Die Fähigkeit von Neuroleptika der neuen Generation, die Schwere negativer Symptome zu reduzieren, kognitive Funktionen zu verbessern, den Schlaf durch Verlängerung der Gesamtdauer der langsamwelligen (D-Wellen-)Schlafphasen zu regulieren, Aggressionen zu reduzieren und depressive Symptome sowie migräneartige (aufgrund zerebrovaskulärer Erkrankungen entstehende) Kopfschmerzen zu lindern, ist mit der Blockade von 5-HT2a-Rezeptoren verbunden. Andererseits sind mit der Blockade von 5-HT2a-Rezeptoren blutdrucksenkende Wirkungen und Ejakulationsstörungen bei Männern möglich.
Man geht davon aus, dass die Wirkung von Neuroleptika auf 5-HT2c-Rezeptoren eine sedierende (anxiolytische) Wirkung, gesteigerten Appetit (begleitet von einer Zunahme des Körpergewichts) und eine Verringerung der Prolaktinproduktion verursacht.
5-HT3-Rezeptoren befinden sich überwiegend im limbischen System. Bei einer Blockade tritt zunächst die antiemetische Wirkung ein, zudem werden die antipsychotischen und anxiolytischen Effekte verstärkt.
Das Auftreten von Parkinson-ähnlichen Symptomen hängt auch von der Blockierungskraft des Arzneimittels auf muskarinische cholinerge Rezeptoren ab. Cholinolytische und dopaminblockierende Wirkungen stehen bis zu einem gewissen Grad in wechselseitiger Beziehung. Es ist beispielsweise bekannt, dass D2-Rezeptoren im nigrostriatalen Bereich die Freisetzung von Acetylcholin hemmen. Wenn mehr als 75 % der D2-Rezeptoren im nigrostriatalen Bereich blockiert sind, wird das Gleichgewicht zugunsten des cholinergen Systems gestört. Dies ist der Grund für die korrigierende Wirkung von Anticholinergika (Korrektoren) auf neuroleptische extrapyramidale Nebenwirkungen. Chlorprothixen, Clozapin und Olanzapin haben eine hohe Affinität zu muskarinischen Rezeptoren und verursachen praktisch keine extrapyramidalen Nebenwirkungen, da sie cholinerge und dopaminerge Rezeptoren gleichzeitig blockieren. Haloperidol- und Piperazinphenothiazin-Derivate haben eine ausgeprägte Wirkung auf Dopaminrezeptoren, jedoch eine sehr schwache Wirkung auf Cholinrezeptoren. Dies liegt an ihrer Fähigkeit, ausgeprägte extrapyramidale Nebenwirkungen hervorzurufen, die bei sehr hohen Dosen reduziert werden, wenn die cholinolytische Wirkung spürbar wird. Neben der Verringerung der Dopamin-blockierenden Wirkung auf D2-Rezeptoren der nigrostriatalen Region und der Nivellierung extrapyramidaler Nebenwirkungen kann eine starke cholinerge Wirkung zu einer Verschlechterung der kognitiven Funktionen, einschließlich Gedächtnisstörungen, sowie zu peripheren Nebenwirkungen (trockene Schleimhäute, Sehstörungen, Verstopfung, Harnverhalt, Verwirrtheit usw.) führen. Neuroleptika haben eine ziemlich starke blockierende Wirkung auf Histaminrezeptoren vom Typ I, was vor allem mit der Schwere der sedierenden Wirkung sowie einer Gewichtszunahme aufgrund gesteigerten Appetits verbunden ist. Die antiallergische und juckreizstillende Wirkung von Neuroleptika wird auch mit ihren antihistaminischen Eigenschaften in Verbindung gebracht.
Neben der Dopaminblockierung, den antiserotonergen, cholinolytischen und antihistaminischen Wirkungen haben die meisten Neuroleptika adrenolytische Eigenschaften, d. h. sie blockieren sowohl zentrale als auch periphere a1-Adrenorezeptoren. Adrenoblocker wie Chlorpromazin und Chlorprothixen haben eine ausgeprägte sedierende Wirkung. Darüber hinaus kann die blockierende Wirkung dieser Medikamente neurovegetative Nebenwirkungen (arterielle Hypotonie, Tachykardie usw.) sowie eine Verstärkung der blutdrucksenkenden Wirkung von Adrenoblockern verursachen.
Die Arbeiten einer Vielzahl von Autoren liefern Daten zur Bindungsstärke (Affinität) einzelner Neuroleptika an unterschiedliche Typen von Neurorezeptoren.
Aufgrund ihres neurochemischen Wirkprofils lassen sich typische und atypische Antipsychotika, die in der klinischen Praxis vorherrschend sind, grob in sechs Gruppen einteilen.
Die erste Gruppe besteht aus selektiven Blockern von D2- und D4-Rezeptoren (Sulpirid, Amisudprid, Haloperidol usw.) aus den Gruppen der Benzamid- und Butyrophenon-Derivate. In kleinen Dosen aktivieren sie hauptsächlich aufgrund der Blockade präsynaptischer D4-Rezeptoren die dopaminerge Übertragung von Nervenimpulsen und wirken stimulierend (enthemmend). In großen Dosen blockieren sie D2-Rezeptoren in allen Bereichen des Gehirns, was sich klinisch in einer ausgeprägten antipsychotischen Wirkung sowie in extrapyramidalen und endokrinen (aufgrund von Prolaktinämie) Nebenwirkungen äußert.
Die zweite Gruppe umfasst hochaktive D2-Rezeptorblocker sowie Arzneimittel, die 5-HT2a- und 5-HT1a-Rezeptoren schwach oder mäßig blockieren (Flupentixol, Fluphenazin, Zuclopenthixol usw.), d. h. hauptsächlich Piperazinderivate von Phenothiazin oder Thioxanthenen mit ähnlicher stereochemischer Struktur. Wie die Arzneimittel der ersten Gruppe haben diese Neuroleptika vor allem eine ausgeprägte antipsychotische (einschneidende) Wirkung und verursachen auch extrapyramidale Pye-Effekte und Prolaktinämie. In kleinen Dosen haben sie eine mäßig aktivierende (psychostimulierende) Wirkung.
Die dritte Gruppe besteht aus polyvalenten sedierenden Neuroleptika, die die meisten Neurorezeptoren undifferenziert blockieren. Diese Medikamente haben eine deutlich ausgeprägte blockierende Wirkung auf Dopaminrezeptoren und verursachen zudem starke adrenolytische und cholinolytische Wirkungen. Dazu gehören die meisten sedierenden Neuroleptika, vor allem aliphatische und Piperidinderivate von Phenothiazin sowie Thioxanthene, die ihnen in ihrer stereochemischen Struktur nahestehen (Chlorpromazin, Levomepromazin, Chlorprothixen usw.). Das Spektrum der psychotropen Wirkung dieser Medikamente wird vor allem von einer ausgeprägten primären sedierenden Wirkung dominiert, die sich unabhängig von der verwendeten Dosis entwickelt, und einer moderaten antipsychotischen Wirkung. Darüber hinaus verursachen Arzneimittel dieser Gruppe aufgrund ihrer ausgeprägten anticholinergen Wirkung schwache oder mäßige extrapyramidale und neuroendokrine Nebenwirkungen, führen jedoch aufgrund einer ausgeprägten Blockade der a1-adrenergen Rezeptoren häufig zur Entwicklung einer orthostatischen Hypotonie und anderer autonomer Reaktionen.
Die vierte Gruppe umfasst Neuroleptika, die D2- und 5-HT2a-Rezeptoren auf ausgewogene Weise blockieren, d. h. in gleichem Ausmaß (letztere in etwas größerem Ausmaß) und a1-Adrenorezeptoren in mäßigem Ausmaß. Diese Gruppe umfasst Vertreter der neuen Generation atypischer Antipsychotika (Risperidon, Ziprasidon, Sertindol), die unterschiedliche chemische Strukturen aufweisen. Der neurochemische Wirkungsmechanismus bestimmt ihre selektive Wirkung hauptsächlich auf die mesolimbischen und mesokortikalen Bereiche des Gehirns. Neben einer ausgeprägten antipsychotischen Wirkung, dem Fehlen oder der schwachen Ausprägung extrapyramidaler Nebenwirkungen (bei Verwendung therapeutischer Dosen), schwacher oder mäßiger Prolaktinämie und mäßigen adrenolytischen Eigenschaften (hypotensive Reaktionen) ist diese Gruppe von Neuroleptika in der Lage, negative Symptome durch indirekte Stimulation der dopaminergen Übertragung in der Großhirnrinde zu korrigieren.
Die fünfte Gruppe besteht aus polyvalenten atypischen Antipsychotika vom Typ des trizyklischen Dibenzodiazepins oder ähnlicher Struktur (Clozapin, Olanzapin und Quetiapin). Ebenso wie die Arzneimittel der dritten Gruppe blockieren sie die meisten Neurorezeptoren undifferenziert. Allerdings werden 5-HT2a-Rezeptoren stärker blockiert als D2- und D4-Rezeptoren, insbesondere jene im nigrostriatalen Bereich. Dies führt zum tatsächlichen Fehlen oder schwachen extrapyramidalen Effekts und zum Fehlen neuroendokriner Nebenwirkungen, die mit einer erhöhten Prolaktinproduktion einhergehen, bei gleichzeitig ausgeprägter antipsychotischer Wirkung und der Fähigkeit, die Schwere negativer Symptome zu verringern. Darüber hinaus besitzen alle Arzneimittel dieser Gruppe ausgeprägte adrenolytische und antihistaminische Eigenschaften, die für die sedierende und blutdrucksenkende Wirkung verantwortlich sind. Clozapin und Olanzapin haben zudem eine recht ausgeprägte blockierende Wirkung auf muskarinische Rezeptoren und führen zur Entwicklung cholinolytischer Nebenwirkungen.
Somit ist die Fähigkeit, postsynaptische dopaminerge Rezeptoren mit einer kompensatorischen Steigerung der Synthese und des Stoffwechsels von Dopamin zu blockieren, die einzige gemeinsame biochemische Eigenschaft aller in diesen Gruppen betrachteten Neuroleptika.
Die sechste Gruppe umfasst das einzige atypische Antipsychotikum – Aripiprazol, das erst vor relativ kurzer Zeit auf dem heimischen Psychopharmakamarkt erschienen ist. Dieses Medikament ist ein partieller Agonist der D2-Dopaminrezeptoren und wirkt als funktioneller Antagonist im hyperdopaminergen Zustand und als funktioneller Agonist im hypodopaminergen Profil. Dieses einzigartige Rezeptorprofil von Aripiprazol ermöglicht es, das Risiko extrapyramidaler Störungen und Hyperprolaktinämie bei seiner Anwendung zu reduzieren. Darüber hinaus wirkt Aripiprazol als partieller Agonist der 5-HT1a-Rezeptoren und gleichzeitig als Antagonist der 5-HT2a-Rezeptoren. Es wird angenommen, dass eine solche Interaktion mit Rezeptoren zu einer insgesamt ausgeglichenen Funktion der Serotonin- und Dopaminsysteme führt, sodass der Wirkmechanismus von Aripiprazol als Stabilisierung des Dopamin-Serotonin-Systems bezeichnet werden kann.
Der aktuelle Kenntnisstand über die neurochemischen Wirkmechanismen von Neuroleptika erlaubt es uns daher, eine neue, pathogenetisch fundiertere pharmakodynamische Klassifikation dieser Gruppe von Psychopharmaka vorzuschlagen. Die Verwendung dieser Klassifikation ermöglicht es uns, das Spektrum der psychotropen Wirkung, die Verträglichkeit und die wahrscheinlichen Arzneimittelwechselwirkungen eines bestimmten Arzneimittels weitgehend vorherzusagen. Mit anderen Worten: Die Merkmale der neurochemischen Aktivität eines Arzneimittels bestimmen weitgehend die Merkmale seiner klinischen Aktivität, die bei der Auswahl eines bestimmten Antipsychotikums für einen bestimmten Patienten berücksichtigt werden sollten.
Die Wirksamkeit der globalen antipsychotischen Wirkung eines Neuroleptikums wird anhand des sogenannten Chlorpromazinäquivalents geschätzt, das mit 1 angenommen wird. Beispielsweise beträgt das Chlorpromazinäquivalent von Haloperidol 50. Dies bedeutet, dass die antipsychotische Wirksamkeit von 1 mg Haloperidol mit der von 50 mg Chlorpromazin vergleichbar ist. Basierend auf diesem Indikator wurde eine Klassifikation entwickelt, die die Zuordnung von Neuroleptika mit hoher (Chlorpromazinäquivalent > 10,0), mittlerer (Chlorpromazinäquivalent = 1,0–10,0) und niedriger (Chlorpromazinäquivalent = 1,0) antipsychotischer Aktivität, genannt Patentität, vorsieht. Typische Neuroleptika (Antipsychotika der ersten Generation) werden seit fast einem halben Jahrhundert in der klinischen Psychopharmakotherapie häufig eingesetzt. Ihr therapeutisches Wirkungsspektrum umfasst:
- globale antipsychotische Wirkung in Form der Fähigkeit, verschiedene Manifestationen von Psychosen gleichmäßig und differenziell zu reduzieren:
- primäre beruhigende (hemmende) Wirkung – die Fähigkeit von Arzneimitteln, psychomotorische Unruhe schnell zu lindern;
- selektive, selektive antipsychotische Wirkung, die sich in der Fähigkeit manifestiert, einzelne Symptome zu beeinflussen: Delirium, Halluzinationen, Enthemmung von Trieben usw.;
- aktivierende (enthemmende, enthemmende, antiautistische) neurotrope Wirkung, die sich in der Entwicklung extrapyramidaler Symptome manifestiert;
- somatotrope Wirkung in Form der Entwicklung neuroendokriner und vegetativer Nebenwirkungen;
- dämpfende Wirkung, die sich in der Fähigkeit einiger Antipsychotika äußert, depressive Symptome hervorzurufen.
Die Wirksamkeit von Antipsychotika der ersten Generation bei der Behandlung nicht nur psychotischer Störungen, sondern auch von Störungen der Borderline-Psychiatrie ist vielfach nachgewiesen und unbestritten. Daher werden sie trotz der hohen Häufigkeit von Nebenwirkungen der Therapie bei ihrer Verschreibung weiterhin in der medizinischen Praxis eingesetzt.
Atypische Antipsychotika
Moderne Leitlinien enthalten Daten zu den Vorteilen des Einsatzes von Antipsychotika der zweiten Generation in der Pharmakotherapie. Der Begriff „atypisch“ (Synonym – Antipsychotika der zweiten Generation) ist bedingt und wird hauptsächlich zur Vereinfachung der Bezeichnung der neuen Generation verwendet. Im Vergleich zu herkömmlichen Neuroleptika sind Medikamente dieser Gruppe wirksamer bei der Korrektur negativer, affektiver und kognitiver Störungen, was mit einer besseren Verträglichkeit und einem geringeren Risiko für extrapyramidale Symptome einhergeht. Unterschiede in der Art der therapeutischen Wirkung des einen oder anderen Arzneimittels aus einer Reihe atypischer Antipsychotika erklären sich, wie in der Gruppe der typischen Neuroleptika, durch sein individuelles pharmakologisches Wirkprofil.
Um die Möglichkeiten einer Psychopharmakotherapie mit atypischen Antipsychotika zu verdeutlichen, empfiehlt es sich, sich auf die in Russland zugelassenen Medikamente dieser Gruppe zu konzentrieren.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapin (Dibenzodiazepin)
Der Begründer der Gruppe der atypischen Antipsychotika. Der Wirkmechanismus von Clozapin ist durch eine leichte Blockade der D2-Rezeptoren bei gleichzeitig starkem Antagonismus der 5-HT2a-Rezeptoren, a1-, a2-adrenergen und H1-Histaminrezeptoren gekennzeichnet. Es hat sich als wirksames Antipsychotikum bei Resistenzen gegen andere Antipsychotika (ein Medikament der Reservegruppe) bewährt und ist auch zur Behandlung von chronischer Manie, psychotischer Agitation und Aggression indiziert. In der häuslichen Praxis wird Clozapin häufig zur Sedierung und als Hypnotikum bei psychotischen Patienten verschrieben. Es ist zu beachten, dass diese Anwendung von Clozapin nicht seinem Hauptindikationsprofil für die therapeutische Anwendung entspricht. Wahrscheinlich sollte die Einstellung zu diesem Antipsychotikum als Medikament von untergeordneter Bedeutung überdacht werden, da es heute das einzige Medikament mit nachgewiesener Wirksamkeit bei resistenten Patienten ist.
Clozapin verursacht im Gegensatz zu typischen Neuroleptika aufgrund der erwähnten geringen Affinität zu O2-Rezeptoren keine schwerwiegenden extrapyramidalen Störungen. Es zeigte sich auch, dass es zur Behandlung von Spätdystonie und schwerer Akathisie eingesetzt werden kann. Aufgrund des geringen Risikos, an NMS zu erkranken, kann Clozapin als Medikament der Wahl bei Patienten angesehen werden, die zuvor an dieser Komplikation gelitten haben.
Während der Clozapin-Therapie können jedoch eine Reihe schwerwiegender Nebenwirkungen auftreten. Die gefährlichste davon (selbst bei Verschreibung niedriger Dosen) ist die Agranulozytose, die bei 0,5-1,0 % der Patienten auftritt. Weitere wichtige Nebenwirkungen, die bei der Anwendung des Arzneimittels auftreten können, sind Schläfrigkeit, Hypersalivation und Gewichtszunahme, die zum Zeitpunkt der Clozapin-Verschreibung aufgrund einer früheren antipsychotischen Therapie oft bereits erhöht ist. Es sollte auch auf die Möglichkeit geachtet werden, dass bei der Einnahme von Clozapin Tachykardie, arterielle Hypotonie und epileptische Anfälle auftreten können. Die Wahrscheinlichkeit von Anfällen hängt von der Dosis ab. Ihr Risiko steigt signifikant an, wenn die Clozapin-Dosis 600 mg/Tag überschreitet. Das Auftreten von Anfällen ist keine Kontraindikation für die weitere Anwendung des Arzneimittels, erfordert jedoch eine Halbierung der Dosis und die Verschreibung von Antikonvulsiva wie Valproinsäure. Zur Vorbeugung von Nebenwirkungen der Clozapin-Behandlung gehört eine sorgfältige Überwachung der Anzahl weißer Blutkörperchen sowie des EKG und der endokrinen Parameter.
Eine Überdosierung von Clozapin kann zu Bewusstseinsstörungen bis hin zum Koma sowie zu Symptomen im Zusammenhang mit der cholinolytischen Wirkung (Tachykardie, Delirium), epileptischen Anfällen, Atemdepression und extrapyramidalen Syndromen führen. Bei einer Dosis von mehr als 2500 mg des Arzneimittels kann es zum Tod kommen.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Ein Benzisoxazol-Derivat mit hoher Affinität zu Serotonin- und Dopamin-Dj-Rezeptoren und einer vorherrschenden Wirkung auf das Serotoninsystem. Das Medikament hat ein breites Anwendungsspektrum, darunter die Linderung von Exazerbationen, die Behandlung von Rückfällen, die Therapie der ersten psychotischen Episode und die Korrektur negativer Symptome der Schizophrenie. Das Medikament verbessert nachweislich die kognitiven Funktionen bei Patienten mit Schizophrenie. Erste Daten zeigen, dass Risperidon auch komorbide affektive Symptome bei Patienten mit Schizophrenie reduziert und ein Medikament der Wahl bei der Behandlung bipolarer affektiver Störungen sein könnte.
Nebenwirkungen der Risperidon-Therapie, insbesondere extrapyramidale Störungen, sind dosisabhängig und treten häufiger bei Dosen über 6 mg/Tag auf. Weitere Nebenwirkungen sind Übelkeit, Erbrechen, Angstzustände, Schläfrigkeit und erhöhte Serumprolaktinspiegel. Die Langzeitanwendung von Risperidon kann zu Gewichtszunahme und zur Entwicklung von Typ-2-Diabetes mellitus führen, jedoch mit geringerer Wahrscheinlichkeit als bei Clozapin und Olanzapin.
Eine Überdosierung kann zu Somnolenz, epileptischen Anfällen, einer Verlängerung des QT-Intervalls und einer Erweiterung des QRS-Komplexes sowie zu arterieller Hypotonie führen. Es wurden Fälle mit tödlichem Ausgang aufgrund einer Risperidon-Überdosierung beschrieben.
Der unbestrittene Vorteil des Arzneimittels ist die Verfügbarkeit flüssiger und schnell auflösender (sublingualer) Formen, deren Verwendung den Eintritt des Arzneimittels in den Körper des Patienten beschleunigt und die Kontrolle über seine Einnahme erleichtert. Es gibt auch eine verlängerte Form des Arzneimittels - Pulver zur Herstellung einer Suspension zur intramuskulären Verabreichung (Consta-Risperidon in Mikrosphären). Es wird zur Erhaltungstherapie von Patienten mit Schizophrenie empfohlen, insbesondere für Patienten mit geringer Compliance. Es ist zu berücksichtigen, dass das Arzneimittel etwa drei Wochen benötigt, um in den Blutkreislauf zu gelangen. Daher muss der Patient zu Beginn der Therapie mit Consta-Risperidon mindestens 3 Wochen nach der ersten Injektion zusätzlich die orale Form von Risperidon einnehmen.
Olanzapin
In Bezug auf die pharmakologische Wirkung ähnelt es Clozapin, da es ein pleiomorphes Rezeptorprofil mit signifikanter Affinität zu Serotonin-, Muskarin-, α1-adrenergen und Histaminrezeptoren aufweist. Die therapeutische Aktivität von Olanzapin weist hinsichtlich der Wirkung auf positive, negative und depressive Symptome der Schizophrenie ähnliche Merkmale auf wie die Wirksamkeit von Clozapin und Risperidon. Gleichzeitig wurden Daten zur höheren Wirksamkeit von Olanzapin im Vergleich zu anderen atypischen Antipsychotika bei Patienten mit der ersten psychotischen Episode und bei der Korrektur kognitiver Funktionsindikatoren erhalten. Es ist zu beachten, dass zu Beginn der Therapie mit der Tablettenform des Arzneimittels eine schnelle enthemmende Wirkung mit verstärkter psychomotorischer Unruhe und Angst auftreten kann. Daher ist bei der Behandlung von Anfällen, die mit schwerer psychomotorischer Unruhe einhergehen, die Verwendung der Injektionsform des Arzneimittels angezeigt.
Olanzapin verursacht selten extrapyramidale Störungen oder Spätdyskinesien, und die am häufigsten auftretenden Nebenwirkungen bei seiner Anwendung sind Stoffwechselstörungen und Gewichtszunahme. Es wurde festgestellt, dass bei Patienten, die Olanzapin erhalten, häufig erhöhte Cholesterin- und Plasmalipidwerte sowie eine Neigung zu Diabetes mellitus Typ 2 auftreten. Solche Effekte traten jedoch bei Patienten, die sowohl Olanzapin als auch Clozapin erhielten, gleichermaßen häufig auf. Gleichzeitig liegen Daten vor, die zeigen, dass eine Gewichtszunahme mit einer positiven Reaktion auf Olanzapin korreliert (d. h. als wichtiger prognostischer Indikator für die Therapie dient) und nur bei 20–30 % der Patienten, die während der Behandlung an Gewicht zugenommen haben, zu Fettleibigkeit führt.
Eine Überdosierung kann zu Sedierung, toxischen anticholinergen Effekten, epileptischen Anfällen und arterieller Hypotonie führen. Derzeit liegen keine aussagekräftigen Daten zur Beurteilung des Sterberisikos bei Überdosierung vor.
Quetiapin
Es wird als Dibenzothiazepin-Verbindung klassifiziert. Sein Rezeptorprofil ähnelt weitgehend dem von Clozapin. Die Bindung von Quetiapin an D2-Rezeptoren ist gering (weniger als 50 %) und auch bei hohen Dosen nur von kurzer Dauer. Das Medikament ist wirksam bei der Behandlung positiver, negativer und allgemeiner Symptome der Schizophrenie. Es gibt Belege für seinen erfolgreichen Einsatz sowohl bei hoher Therapieresistenz als auch zur Verbesserung der kognitiven Funktionen von Patienten, was es als First-Line-Antipsychotikum zur Erhaltungstherapie der Schizophrenie empfiehlt. Schließlich hat Quetiapin eine mäßig antidepressive, aktivierende Wirkung. Daher ist es zur Behandlung depressiv-wahnhafter Anfälle und Störungen des senesto-hypochondrischen Kreises indiziert.
Die nachgewiesene hohe thymotrope Wirkung von Quetiapin erklärt die Zulassung als Mittel zur Linderung und Sekundärprävention depressiver Störungen. Zur Behandlung manischer Episoden bei bipolaren Störungen vom Typ I und II wird Quetiapin als zusätzliches Mittel eingesetzt. Das Fehlen einer injizierbaren Darreichungsform schränkt die Anwendung bei Patienten mit Agitiertheit und aggressivem Verhalten etwas ein.
Quetiapin wird gut vertragen und verursacht praktisch keine extrapyramidalen Syndrome, außer in Fällen, in denen Höchstdosen verwendet werden. Quetiapin verursacht keine Hyperprolaktinämie, seltener als Olanzapin und Clozapin, führt es zu Gewichtszunahme und beeinträchtigter Glukosetoleranz.
Ziprasidon
Hat ein einzigartiges Rezeptoraktivitätsprofil. Als potenter Antagonist von 5HT2a-Rezeptoren und D2-Rezeptoren ist es auch ein aktiver Inhibitor der Serotonin- und Noradrenalin-Wiederaufnahme. Klinische Studien haben eine signifikante Überlegenheit von Ziprasidon in seiner Wirkung auf psychotische Symptome und Manifestationen von Aggression im Vergleich zu Haloperidol gezeigt. Es gibt auch Daten zur positiven Wirkung von Ziprasidon auf die kognitiven Funktionen von Patienten mit Schizophrenie sowie auf komorbide affektive Symptome, Indikatoren für soziales Funktionieren. Ziprasidon wird im Allgemeinen gut vertragen und verursacht sehr selten extrapyramidale Syndrome, Gewichtszunahme und Stoffwechselstörungen. Häufiger kommt es zu einer Verlängerung des QT-Intervalls über 460 ms, daher ist es für Patienten, die dieses Medikament erhalten, ratsam, sich sowohl vor der Verschreibung des Medikaments als auch während der Behandlung einer EKG-Untersuchung zu unterziehen. Besondere Aufmerksamkeit sollte der gleichzeitigen Therapie (Einnahme von Antiarrhythmika) gewidmet werden, da diese die Verlängerung des QT-Intervalls verschlimmern und zur Entwicklung von Herzrhythmusstörungen und Kammerflimmern führen kann.
Sertindol
Gehört zu den Phenylindol-Derivaten. Es weist einen hohen funktionellen Antagonismus gegenüber D2-, Serotonin- (insbesondere 5-HT2a-Rezeptoren) und a1-adrenergen Rezeptoren auf. Elektroneurochemischen Studien zufolge hemmt Sertindol selektiv Dopaminrezeptoren im ventralen Segmentbereich. Diese Selektivität gewährleistet aller Wahrscheinlichkeit nach ein geringes Risiko für extrapyramidale Syndrome und Hyperprolaktinämie bei der Anwendung des Arzneimittels. Vergleichsstudien haben gezeigt, dass Sertindol hinsichtlich seiner antipsychotischen Wirkung mit Haloperidol vergleichbar ist. Das Arzneimittel hat eine ausgeprägte enthemmende Wirkung bei Patienten mit negativen und depressiven Symptomen, die der ähnlichen Wirkung von Rispolept überlegen ist. Es gibt auch Belege für die Wirksamkeit von Sertindol bei der Korrektur kognitiver Beeinträchtigungen bei Patienten mit Schizophrenie. Sertindol wird von den Patienten im Allgemeinen gut vertragen, verursacht selten eine Sedierung und wird daher als Ersatzmedikament empfohlen, wenn unter der Therapie mit anderen modernen Antipsychotika Nebenwirkungen auftreten.
Zu den schwerwiegenden Nebenwirkungen gehört die Fähigkeit des Medikaments, das QT-Intervall zu verlängern, was zu Herzrhythmusstörungen führen kann. Bei der Analyse von Post-Marketing-Studien wurde deutlich, dass sich das Herzprofil von Sertindol nicht von dem anderer Antipsychotika der neuen Generation unterscheidet.
Aripiprazol
Es hat eine mit anderen atypischen Wirkstoffen vergleichbare antipsychotische Wirkung, hat jedoch einen stärkeren Einfluss auf die Parameter der kognitiven Funktion von Patienten mit Schizophrenie. Die oben erwähnte einzigartige pharmakologische Wirkung des Arzneimittels - ein partieller Agonist von D2-Rezeptoren - ermöglicht es, das Risiko extrapyramidaler Syndrome und Hyperprolaktinämie bei seiner Anwendung zu verringern.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprid
Gehört zur Klasse der substituierten Benzamide. Das Medikament bindet selektiv an die Subtypen der dopaminergen Rezeptoren D2 und D3, hat keine Affinität zu den Subtypen D1, D4 und D5 sowie zu Serotonin-, H1-Histamin-, a1-adrenergen und cholinergen Rezeptoren. In hohen Dosen blockiert es postsynaptische D2-Rezeptoren. In niedrigen Dosen manifestiert sich seine enthemmende Wirkung aufgrund der Blockade präsynaptischer D2- und D3-Rezeptoren, wodurch seine Anwendung auch bei der Behandlung negativer Symptome wirksam ist, obwohl es kein kombinierter Antagonist von D2- und Serotoninrezeptoren ist. Die Ergebnisse einer Reihe von Studien weisen auf eine ausgeprägte antipsychotische Aktivität des Arzneimittels bei Verwendung in hohen Dosen hin, die herkömmlichen Arzneimitteln überlegen ist.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Nebenwirkungen der antipsychotischen Therapie
In der Tabelle sind die wichtigsten Nebenwirkungen einer atypischen antipsychotischen Therapie aufgeführt.
Vorbereitung |
Extrapyramidale |
Reizleitungsstörung im EKG |
Stoffwechselstörungen (Gewichtszunahme, erhöhte Glukose-, Cholesterin- und Triglyceridwerte im Blut) |
||
Clozapin |
. |
++ |
++ |
++- |
|
Risperidon |
++ |
+/- |
++ |
+/- |
|
Olanzapin |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapin |
+/- |
+ |
+/- |
--- |
|
Ziprasidon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprid |
++ |
+/- |
|||
Hinweis. Schwere der Nebenwirkungen: "+++" - hoch; "++" - durchschnittlich; "+" - gering; "+/-" - fraglich; "-" - nicht vorhanden.
Extrapyramidale Syndrome
Eines der Hauptmerkmale atypischer Antipsychotika ist im Gegensatz zu herkömmlichen ihre geringe Fähigkeit, extrapyramidale Syndrome zu verursachen, was einen Durchbruch in der Erhaltungspharmakotherapie der Schizophrenie darstellte. Wie aus den Daten in der Tabelle hervorgeht, können jedoch bei der Anwendung einzelner Arzneimittel dieser Reihe (Risperidon, Amisulprid) solche Symptome auftreten, die bei der Verschreibung besondere Aufmerksamkeit erfordern.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
EKG-Anomalien
Die Möglichkeit kardialer Nebenwirkungen stellt bei der Anwendung einiger moderner Antipsychotika in der Therapie ein ernstes Problem dar. In diesen Fällen handelt es sich um eine Verlängerung des QT-Intervalls, die zur Entwicklung von Arrhythmien führen kann. Reizleitungsstörungen, vor allem eine Verlängerung des QT-Intervalls, treten am häufigsten während der Behandlung mit Clozapin, Sertindol und Ziprasidon auf. Begleiterkrankungen wie Bradykardie, AV-Block und Hypothyreose können während der Therapie mit den oben genannten Arzneimitteln zum Auftreten dieser Komplikation beitragen. Derzeit wird bei Patienten, die eine Erhaltungstherapie mit atypischen Antipsychotika erhalten, eine EKG-Überwachung etwa alle 3 Monate empfohlen.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokrine Störungen
Derzeit besteht die größte Sorge darin, dass atypische Antipsychotika eine Gewichtszunahme verursachen können. Erhöhtes Körpergewicht, erhöhte Glukose- und Triglyceridwerte im Blut können zu Stoffwechselstörungen und der Entwicklung von Typ-2-Diabetes führen. Besondere Vorsicht und eine wöchentliche Überwachung der biochemischen Parameter sind während der Therapie mit Clozapin und Olanzapin geboten. Laut J. Geddes et al. (2000), PB Jones, PF Buckley (2006) ist eine gründliche Untersuchung der Patienten vor der Verschreibung eines bestimmten Antipsychotikums der modernen Generation angebracht, da bekannt ist, dass Stoffwechselstörungen häufiger bei Patienten auftreten, die vor Behandlungsbeginn eine erbliche Veranlagung, Übergewicht, Lipidspektrumstörungen und Hyperglykämie hatten. Der von PB Jones, PF Buckley (2006) vorgeschlagene Überwachungsalgorithmus umfasst mehrere Punkte.
- Erhebung der Anamnese und familiärer Faktoren hinsichtlich des Risikos für Stoffwechselerkrankungen.
- Erfassung von Body-Mass-Index, EKG, Blutdruck und Puls vor Behandlungsbeginn.
- Erhebung von Labordaten (Glukose, Lipidprofil, Cholesterin) vor Therapiebeginn.
- Regelmäßige Überwachung des Body-Mass-Index und der Vitalfunktionen während der Behandlung.
- Überwachung der Labordaten während der Behandlung.
Das Auftreten einer Hyperprolaktinämie während einer antipsychotischen Therapie ist auf eine zentrale Blockade der Dopaminrezeptoren im Hypothalamus zurückzuführen, die zur Freisetzung von Prolaktin aus dem Hypophysenvorderlappen führt. Hyperprolaktinämie tritt am häufigsten bei der Behandlung mit Olanzapin, Risperidon und Amisulprid auf.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulozytose
Eine weitere schwerwiegende Komplikation der antipsychotischen Therapie. Sie kann während der Behandlung mit Clozapin und Olanzapin auftreten. Laut J. Geddes et al. (2000) wurde sie innerhalb der ersten drei Monate bei 1–2 % der Patienten diagnostiziert, die diese Medikamente einnahmen. In diesem Zusammenhang werden Patienten, die diese Medikamente einnehmen, in den ersten 18 Wochen der Therapie wöchentliche Blutuntersuchungen und danach monatliche Kontrollen empfohlen. Es wurde gezeigt, dass sich die klinischen Blutwerte nach Dosisreduktion der oben genannten Neuroleptika wieder normalisieren. Gleichzeitig ist zu beachten, dass es bis heute keine klare Strategie für Patienten mit den oben genannten Nebenwirkungen im Zusammenhang mit Stoffwechselstörungen gibt. Meistens wird ein atypisches Antipsychotikum durch ein anderes ersetzt. Ein weiterer vielversprechender Ansatz ist die Einführung einer speziellen Korrekturtherapie, insbesondere die Verwendung von Bromocriptin zur Korrektur der Hyperprolaktinämie. Im Idealfall erfolgt die Betreuung eines Patienten mit derartigen Erkrankungen unter regelmäßiger Einbindung von Internisten, insbesondere Endokrinologen, Kardiologen und anderen Fachärzten.
Zusammenfassend ist festzuhalten, dass die Anwendung von Medikamenten der zweiten Generation sicherer ist als die Anwendung typischer Neuroleptika, wenn die vorgegebenen Algorithmen zur Verschreibung und Überwachung nicht nur des psychischen, sondern auch des physischen Zustands der Patienten befolgt werden.
Eine Reihe weiterer Antipsychotika befindet sich derzeit in der Entwicklungsphase. Medikamente der nächsten Generation werden wahrscheinlich einen anderen Wirkmechanismus aufweisen (z. B. ein GABAerges Profil) und verschiedene Erscheinungsformen der Schizophrenie, einschließlich der eigentlichen Defizitstörungen, beeinflussen können.
Beachtung!
Um die Wahrnehmung von Informationen zu vereinfachen, wird diese Gebrauchsanweisung der Droge "Neuroleptika, oder Antipsychotika " übersetzt und in einer speziellen Form auf der Grundlage der offiziellen Anweisungen für die medizinische Verwendung des Medikaments präsentiert . Vor der Verwendung lesen Sie die Anmerkung, die direkt zu dem Medikament kam.
Beschreibung zu Informationszwecken zur Verfügung gestellt und ist kein Leitfaden zur Selbstheilung. Die Notwendigkeit für dieses Medikament, der Zweck des Behandlungsregimes, Methoden und Dosis des Medikaments wird ausschließlich durch den behandelnden Arzt bestimmt. Selbstmedikation ist gefährlich für Ihre Gesundheit.

