Facharzt des Artikels
Neue Veröffentlichungen
Aortenklappeninsuffizienz
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Bei der Aorteninsuffizienz schließt die Aortenklappe nicht richtig, was zu einem Blutfluss von der Aorta in den linken Ventrikel während der Diastole führt. Ursachen sind idiopathische Klappendegeneration, akutes rheumatisches Fieber, Endokarditis, myxomatöse Degeneration, angeborene bikuspide Aortenklappe, syphilitische Aortitis sowie Bindegewebs- oder rheumatologische Erkrankungen.
Zu den Symptomen zählen Belastungsdyspnoe, Orthopnoe, paroxysmale nächtliche Dyspnoe, Herzklopfen und Brustschmerzen. Die körperliche Untersuchung kann eine diffuse Pulswelle und ein holodiastolisches Herzgeräusch zeigen. Die Diagnose wird durch körperliche Untersuchung und Echokardiographie gestellt. Die Behandlung umfasst einen Aortenklappenersatz und (in manchen Fällen) die Gabe von vasodilatatorischen Medikamenten.
Ursachen Aortenklappeninsuffizienz
Eine Aorteninsuffizienz (AR) kann akut oder chronisch sein. Hauptursachen einer akuten Aorteninsuffizienz sind eine infektiöse Endokarditis und eine Dissektion der aufsteigenden Aorta.
Eine mittelschwere chronische Aorteninsuffizienz bei Erwachsenen wird am häufigsten durch eine bikuspide oder fenestrierte Aortenklappe verursacht (2 % der Männer und 1 % der Frauen), insbesondere wenn eine schwere diastolische Hypertonie (Blutdruck > 110 mmHg) vorliegt.
Eine mittelschwere bis schwere chronische Aorteninsuffizienz bei Erwachsenen wird am häufigsten durch eine idiopathische Degeneration der Aortenklappen oder der Aortenwurzel, rheumatisches Fieber, infektiöse Endokarditis, myxomatöse Degeneration oder ein Trauma verursacht.
Bei Kindern ist die häufigste Ursache ein Ventrikelseptumdefekt mit Aortenklappenprolaps. Gelegentlich wird eine Aorteninsuffizienz durch eine seronegative Spondylarthropathie (ankylosierende Spondylitis, reaktive Arthritis, Psoriasis-Arthritis), rheumatoide Arthritis, systemischen Lupus erythematodes, Arthritis im Zusammenhang mit Colitis ulcerosa, syphilitische Aortitis, Osteogenesis imperfecta, thorakales Aortenaneurysma, Aortendissektion, supravalvuläre Aortenstenose, Takayasu-Arteriitis, Ruptur des Sinus Valsalvae, Akromegalie und temporale (Riesenzell-)Arteriitis verursacht. Eine Aorteninsuffizienz aufgrund einer myxomatösen Degeneration kann sich bei Patienten mit Marfan-Syndrom oder Ehlers-Danlos-Syndrom entwickeln.
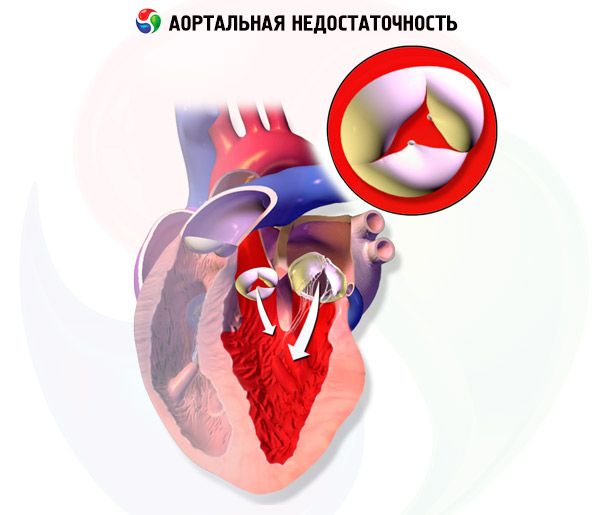
Bei einer chronischen Aorteninsuffizienz nehmen das linksventrikuläre Volumen und das linksventrikuläre Schlagvolumen allmählich zu, da der linke Ventrikel während der Diastole zusätzlich zu Blut aus den Lungenvenen und dem linken Vorhof auch Blut aus der Aorteninsuffizienz erhält. Die linksventrikuläre Hypertrophie kompensiert den Volumenanstieg über mehrere Jahre, kommt aber schließlich zur Dekompensation. Diese Veränderungen können zu Arrhythmien, Herzinsuffizienz (HF) oder kardiogenem Schock führen.
Symptome Aortenklappeninsuffizienz
Eine akute Aorteninsuffizienz verursacht Symptome einer Herzinsuffizienz und eines kardiogenen Schocks. Eine chronische Aorteninsuffizienz verläuft meist jahrelang asymptomatisch; schleichend entwickeln sich progrediente Belastungsdyspnoe, Orthopnoe, paroxysmale nächtliche Dyspnoe und Palpitationen. Die Symptome einer Herzinsuffizienz korrelieren schlecht mit objektiven Messungen der linksventrikulären Funktion. Brustschmerzen (Angina pectoris) treten bei etwa 5 % der Patienten ohne zugrundeliegende koronare Herzkrankheit auf, meist nachts. Anzeichen einer Endokarditis (z. B. Fieber, Anämie, Gewichtsverlust, Embolien an verschiedenen Stellen) können sich entwickeln, da die krankhafte Aortenklappe anfällig für bakterielle Infektionen ist.
Die Symptome variieren je nach Schweregrad der Aorteninsuffizienz. Mit fortschreitender chronischer Erkrankung steigt der systolische Blutdruck bei abnehmendem diastolischen Blutdruck, was zu einem erhöhten Pulsdruck führt. Mit der Zeit kann sich der linksventrikuläre Impuls verstärken, ausweiten, seine Amplitude vergrößern, sich nach unten und zur Seite verschieben, mit einer systolischen Depression der vorderen linken parasternalen Region, was zu einer „schwingenden“ Bewegung der linken Brusthälfte führt.
In späteren Stadien einer Aorteninsuffizienz kann ein systolisches Schwirren über der Herzspitze und den Halsschlagadern tastbar sein. Dies wird durch ein großes Schlagvolumen und einen niedrigen diastolischen Aortendruck verursacht.
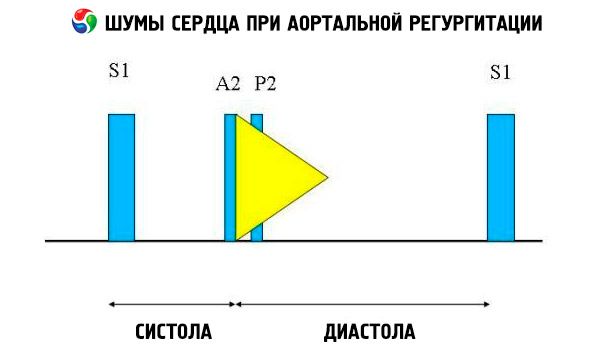
Zu den auskultatorischen Befunden gehören ein normaler Herzton und ein ungeteilter, lauter, spitzer oder knallender zweiter Herzton aufgrund des erhöhten Widerstands der elastischen Aorta. Das Geräusch der Aorteninsuffizienz ist hell, hochfrequent, diastolisch, verblasst und beginnt kurz nach der Aortenkomponente von S1. Es ist im dritten oder vierten Interkostalraum links vom Brustbein am lautesten. Das Geräusch ist am besten mit einem Stethoskop mit Zwerchfell zu hören, wenn sich der Patient nach vorne beugt und beim Ausatmen den Atem anhält. Es verstärkt sich bei Manövern, die die Nachlast erhöhen (z. B. Hocken, isometrischer Handgriff). Bei leichter Aorteninsuffizienz kann das Geräusch nur in der frühen Diastole auftreten. Wenn der diastolische Druck im linken Ventrikel sehr hoch ist, wird das Geräusch kürzer, weil sich Aortendruck und diastolischer Druck im linken Ventrikel in der frühen Diastole angleichen.
Zu den weiteren auffälligen auskultatorischen Befunden zählen ein Auswurfgeräusch und ein Regurgitationsgeräusch, ein Auswurfklick kurz nach S und ein aortisches Auswurfgeräusch. Ein diastolisches Geräusch in der Achselhöhle oder im mittleren linken Hemithorax (Cole-Cecil-Geräusch) entsteht durch die Verschmelzung des Aortengeräusches mit dem dritten Herzton (S3 ), die durch die gleichzeitige Füllung des linken Ventrikels durch den linken Vorhof und die Aorta entsteht. Ein mittel- bis spätdiastolisches Geräusch an der Herzspitze (Austin-Flint-Geräusch) kann durch einen schnellen Regurgitationsfluss in den linken Ventrikel entstehen, der am Höhepunkt des Vorhofflusses eine Vibration des Mitralklappensegels verursacht; dieses Geräusch ähnelt dem diastolischen Geräusch bei einer Mitralstenose.
Andere Symptome sind selten und ihre Sensitivität und Spezifität sind gering (oder unbekannt). Sichtbare Zeichen sind Kopfschütteln (Musset-Zeichen) und Pulsieren der Nagelkapillaren (Quincke-Zeichen, besser tastbar bei leichtem Druck) oder des Zäpfchens (Müller-Zeichen). Die Palpation kann einen angespannten Puls mit schnellem Steigen und Fallen (schlagender, Wasserschlag- oder Kollapspuls) sowie Pulsieren der Halsschlagadern (Corrigen-Zeichen), der Netzhautarterien (Becker-Zeichen), der Leber (Rosenbach-Zeichen) oder der Milz (Gerhard-Zeichen) offenbaren. Zu den Blutdruckänderungen zählen ein erhöhter systolischer Druck in den Beinen (unterhalb des Knies) um > 60 mmHg im Vergleich zum Druck im Arm (Hill-Zeichen) und ein Abfall des diastolischen Drucks um > 15 mmHg beim Anheben des Arms (Maine-Zeichen). Zu den auskultatorischen Symptomen zählen ein raues Herzgeräusch im Bereich des Femoralpulses (Schussgeräusch oder Traube-Zeichen) sowie ein systolischer Femurtonus und ein diastolisches Herzgeräusch proximal der Kompressionsarterie (Duroziez-Geräusch).
Diagnose Aortenklappeninsuffizienz
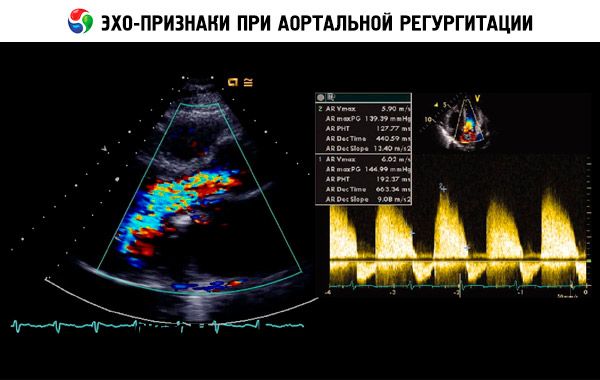
Die Verdachtsdiagnose basiert auf Anamnese und körperlicher Untersuchung und wird durch eine Echokardiographie bestätigt. Die Doppler-Echokardiographie ist das bildgebende Verfahren der Wahl, um das Ausmaß des Regurgitationsflusses zu erfassen und zu quantifizieren. Die zweidimensionale Echokardiographie kann helfen, die Größe der Aortenwurzel sowie die Anatomie und Funktion des linken Ventrikels zu bestimmen. Ein linksventrikuläres endsystolisches Volumen > 60 ml/m² , ein linksventrikulärer endsystolischer Durchmesser > 50 mm und eine LVEF < 50 % weisen auf eine Dekompensation hin. Die Echokardiographie kann auch den Schweregrad der pulmonalen Hypertonie infolge einer Linksherzinsuffizienz beurteilen, Vegetationen oder Perikardergüsse (z. B. bei Aortendissektion) erkennen und die Prognose einschätzen.
Mithilfe einer Radionuklidszintigraphie kann die LVEF bestimmt werden, wenn die echokardiographischen Befunde grenzwertig abnorm sind oder eine Echokardiographie technisch schwierig durchzuführen ist.
Es werden ein EKG und eine Röntgenaufnahme des Brustkorbs durchgeführt. Das EKG kann Repolarisationsstörungen mit oder ohne Veränderungen des QRS-Komplexes zeigen, die für eine LV-Hypertrophie, eine Vergrößerung des linken Vorhofs und eine T-Wellen-Inversion mit ST-Strecken-Senkung in den präkordialen Ableitungen charakteristisch sind. Die Röntgenaufnahme des Brustkorbs kann bei Patienten mit chronisch-progressiver Aorteninsuffizienz eine Kardiomegalie und eine vergrößerte Aortenwurzel zeigen. Bei schwerer Aorteninsuffizienz können Symptome eines Lungenödems und einer Herzinsuffizienz auftreten. Belastungstests helfen, die funktionelle Reserve und die klinischen Manifestationen der Pathologie bei Patienten mit nachgewiesener Aorteninsuffizienz und fraglichen Manifestationen zu beurteilen.
Eine Koronarangiographie ist für die Diagnose normalerweise nicht erforderlich, wird jedoch vor einer Operation durchgeführt, auch wenn keine Angina pectoris vorliegt, da etwa 20 % der Patienten mit schwerer AR eine schwere koronare Herzkrankheit haben, die eine Indikation für eine begleitende chirurgische Behandlung (CABG) sein kann.
Was muss untersucht werden?
Wie zu prüfen?
Wen kann ich kontaktieren?
Behandlung Aortenklappeninsuffizienz
Die Behandlung einer akuten Aorteninsuffizienz besteht in einem Aortenklappenersatz. Die Behandlung einer chronischen Aorteninsuffizienz richtet sich nach den klinischen Manifestationen und dem Grad der linksventrikulären Dysfunktion. Patienten mit Symptomen, die bei normalen Alltagsaktivitäten oder bei Belastungstests auftreten, benötigen einen Aortenklappenersatz. Patienten, die sich einer Operation nicht unterziehen möchten, können Vasodilatatoren erhalten (z. B. langwirksames Nifedipin 30–90 mg einmal täglich oder ACE-Hemmer). Diuretika oder Nitrate können ebenfalls verabreicht werden, um die Vorlast bei schwerer Aorteninsuffizienz zu senken. Asymptomatische Patienten mit einer LVEF < 55 %, einem endsystolischen Durchmesser > 55 mm (55er-Regel) oder einem enddiastolischen Durchmesser > 75 mm benötigen ebenfalls eine Operation; Medikamente sind für diese Patientengruppe die zweite Wahl. Zu den weiteren chirurgischen Kriterien gehören eine EF < 25–29 %, ein Verhältnis von enddiastolischem Radius zu Myokardwanddicke > 4,0 und ein Herzindex < 2,2–2,5 l/min pro m².
Patienten, die diese Kriterien nicht erfüllen, sollten sich alle 6 bis 12 Monate einer gründlichen körperlichen Untersuchung, einer Echokardiographie und möglicherweise einer Belastungs- und Ruhe-Radionuklidangiographie unterziehen, um die LV-Kontraktilität zu bestimmen.
Vor Eingriffen, die zu einer Bakteriämie führen können, ist eine Endokarditisprophylaxe mit Antibiotika angezeigt.
Prognose
Unter Behandlung liegt die 10-Jahres-Überlebensrate bei Patienten mit leichter bis mittelschwerer Aorteninsuffizienz bei 80–95 %. Bei rechtzeitigem Klappenersatz (vor Auftreten einer Herzinsuffizienz und unter Berücksichtigung der unten beschriebenen Kriterien) ist die Langzeitprognose bei Patienten mit mittelschwerer bis schwerer Aorteninsuffizienz gut. Bei schwerer Aorteninsuffizienz und Herzinsuffizienz ist die Prognose jedoch deutlich schlechter.
 [ 16 ]
[ 16 ]

