Facharzt des Artikels
Neue Veröffentlichungen
Transmuraler Myokardinfarkt
Zuletzt überprüft: 29.06.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
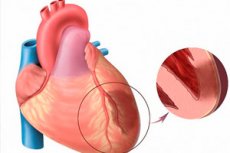
Wenn wir von akutem Myokardinfarkt sprechen, meinen wir eine der bedrohlichsten Formen der Herzischämie. Es handelt sich um eine ischämische Nekrose eines bestimmten Myokardbereichs, die aufgrund eines Ungleichgewichts zwischen dem Sauerstoffbedarf des Herzmuskels und dem tatsächlichen Sauerstofftransport durch die Blutgefäße auftritt. Der transmurale Myokardinfarkt wiederum gilt als besonders schwere Erkrankung, wenn nekrotische Herde die gesamte Dicke der Ventrikelwand schädigen, vom Endokard bis zum Epikard. Die Pathologie ist immer akut und großherdig und gipfelt in der Entwicklung einer postinfarktbedingten Kardiosklerose. Die Symptomatologie ist im Vergleich zum Bild eines typischen Infarkts hell ausgeprägt (Ausnahme: Infarkt der hinteren Herzwand, der oft verdeckt verläuft). Die Prognose hängt direkt von der Rechtzeitigkeit der medizinischen Notfallversorgung ab. [ 1 ]
Epidemiologie
Herz-Kreislauf-Erkrankungen gelten in vielen wirtschaftlich entwickelten Regionen der Welt als häufigste Todesursache. So sterben beispielsweise in europäischen Ländern jährlich mehr als vier Millionen Menschen an Herzerkrankungen. Mehr als die Hälfte der Todesfälle steht in direktem Zusammenhang mit Risikofaktoren wie Bluthochdruck, Übergewicht, Rauchen und Bewegungsmangel.
Der Herzinfarkt als komplizierte Variante der koronaren Herzkrankheit ist derzeit die häufigste Ursache für Behinderungen bei Erwachsenen mit einer Sterblichkeitsrate von 11 %.
Ein transmuraler Infarkt betrifft häufiger Männer im Alter von 40 bis 60 Jahren. Frauen erleiden diese Art von Infarkt 1,5 bis 2 Mal seltener.
In den letzten Jahren hat die Häufigkeit transmuraler Pathologien bei jungen Patienten im Alter von 20 bis 35 Jahren zugenommen.
Der transmurale Myokardinfarkt zählt zu den schwersten und lebensbedrohlichsten Erkrankungen. Die Krankenhaussterblichkeit liegt oft bei 10–20 %. Der häufigste ungünstige Verlauf wird bei Patienten mit gleichzeitigem Diabetes mellitus, Bluthochdruck sowie bei wiederkehrenden Infarkten beobachtet.
Ursachen transmuraler Myokardinfarkt
Bei der überwiegenden Mehrheit der Patienten ist die Entwicklung eines transmuralen Infarkts mit einem Verschluss des Hauptstamms oder Astes des Koronargefäßes verbunden. Bei dieser Erkrankung kommt es zu einer Unterversorgung des Myokards mit Blut, die Hypoxie nimmt zu, was sich mit zunehmender Belastung des Herzmuskels verschlimmert. Die Myokardfunktionalität nimmt ab, das Gewebe in einem bestimmten Bereich erleidet eine Nekrose.
Eine direkte Verengung des Koronarlumens kann beispielsweise folgende Ursachen haben:
- Chronische Gefäßerkrankungen – Arteriosklerose, begleitet von der Ablagerung von Cholesterinelementen (Plaques) an den Gefäßwänden – sind der häufigste Faktor für Herzinfarkte. Sie treten in 95 % der Fälle mit tödlichem Ausgang bei transmuralen Infarkten auf. Ein häufiges Anzeichen für Arteriosklerose ist ein Anstieg der Blutfettwerte. Das Risiko von Infarktkomplikationen steigt dramatisch an, wenn das Gefäßlumen zu 75 % oder mehr blockiert ist.
- Die Bildung und Bewegung von Blutgerinnseln in Blutgefäßen – eine Gefäßthrombose – ist eine seltenere, aber dennoch mögliche Ursache für eine Blockade des Blutflusses im Koronarkreislauf. Thromben können aus der linken Herzkammer (wo sie aufgrund von Vorhofflimmern und Herzklappenerkrankungen entstehen) oder durch ein offenes Foramen ovale in das Koronarnetz gelangen.
Zu den besonderen Risikogruppen zählen Menschen mit einer erhöhten erblichen Veranlagung (Herz- und Gefäßerkrankungen in der Familie), starke Raucher und Menschen über 50–55 Jahre. S[ 2 ]
Negative Beiträge zur Entstehung von Arteriosklerose sind:
- Falsche Ernährung;
- Stoffwechselstörungen, Fettleibigkeit;
- Unzureichende körperliche Aktivität, körperliche Inaktivität;
- Diagnostizierte arterielle Hypertonie;
- Diabetes jeglicher Art;
- Systemische Pathologien (hauptsächlich Vaskulitis).
Risikofaktoren
Das Herz reagiert immer akut auf Kreislaufversagen und Hypoxie. Wenn das Lumen eines Koronargefäßes blockiert ist und kein alternativer Blutfluss möglich ist, beginnen Herzmyozyten – Myokardzellen – im betroffenen Bereich innerhalb einer halben Stunde abzusterben.
Eine gestörte Durchblutung infolge atherosklerotischer Prozesse des Koronarnetzwerks ist in 98 % der Fälle die „Ursache“ eines transmuralen Myokardinfarkts.
Arteriosklerose kann eine oder mehrere Koronararterien betreffen. Die Verengung des betroffenen Gefäßes ist unterschiedlich – je nach Grad der Blutflussbehinderung und Länge des verengten Abschnitts. Steigt der Blutdruck, wird die Endothelschicht geschädigt, die atherosklerotische Plaque sättigt sich mit Blut, das anschließend gerinnt und einen Thrombus bildet, was die Situation mit einem freien Gefäßlumen verschlimmert.
Die Wahrscheinlichkeit der Bildung eines Blutgerinnsels ist höher:
- Im Bereich der atherosklerotischen Plaque-Läsion;
- Im Bereich der Endothelschädigung;
- An der Stelle der Verengung des arteriellen Gefäßes.
Eine zunehmende Myokardnekrose kann unterschiedliche Ausmaße annehmen, und eine transmurale Nekrose führt häufig zu einem Riss der Muskelschicht. Faktoren wie Anämie, infektiös-entzündliche Prozesse, Fieber, endokrine und metabolische Erkrankungen (einschließlich Schilddrüsenerkrankungen) verschlimmern die Myokardischämie. [ 3 ]
Als wichtigste Risikofaktoren für die Entstehung eines transmuralen Myokardinfarkts gelten:
- Ungleichgewicht der Blutfettwerte;
- Langjähriges oder starkes Rauchen;
- Diabetes;
- Erhöhter Blutdruck;
- Jeglicher Grad von Fettleibigkeit;
- Psychosoziale Aspekte (häufiger Stress, Depressionen usw.);
- Hypodynamie, Bewegungsmangel;
- Falsche Ernährung (Verzehr großer Mengen tierischer Fette und Transfette vor dem Hintergrund eines geringen Verzehrs pflanzlicher Lebensmittel);
- Alkoholmissbrauch.
Als „kleine“, relativ seltene Risikofaktoren gelten:
- Gicht;
- Folsäuremangel;
- Schuppenflechte.
Der Verlauf eines Herzinfarkts wird durch folgende Faktoren erheblich verschlechtert:
- Männlich zu sein;
- Thrombolyse;
- Akute koronare Herzkrankheit;
- Rauchen;
- Erbliche Verschlimmerung der koronaren Herzkrankheit;
- Linksherzinsuffizienz;
- Kardiogener Schock;
- Ventrikuläre Rhythmusstörungen;
- Atrioventrikulärer Block;
- Ein zweiter Herzinfarkt;
- Alter.
Pathogenese
Der Prozess der Infarktentwicklung verläuft mit der Bildung dauerhafter Veränderungen im Myokard und dem Tod von Myozyten.
Eine typische Manifestation eines Myokardinfarkts ist der elektrokardiographische Nachweis abnormaler Q-Schläge, deren Dauer und Amplitude die Norm überschreiten, sowie eine leichte Zunahme der Amplitude der R-Schläge in den Thoraxableitungen. Das Verhältnis der Q- und R-Zahnamplituden bestimmt die Tiefe des Debridements. Das heißt, je tiefer Q und je niedriger R, desto ausgeprägter der Grad der Nekrose. Die transmurale Nekrose geht mit dem Verschwinden der R-Kerben und der Fixierung des QS-Komplexes einher.
Vor der Entwicklung einer Koronarthrombose ist die Endothelschicht der atherosklerotischen Plaque betroffen, was mit einem Anstieg thrombogener Blutfaktoren (Thromboxan A2 usw.) einhergeht. Dies wird durch hämodynamische Störungen, abrupte Veränderungen des Gefäßtonus und Schwankungen der Katecholaminindizes vorangetrieben.
Eine Schädigung der atherosklerotischen Plaque mit ihrer zentralen Nekrose und extramuralen Thrombose sowie einer kleinen Stenose führt häufig entweder zur Entwicklung eines transmuralen Infarkts oder eines plötzlichen Koronartodsyndroms. Frische atherosklerotische Massen, die große Mengen atherogener Lipoproteine enthalten, sind besonders anfällig für Rupturen.
Der Beginn einer Myokardschädigung tritt am häufigsten in den frühen Morgenstunden auf, was durch zirkadiane Veränderungen des Koronargefäßtonus und Veränderungen des Katecholaminspiegels erklärt wird.
Die Entwicklung eines transmuralen Infarkts in jungen Jahren kann auf angeborene Defekte der Herzkranzgefäße, Embolien aufgrund einer infektiösen Endokarditis, Herzmyxome, Aortenstenose, Erythrämie usw. zurückzuführen sein. In diesen Fällen besteht ein akutes Ungleichgewicht zwischen dem Sauerstoffbedarf des Herzmuskels und seiner Versorgung durch das Kreislaufsystem. Die transmurale Nekrose wird durch Hyperkatecholämie verschlimmert.
Offensichtlich liegt die Ursache eines akuten transmuralen Myokardinfarkts in den meisten Fällen in einer stenotischen Arteriosklerose der Koronargefäße, einer Thrombose oder einem anhaltenden okklusiven Krampf.
Symptome transmuraler Myokardinfarkt
Das Krankheitsbild beim transmuralen Infarkt durchläuft mehrere Stadien, die sich symptomatisch voneinander unterscheiden.
Das erste Stadium ist die Prodromalphase oder Präinfarktphase, die etwa eine Woche dauert und mit Stress oder körperlicher Überlastung einhergeht. Die Symptomatik dieser Phase ist durch das Auftreten oder die Verschlimmerung von Angina-Pectoris-Anfällen gekennzeichnet, die häufiger und schwerer werden: Es entwickelt sich eine instabile Angina pectoris. Auch das allgemeine Wohlbefinden verändert sich. Die Patienten leiden unter unmotivierter Schwäche, Müdigkeit, Stimmungsverlust, Angstzuständen und Schlafstörungen. Schmerzmittel, die früher zur Schmerzlinderung beitrugen, zeigen nun keine Wirksamkeit mehr.
Wenn dann keine Hilfe geleistet wird, tritt das nächste – akute – Stadium der Pathologie ein. Seine Dauer wird vom Zeitpunkt der Ischämie des Herzmuskels bis zu den ersten Anzeichen seiner Nekrose gemessen (übliche Dauer – von einer halben Stunde bis zu einigen Stunden). Dieses Stadium beginnt mit einem plötzlichen Herzschmerz, der in die obere Extremität, den Nacken, die Schulter oder den Unterarm, den Kiefer und das Schulterblatt ausstrahlt. Der Schmerz kann entweder kontinuierlich (anhaltend) oder wellenförmig sein. Es gibt Anzeichen einer Stimulation des autonomen Nervensystems:
- Plötzliche Schwäche, Kurzatmigkeit;
- Ein akutes Gefühl der Todesangst;
- "durchnässter" Schweiß;
- Atembeschwerden, selbst im Ruhezustand;
- Übelkeit (möglicherweise bis zum Erbrechen).
Es entwickelt sich eine Linksherzinsuffizienz, die durch Dyspnoe und verminderten Pulsdruck gekennzeichnet ist, gefolgt von Herzasthma oder Lungenödem. Ein kardiogener Schock ist eine mögliche Komplikation. Bei der überwiegenden Mehrheit der Patienten treten Arrhythmien auf.
Erste Anzeichen
Die ersten „Glocken“ eines transmuralen Infarkts treten meist einige Stunden oder sogar Tage vor der Entwicklung eines Anfalls auf. Menschen, die auf ihre Gesundheit achten, können ihnen durchaus Beachtung schenken und rechtzeitig ärztliche Hilfe in Anspruch nehmen.
Die wahrscheinlichsten Anzeichen einer drohenden Pathologie:
- Auftreten von Brustschmerzen zeitweise oder unmittelbar nach körperlicher Aktivität, starken emotionalen Zuständen und Erlebnissen;
- häufigeres Auftreten von Angina-Anfällen (sofern diese vorher schon einmal aufgetreten sind);
- Ein Gefühl von Herzinstabilität, starkem Herzschlag und Schwindel;
- Fehlende Wirkung von Nitroglycerin (Brustschmerzen werden nicht kontrolliert, obwohl das Medikament zuvor geholfen hat).
Es ist wichtig, den Ernst der Lage zu verstehen: Von allen registrierten transmuralen Infarkten verlaufen mindestens 20 % innerhalb der ersten 60 Minuten tödlich. Und die Schuld der Ärzte liegt hier in der Regel nicht. Der Tod entsteht durch Verzögerungen seitens des Patienten oder seiner Angehörigen, die es nicht eilig haben, einen Arzt zu kontaktieren und nicht rechtzeitig den Notarzt rufen. Es sollte daran erinnert werden, dass, wenn es in der Familie eine Person mit erhöhtem Herzinfarktrisiko gibt, alle nahestehenden Personen den Algorithmus ihres Handelns zum Zeitpunkt der Entstehung eines Herzinfarkts genau kennen sollten.
Ein transmuraler Myokardinfarkt kann durch ein ziemlich starkes und anhaltendes Schmerzsyndrom vermutet werden. Schmerzhafte Manifestationen - Quetschen, Picken - sind in der Brust zu spüren und können in die obere Extremität (häufiger die linke), den Schulter- oder Nackenbereich, die Körperseite oder das Schulterblatt "zurückstoßen". Weitere Anzeichen, auf die geachtet werden sollte:
- Das Gefühl, nicht genug Luft zum Atmen zu haben;
- Ein Gefühl der Angst, eine Vorahnung seines eigenen Todes;
- Erhöhtes Schwitzen;
- Blässe der Haut.
Eines der Unterscheidungsmerkmale eines Herzinfarkts von einem gewöhnlichen Angina-Anfall: Das Schmerzsyndrom verschwindet in Ruhe nicht von selbst, verschwindet nicht nach der Resorption von Nitroglycerin und dauert länger als 15–20 Minuten. [ 4 ]
Bühnen
Der Verlauf eines Herzinfarkts verläuft nach morphologischen Merkmalen in drei Stadien (sie werden in der Diagnosezeile selten angegeben, da es angemessener ist, die Dauer der Pathologie in Tagen anzugeben):
- Das Ischämiestadium (etwas früher wurde es als akutes fokales ischämisches Myokarddystrophiestadium bezeichnet) dauert bis zu 6–12 Stunden.
- Nekrosestadium – dauert bis zu 1–2 Wochen.
- Organisationsphase – dauert bis zu 4 Wochen oder länger.
Formen
Abhängig von der Lokalisation des pathologischen Fokus werden folgende Arten von transmuralen Infarkten unterschieden:
- Läsion der Vorderwand (anteriorer, anterosuperiorer, anterolateraler, anteroseptaler transmuraler Infarkt;
- Läsion der hinteren (unteren) Wand (inferiorer, inferolateraler, inferiorer posteriorer, Zwerchfellinfarkt);
- Apikal-laterale, obere-laterale, basal-laterale Läsionen;
- Posteriore, laterale, posterior-basale, posterolaterale, posterior-septale Läsionen;
- Massiver Rechtsherzinfarkt.
Je nach Ausbreitung des pathologischen nekrotischen Prozesses gibt es neben transmuralen Infarktherden noch weitere Typen:
- Intramural;
- Subepikardial;
- Subendokardial.
Bei den meisten Patienten werden transmurale und subendokardiale Läsionen diagnostiziert.
Je nach Ausmaß des Schadens unterscheidet man:
- Mikronekrose (auch fokale Nekrose genannt);
- Oberflächliche Nekrose;
- Großflächige fokale Nekrose (wiederum unterteilt in kleine, mittlere und ausgedehnte Variante).
Ein transmuraler Infarkt der vorderen Myokardwand ist häufiger mit einem Verschluss des Hauptstamms der linken Koronararterie oder ihres Astes - der vorderen absteigenden Arterie - verbunden. Die Pathologie wird oft von ventrikulärer Extrasystole oder Tachykardie, supraventrikulärer Arrhythmie begleitet. Leitungsstörungen sind in der Regel stabil, da sie mit einer Nekrose der Strukturen des Leitungssystems verbunden sind.
Ein transmuraler Infarkt der unteren Myokardwand betrifft die an das Zwerchfell angrenzenden Bereiche – den Zwerchfellabschnitt der hinteren Wand. Manchmal wird ein solcher Infarkt als posteriorer Zwerchfellinfarkt, Zwerchfellinfarkt oder inferior bezeichnet. Eine solche Läsion verläuft häufig abdominal, sodass das Problem oft mit Erkrankungen wie akuter Blinddarmentzündung oder Pankreatitis verwechselt wird.
Ein akuter transmuraler Myokardinfarkt des linken Ventrikels tritt bei den meisten transmuralen Läsionen auf. Der Nekroseherd kann in der Vorder-, Hinter- oder Unterwand, der Herzspitze oder dem interventrikulären Septum lokalisiert sein oder mehrere Zonen gleichzeitig betreffen. Der rechte Ventrikel ist relativ selten betroffen, die Vorhöfe noch seltener.
Der transmurale anterolaterale Myokardinfarkt ist eine Form der Schädigung des linken Ventrikels. Im Elektrokardiogramm sind dabei ein erhöhter Q-Zahn in den Ableitungen I, aVL, V4-6 sowie eine Verschiebung des ST-Segments nach oben von der Isolation und ein negativer koronarer T-Zahn erkennbar. Die Vorderseite der Seitenwand des linken Ventrikels ist durch einen Verschluss der diagonalen Arterien oder Äste der linken Zirkumflexarterie beeinträchtigt.
Ein transmuraler inferolateraler Myokardinfarkt ist eine Folge der Okklusion der vorderen absteigenden Arterie oder des umhüllenden Arterienstamms.
Ein transmuraler Myokardinfarkt der Seitenwand ist die Folge einer Okklusion der diagonalen Arterie oder des posterolateralen Astes der linken Zirkumflexarterie.
Der transmurale anteriore Septuminfarkt ist durch die Lage des nekrotischen Fokus im rechten Teil der Vorderwand des linken Ventrikels und im vorderen Teil des interventrikulären Septums gekennzeichnet, das gleichzeitig die rechte Wand des linken Ventrikels darstellt. Infolge der Läsion wandern die Erregungsvektoren nach hinten und links, sodass charakteristische elektrokardiographische Veränderungen nur in den rechten Thoraxableitungen beobachtet werden.
Der großflächige transmurale Myokardinfarkt, auch als ausgedehnter Myokardinfarkt oder MI mit pathologischem QS bekannt, ist die gefährlichste Form der Pathologie und hat sehr schwerwiegende und lebensbedrohliche Folgen für den Patienten. Ein ausgedehnter transmuraler Myokardinfarkt lässt den Patienten praktisch keine Chance.
Komplikationen und Konsequenzen
Komplikationen bei transmuralen Infarkten sind leider keine Seltenheit. Ihre Entwicklung kann die Prognose der Erkrankung dramatisch verändern. Zu den häufigsten Nebenwirkungen zählen kardiogener Schock, schwere Rhythmusstörungen und akutes Herzversagen.
Die überwiegende Mehrheit der verzögerten Ergebnisse ist auf die Bildung einer Bindegewebszone im Bereich des abgestorbenen Herzgewebes zurückzuführen. Die Prognose kann durch eine Herzoperation relativ verbessert werden: Die Operation kann aus einem aortokoronaren Bypass, einer perkutanen Koronarangiographie usw. bestehen.
Der Bindegewebsersatz des betroffenen Bereichs verhindert die vollständige Myokardkontraktion. Es treten Reizleitungsstörungen auf, das Herzzeitvolumen verändert sich. Es entsteht eine Herzinsuffizienz, die Organe leiden unter schwerer Hypoxie.
Es braucht Zeit und intensive Rehabilitationsmaßnahmen, damit sich das Herz optimal an die neuen Arbeitsbedingungen anpassen kann. Die Behandlung sollte kontinuierlich erfolgen, die körperliche Aktivität sollte unter sorgfältiger Aufsicht eines Facharztes schrittweise gesteigert werden.
Zu den häufigsten Spätkomplikationen zählen:
- Herzaneurysma (strukturelle Veränderung und Aussackung der Herzwand, die zu einer verminderten Blutauswurfleistung und zunehmender Herzschwäche führt);
- Thromboembolie (kann aufgrund körperlicher Inaktivität oder Nichtbefolgens ärztlicher Ratschläge auftreten);
- Chronisches Versagen der Herzfunktion (tritt als Folge einer beeinträchtigten kontraktilen Aktivität des linken Ventrikels auf, die sich durch Beinödeme, Dyspnoe usw. äußert).
Das Risiko von Komplikationen nach einem transmuralen Infarkt besteht lebenslang. Besonders häufig kommt es zu einem Rückfall. Die einzige Möglichkeit, dies zu vermeiden, besteht darin, regelmäßig einen Kardiologen aufzusuchen und seine Empfehlungen genau zu befolgen.
Der transmurale Myokardinfarkt ist eine sehr schwere Erkrankung, die dem Patienten bei Komplikationen kaum eine Chance lässt. Zu den häufigsten Folgen gehören:
- Verstöße gegen rhythmische Herzaktivität (Vorhofflimmern, extrasystolische Arrhythmien, paroxysmale Tachykardie). Oft stirbt der Patient, wenn Kammerflimmern mit weiterer Umwandlung in Flimmern auftritt.
- Zunehmende Herzinsuffizienz mit linksventrikulärer Dysfunktion und in der Folge Lungenödem, kardiogener Schock, starker Blutdruckabfall, blockierte Nierenfiltration und – letaler Ausgang.
- Pulmonal-arterielle Thromboembolie, die zu Lungenentzündung, Lungeninfarkt und – Tod führt.
- Herzbeuteltamponade aufgrund einer Myokardruptur und eines Bluteinbruchs in die Perikardhöhle. In den meisten Fällen führt dies zum Tod des Patienten.
- Akutes Koronaraneurysma (vorgewölbte Narbenregion) mit anschließend zunehmender Herzinsuffizienz.
- Thromboendokarditis (Fibrinablagerung in der Herzhöhle mit anschließender Ablösung und Schlaganfall, Mesenterialthrombose usw.).
- Postinfarktsyndrom, das die Entwicklung von Perikarditis, Arthritis, Pleuritis usw. umfasst.
Wie die Praxis zeigt, verstirbt der größte Teil der Patienten mit transmuralem Myokardinfarkt im frühen (weniger als zwei Monate) Postinfarktstadium. Das Vorliegen einer akuten Linksherzinsuffizienz verschlechtert die Prognose erheblich. [ 5 ]
Diagnose transmuraler Myokardinfarkt
Diagnostische Maßnahmen sollten so schnell wie möglich durchgeführt werden. Gleichzeitig sollte die Vollständigkeit der Diagnose nicht vernachlässigt werden, da viele Krankheiten, nicht nur Herzerkrankungen, von einem ähnlichen Krankheitsbild begleitet sein können.
Das primäre Verfahren ist die Elektrokardiographie, die einen Koronarverschluss anzeigt. Es ist wichtig, auf die Symptomatik zu achten – insbesondere auf ein ausgeprägtes Brustschmerzsyndrom, das 20 Minuten oder länger anhält und nicht auf die Gabe von Nitroglycerin anspricht.
Weitere Dinge, auf die Sie achten sollten:
- Pathologische Anzeichen vor dem Anfall;
- „Rückstoß“ von Schmerzen im Nacken, Kiefer, oberen Extremitäten.
Schmerzempfindungen bei transmuralen Infarkten sind häufiger intensiv, gleichzeitig können Atembeschwerden, Bewusstseinsstörungen und Synkopen auftreten. Transmurale Läsionen weisen keine spezifischen Symptome auf. Unregelmäßigkeiten der Herzfrequenz, Bradykardie oder Tachykardie sowie feuchte Heiserkeit sind möglich.
Die instrumentelle Diagnostik sollte zunächst durch die Elektrokardiographie erfolgen: Dies ist die wichtigste Untersuchungsmethode, die einen tiefen und erweiterten Q-Zahn, eine reduzierte R-Amplitude und eine ST-Strecken-Hebung über der Isolinie aufdeckt. Nach einiger Zeit wird die Bildung eines negativen T-Zahns und eine ST-Strecken-Abnahme festgestellt.
Als zusätzliche Methode kann die Koronarographie eingesetzt werden. Diese besonders genaue Methode ermöglicht nicht nur die Erkennung eines Verschlusses der Koronargefäße durch einen Thrombus oder eine atherosklerotische Plaque, sondern auch die Beurteilung der Funktionsfähigkeit der Ventrikel sowie die Erkennung von Aneurysmen und Dissektionen.
Laboruntersuchungen sind ebenfalls obligatorisch. Zunächst wird die MB-Fraktion der CPK (Kreatinphosphokinase-MB) bestimmt – die myokardiale Fraktion der Gesamtkreatinphosphokinase (spezifischer Indikator für die Entwicklung eines Herzinfarkts). Zusätzlich werden kardiale Troponine (quantitative Untersuchung) sowie der Myoglobinspiegel bestimmt.
Bis heute wurden weitere neue Indikatoren entwickelt, die jedoch noch keine breite Anwendung finden. Dabei handelt es sich um Fettsäure-bindendes Protein, Myosin-Leichtketten und Glykogenphosphorylase BB.
Präklinisch werden immunchromatographische Schnelltests aktiv eingesetzt, um die Biomarker Troponin, Myoglobin und Kreatinkinase-MB schnell zu bestimmen. Das Ergebnis eines Schnelltests liegt bereits nach zehn Minuten vor. [ 6 ]
Akuter transmuraler Myokardinfarkt-EKG
Das klassische elektrokardiographische Bild bei einem Infarkt wird durch das Auftreten pathologischer Q-Zähne dargestellt, deren Dauer und Amplitude über den Normalwerten liegen. Darüber hinaus ist die Amplitude der R-Schläge in den Thoraxableitungen leicht erhöht.
Pathologische Q-Zähne, die durch Herzmuskelnekrose hervorgerufen werden, werden 2–24 Stunden nach Beginn der klinischen Manifestationen sichtbar. Ungefähr 6–12 Stunden nach Beginn lässt die ST-Strecken-Hebung nach, und die Q-Zähne werden im Gegenteil intensiver.
Die Bildung pathologischer Q-Kerben erklärt sich durch den Verlust der elektrischen Erregbarkeit abgestorbener Strukturen. Die postnekrotische Ausdünnung der linken Ventrikelvorderwand reduziert auch deren Potenzial, wodurch die Depolarisationsvektoren des rechten Ventrikels und der linken Ventrikelhinterwand begünstigt werden. Dies führt zu einer initialen negativen Abweichung des Ventrikelkomplexes und zur Bildung pathologischer Q-Kerben.
Ein verringertes Depolarisationspotenzial abgestorbenen Herzgewebes trägt ebenfalls zu einer Verringerung der R-Schläge bei. Ausmaß und Ausbreitung des Infarkts werden anhand der Anzahl der Ableitungen mit abnormalen Q-Zähnen und verringerter R-Zahnamplitude beurteilt.
Die Tiefe der Nekrose wird anhand des Verhältnisses der Amplituden der Q- und R-Schläge beurteilt. Tieferes Q und niedrigeres R weisen auf einen ausgeprägten Nekrosegrad hin. Da der transmurale Myokardinfarkt die gesamte Herzwand direkt betrifft, verschwinden die R-Zähne. Es wird lediglich eine negative Form der Plaque, der sogenannte QS-Komplex, aufgezeichnet. [ 7 ]
Elektrokardiographische Anzeichen eines transmuralen Myokardinfarkts |
Das Elektrokardiogramm (üblicherweise in den Thoraxableitungen) zeigt abnorme Q-Notches und QS-Komplexe. Dieselben Veränderungen können bei Endokarditis mit Myokardbeteiligung, eitriger und aseptischer Myokarditis, Kardiomyopathie, progressiver Muskeldystrophie usw. vorliegen. Eine qualitative Differenzialdiagnose ist wichtig. |
Differenzialdiagnose
Der transmurale Myokardinfarkt wird häufig von anderen Ursachen des Schmerzsyndroms hinter dem Brustbein unterschieden. Dies kann ein dissezierendes thorakales Aortenaneurysma, eine Lungenembolie, eine akute Perikarditis (hauptsächlich viraler Ätiologie) oder ein intensives radikuläres Syndrom sein. Bei der Diagnose achtet der Spezialist unbedingt auf das Vorhandensein von Risikofaktoren für Arteriosklerose, die Besonderheiten des Schmerzsyndroms und dessen Dauer, die Reaktion des Körpers des Patienten auf die Verwendung von Analgetika und Vasodilatatoren sowie Blutdruckwerte. Die Ergebnisse der objektiven Untersuchung, des Elektrokardiogramms, des Echokardiogramms und der Labortests werden ausgewertet. [ 8 ]
- Das dissezierende Aortenaneurysma ist durch das Auftreten von Schmerzen gekennzeichnet, die häufiger zwischen den Schulterblättern auftreten. Die Schmerzen zeigen eine Resistenz gegen Nitrate, und es liegt eine Vorgeschichte von arterieller Hypertonie vor. Es gibt keine offensichtlichen elektrokardiographischen Veränderungen, die kardialen Marker sind normal. Es besteht eine ausgeprägte Leukozytose und eine Linksverschiebung des linken Ventrikels. Zur Abklärung der Diagnose werden zusätzlich Echokardiographie, Aortographie mit Kontrastmittel und Computertomographie verordnet.
- Bei einer Perikarditis ist eine sorgfältige Abklärung früherer infektiöser Atemwegserkrankungen erforderlich. Achten Sie auf veränderte Schmerzen beim Ein- und Ausatmen oder in verschiedenen Körperpositionen, auf Perikardreibungsgeräusche und nichtdynamische Herzparameter.
- Das Wiederauftreten von Osteochondrose und Plexitis geht mit Schmerzen seitlich am Brustbein einher. Die Schmerzen hängen von der Körperhaltung und den Atembewegungen des Patienten ab. Palpatorisch lässt sich der Punkt extremer Schmerzempfindung im Bereich der Nervenentladung erkennen.
- Eine Lungenembolie ist durch stärkere Schmerzen gekennzeichnet als ein transmuraler Infarkt. Häufig treten paroxysmale Atemnot, Kollaps und Rötung des Oberkörpers auf. Das elektrokardiographische Bild weist Ähnlichkeiten mit dem Infarkt des Myokards im unteren Bereich auf, zeigt jedoch Manifestationen einer akuten Überlastung der Herzkompartimente auf der rechten Seite. In der Echokardiographie wird eine starke pulmonale Hypertonie festgestellt.
- Das Bild des akuten Abdomens wird von Zeichen einer Peritonealreizung begleitet. Die Leukozytose ist stark ausgeprägt.
Der transmurale Myokardinfarkt wird auch von einer akuten Pankreatitis und einer hypertensiven Krise unterschieden.
Wen kann ich kontaktieren?
Behandlung transmuraler Myokardinfarkt
Therapeutische Interventionen sollten folgende aufeinander folgende Ziele verfolgen:
- Schmerzlinderung;
- Wiederherstellung der Blutversorgung des Herzmuskels;
- Verringerung der Belastung des Myokards und Senkung seines Sauerstoffbedarfs;
- Begrenzung der Größe des transmuralen Fokus;
- Verhinderung der Entstehung von Komplikationen.
Schmerzlinderung verbessert das Wohlbefinden des Patienten und normalisiert das Nervensystem. Übermäßige Nervenaktivität, hervorgerufen durch starke Schmerzen, führt zu erhöhter Herzfrequenz, erhöhtem Blutdruck und Gefäßwiderstand, was die Myokardbelastung weiter erhöht und den Sauerstoffbedarf des Herzmuskels erhöht.
Medikamente, die zur Beseitigung des Schmerzsyndroms verwendet werden, sind narkotische Analgetika. Sie werden intravenös verabreicht.
Um eine ausreichende Blutversorgung des Myokards wiederherzustellen, werden eine Koronarographie, eine Thrombolysetherapie (Thrombolysetherapie) und eine aortokoronare Bypass-Operation durchgeführt.
Die Koronarographie wird mit einer Stent- oder Ballonangioplastie kombiniert, um die Durchgängigkeit der Arterie mit einem Stent oder Ballon wiederherzustellen und den Blutfluss zu normalisieren.
Eine Thrombolysetherapie hilft ebenfalls, den venösen (koronaren) Blutfluss wiederherzustellen. Dabei werden geeignete Thrombolytika intravenös verabreicht.
Der aortokoronare Bypass ist eine der chirurgischen Optionen zur Wiederherstellung und Optimierung der koronaren Blutversorgung. Bei der Bypass-Operation schafft der Chirurg einen Gefäßweg, der den Blutfluss zu den betroffenen Myokardbereichen ermöglicht. Diese Operation kann je nach Situation als Notfall- oder Wahleingriff durchgeführt werden.
Um die Herzbelastung zu reduzieren und die Hypoxie zu minimieren, werden folgende Arzneimittelgruppen verschrieben:
- Organische Nitrate - tragen zur Schmerzlinderung bei, begrenzen die Ausbreitung nekrotischer Herde, verringern die Sterblichkeit durch transmuralen Infarkt, stabilisieren den Blutdruck (zunächst intravenös verabreicht, nach einiger Zeit auf die Tablettenform des Arzneimittels umgestellt);
- β-Adrenoblocker - verstärken die Wirkung von Nitraten, verhindern die Entwicklung von Arrhythmien und erhöhtem Blutdruck, verringern die Schwere der Myokardhypoxie und verringern das Risiko körperlicher Komplikationen (insbesondere einer Ventrikelruptur).
Treten beim Patienten Komplikationen wie Lungenödem, kardiogener Schock oder Reizleitungsstörungen auf, wird das Therapieschema individuell angepasst. Die körperliche und seelische Ruhe muss gewährleistet sein.
Jede Phase der Therapie von Patienten mit transmuralem Infarkt wird nach bestimmten Schemata und Protokollen durchgeführt. Als zusätzliche Medikamente können verschrieben werden:
- Thrombozytenaggregationshemmer: Sie reduzieren die Thrombozytenaggregation und hemmen die Bildung von Blutgerinnseln. Bei transmuralen Infarkten wird den Patienten meist eine duale Thrombozytenaggregationshemmung verschrieben. Dabei werden zwei Thrombozytenaggregationshemmer ein Jahr lang gleichzeitig eingenommen.
- Medikamente gegen Angiotensin-Converting-Enzym-Hemmer – helfen, den Blutdruck zu stabilisieren und Herzdeformationen vorzubeugen.
- Anticholesterin-Medikamente (Statine) – werden zur Verbesserung des Fettstoffwechsels und zur Senkung der Werte von Low-Density-Lipoproteinen und Cholesterin – potenziellen Markern der atherosklerotischen Entwicklung – eingesetzt.
- Antikoagulanzien – verhindern die Bildung von Blutgerinnseln.
Die medikamentöse Therapie wird unbedingt durch allgemeine restaurative Maßnahmen ergänzt – insbesondere erfordert sie die sorgfältige Einhaltung von Ruhe und Bettruhe, Ernährungsumstellungen (Therapietabelle Nr. 10 UND), schrittweise Ausweitung der körperlichen Aktivität.
In den ersten 24 Stunden nach einem Anfall sollte der Patient im Bett bleiben. Fragen zur schrittweisen Wiederaufnahme der motorischen Aktivität werden individuell mit dem behandelnden Arzt besprochen. Es wird empfohlen, Atemübungen zu machen, um einer Lungenstauung vorzubeugen.
Die Nahrungsration ist begrenzt, wodurch der Kaloriengehalt auf 1200–1500 kcal reduziert wird. Tierische Fette und Salz sind auszuschließen. Der Speiseplan wird um pflanzliche Lebensmittel, kaliumhaltige Produkte, Getreide und Meeresfrüchte erweitert. Die Flüssigkeitsaufnahme ist ebenfalls begrenzt (bis zu 1–1,5 Liter pro Tag).
Wichtig: Der Patient sollte vollständig mit dem Rauchen (aktiv und passiv) und dem Alkoholkonsum aufhören.
Nach einem transmuralen Infarkt wird der Patient in die obligatorische Ambulanz eines Kardiologen eingeliefert. Die Beobachtung erfolgt zunächst wöchentlich, dann zweimal monatlich (in den ersten sechs Monaten nach dem Anfall). Nach sechs Monaten genügt ein monatlicher Besuch beim Kardiologen. Der Arzt führt eine Untersuchung durch, führt Kontroll-Elektrokardiographien und Belastungstests durch. [ 9 ]
Chirurgische Behandlung
Die chirurgische Behandlung eines transmuralen Infarkts kann offen (mit Zugang über einen Brustschnitt) oder perkutan (mit Sondierung durch ein arterielles Gefäß) erfolgen. Die zweite Technik wird aufgrund ihrer Effektivität, des geringen Traumas und der minimalen Komplikationen zunehmend eingesetzt.
Häufige Arten perkutaner Operationen:
- Bei der Venenstent-Implantation wird ein spezielles Erweiterungselement im Bereich der Gefäßverengung platziert. Der Stent ist ein zylindrisches Geflecht aus speziellem Kunststoff oder Metall. Er wird mittels einer Sonde in den gewünschten Gefäßbereich eingeführt, dort aufgeweitet und belassen. Die einzige mögliche Komplikation dieser Behandlung kann eine Retrombose sein.
- Bei der Ballon-Gefäßplastik handelt es sich um ein Verfahren, das dem Einsetzen eines Stents ähnelt. Anstelle eines Netzzylinders wird jedoch durch die Sonde ein spezieller Ballonrahmen eingeführt, der sich beim Erreichen des gewünschten Gefäßbereichs aufbläst und das Gefäß erweitert, wodurch der normale Blutfluss wiederhergestellt wird.
- Bei der Laser-Excimer-Gefäßplastik wird eine faseroptische Sonde verwendet, die, wenn sie zum betroffenen Abschnitt der Koronararterie gebracht wird, Laserstrahlung leitet. Die Strahlen wiederum wirken auf das Gerinnsel und zerstören es, wodurch die Durchblutung wiederhergestellt wird.
Die Durchführung einer Operation am offenen Herzen ist bei Patienten mit vollständigem Arterienverschluss sinnvoll, wenn eine Stentimplantation nicht möglich ist oder begleitende Koronarerkrankungen (z. B. Herzfehler) vorliegen. In einer solchen Situation wird eine Bypass-Operation durchgeführt und Gefäßwege (mit Autoimplantaten oder synthetischen Materialien) verlegt. Die Operation wird bei Herzstillstand und Einsatz von AIC („künstlicher Kreislauf“) oder an einem funktionierenden Organ durchgeführt.
Folgende Bypass-Arten sind bekannt:
- Mammarokoronar – als Shunt wird das innere thorakale Arteriengefäß verwendet, das weniger anfällig für atherosklerotische Veränderungen ist und keine Klappen wie eine Vene hat.
- Aortokoronar – Als Shunt wird die patienteneigene Vene verwendet, die an die Koronararterie und die Aorta angenäht wird.
Jede Herzoperation ist ein potenziell gefährlicher Eingriff. Die Operation dauert in der Regel mehrere Stunden. Die ersten zwei Tage verbringt der Patient unter ständiger Aufsicht von Spezialisten auf der Intensivstation. Treten keine Komplikationen auf, wird er auf eine reguläre Station verlegt. Die Besonderheiten der Rehabilitationsphase werden individuell festgelegt.
Verhütung
Präventive Maßnahmen zur Verhinderung der Entstehung eines transmuralen Infarkts zielen darauf ab, die negativen Auswirkungen potenzieller schädlicher Faktoren auf den menschlichen Körper zu reduzieren. Besonders wichtig ist die Vorbeugung eines erneuten Anfalls bei kranken Menschen. Neben der medikamentösen Unterstützung sollten Sie eine Reihe medizinischer Empfehlungen befolgen, darunter Ernährungsumstellungen, Anpassung der körperlichen Aktivität und des Lebensstils.
Daher kann die Prävention primär (für Menschen, die noch nie zuvor einen transmuralen oder anderen Infarkt hatten) und sekundär (zur Verhinderung eines erneuten Herzinfarkts) sein.
Wenn eine Person zur Risikogruppe für die Entwicklung einer kardiovaskulären Pathologie gehört, werden für sie folgende Empfehlungen vorbereitet:
- Erhöhen Sie Ihre körperliche Aktivität.
Hypodynamie kann viele Herz-Kreislauf-Probleme hervorrufen. Die Unterstützung des Herztonus ist besonders für Menschen über 35–40 Jahre notwendig. Sie können das Herz einfach und effektiv durch tägliches Gehen, Joggen, Schwimmen und Radfahren stärken.
- Geben Sie schlechte Gewohnheiten vollständig auf.
Rauchen und Alkoholkonsum sind für jeden schädlich, unabhängig von seinem anfänglichen Gesundheitszustand. Und für Menschen mit Herz-Kreislauf-Erkrankungen sind Alkohol und Zigaretten kategorisch kontraindiziert. Und das sind nicht nur Worte, sondern eine bewiesene Tatsache.
- Ernähren Sie sich qualitativ hochwertig und richtig.
Die Ernährung ist die Grundlage unserer allgemeinen Gesundheit und Gefäßgesundheit. Es ist wichtig, möglichst wenig frittierte Lebensmittel, tierische Fette, Produkte mit synthetischen Ersatzstoffen, Transfette und große Mengen Salz zu sich zu nehmen. Es wird empfohlen, die Ernährung um Gemüse, Gemüse, Obst, Nüsse, Beeren und Meeresfrüchte zu erweitern.
- Vermeiden Sie die negativen Auswirkungen von Stress und streben Sie nach mehr positiven Emotionen.
Es ist wünschenswert, übermäßigen emotionalen Stress und Schocks nach Möglichkeit zu vermeiden. Menschen, die zu Sorgen und Ängsten neigen und Situationen oft „am Herzen“ nehmen, wird empfohlen, Beruhigungsmittel einzunehmen (nach Rücksprache mit einem Arzt).
- Überwachen Sie Ihre Blutdruckwerte.
Oft werden die Prozesse, die zu nachfolgenden Krämpfen und Verstopfungen des Gefäßlumens führen, durch einen Anstieg des Blutdrucks hervorgerufen. Um solche Komplikationen zu vermeiden, sollten Sie Ihren Blutdruck selbstständig überwachen und rechtzeitig von einem Arzt verschriebene blutdrucksenkende Medikamente einnehmen.
- Kontrollieren Sie Ihren Blutzuckerspiegel.
Patienten mit Diabetes mellitus haben Probleme mit dem Zustand der Gefäßwände, die aufgrund der Krankheit spröder werden und leicht verstopfen. Um die Entwicklung pathologischer intravaskulärer Prozesse zu verhindern, ist es notwendig, regelmäßig einen Endokrinologen aufzusuchen, sich einer Behandlung zu unterziehen und unter systematischer medizinischer Kontrolle zu bleiben (zur Überwachung der Blutzuckerwerte).
- Gehen Sie regelmäßig zu einem Kardiologen.
Personen mit einem Risiko für einen transmuralen Infarkt oder andere Herzerkrankungen sollten regelmäßig (1-2 Mal pro Jahr) von einem Allgemeinarzt und einem Kardiologen untersucht werden. Diese Empfehlung gilt insbesondere für Patienten über 40-45 Jahre.
Sekundärprävention soll die Entwicklung eines wiederholten transmuralen Infarktanfalls verhindern, der für den Patienten tödlich sein kann. Zu diesen vorbeugenden Maßnahmen gehören:
- Informieren Sie Ihren Arzt über alle verdächtigen Symptome (auch relativ harmlose).
- Befolgen Sie die Anweisungen und Ratschläge Ihres Arztes.
- Sicherstellung ausreichender körperlicher Aktivität, Ernährung und Anpassung des Lebensstils;
- Auswahl einer Arbeitstätigkeit, die keine übermäßige körperliche Anstrengung erfordert und nicht mit psycho-emotionalen Schocks einhergeht.
Prognose
Pathologien des Herz-Kreislauf-Systems sind der häufigste Faktor für eine erhöhte Sterblichkeit. Der transmurale Myokardinfarkt ist die gefährlichste Komplikation der ischämischen Herzkrankheit, die trotz ständiger Verbesserung der diagnostischen und therapeutischen Methoden nicht „eingedämmt“ werden kann.
Das Überleben nach einem Anfall hängt von vielen Faktoren ab – vor allem von der Geschwindigkeit der medizinischen Versorgung, der Qualität der Diagnose, dem allgemeinen Gesundheitszustand und dem Alter des Patienten. Darüber hinaus hängt die Prognose von der Dauer des Krankenhausaufenthalts ab dem Zeitpunkt des Anfalls, dem Ausmaß der Herzgewebeschädigung, den Blutdruckwerten usw. ab.
Am häufigsten schätzen Experten die Überlebensrate auf ein Jahr, gefolgt von drei, fünf und acht Jahren. In den meisten Fällen gilt eine Überlebensrate von drei Jahren als realistisch, sofern der Patient keine Nierenerkrankungen und keinen Diabetes mellitus hat.
Die Langzeitprognose wird maßgeblich von der Qualität und Vollständigkeit der Behandlung bestimmt. Das höchste Sterberisiko besteht in den ersten zwölf Monaten nach dem Anfall. Die wichtigsten Todesursachen sind:
- Infarktrezidiv (am häufigsten);
- Chronische Myokardischämie;
- Plötzlicher Herztod;
- Lungenembolie;
- Akute Durchblutungsstörung im Gehirn (Schlaganfall).
Eine fachgerecht durchgeführte Rehabilitation ist für die Prognosequalität von entscheidender Bedeutung. Die Rehabilitation sollte folgende Ziele verfolgen:
- Schaffen Sie alle Voraussetzungen für die Erholung des Organismus und seine Anpassung an Standardbelastungen.
- Verbessern Sie die Lebensqualität und Leistungsfähigkeit;
- Reduzieren Sie das Risiko von Komplikationen, einschließlich Rückfällen.
Qualitativ hochwertige Rehabilitationsmaßnahmen sollten sequenziell und ohne Unterbrechung erfolgen. Sie bestehen aus den folgenden Phasen:
- Stationärer Aufenthalt – beginnt mit der Aufnahme des Patienten auf die Intensivstation oder Intensivstation und weiter – in die kardiologische oder vaskuläre Abteilung (Klinik).
- Der Aufenthalt in einem Rehabilitationszentrum oder Sanatorium dauert bis zu 4 Wochen nach einem Herzinfarkt.
- Ambulante Phase – beinhaltet eine ambulante Nachsorge durch einen Kardiologen, Rehabilitologen, Bewegungstrainer (für ein Jahr).
Anschließend wird die Rehabilitation vom Patienten selbstständig zu Hause fortgesetzt.
Grundlage einer erfolgreichen Rehabilitation ist moderate und regelmäßige körperliche Aktivität, deren Schema individuell vom Arzt entwickelt wird. Nach bestimmten Übungen wird der Zustand des Patienten von einem Spezialisten überwacht und anhand verschiedener Kriterien bewertet (besonders relevant sind die sogenannten „Stresstests“). [ 10 ]
Neben körperlicher Aktivität umfasst das Rehabilitationsprogramm auch medikamentöse Unterstützung und eine Anpassung des Lebensstils (Ernährungsumstellung, Gewichtskontrolle, Beseitigung schlechter Gewohnheiten, Überwachung des Fettstoffwechsels). Ein integrierter Ansatz hilft, Komplikationen vorzubeugen und das Herz-Kreislauf-System an die täglichen Aktivitäten anzupassen.
Der transmurale Myokardinfarkt zeichnet sich durch die ungünstigste Prognose aus, was durch die erhöhte Sterbewahrscheinlichkeit bereits im präklinischen Stadium erklärt wird. Etwa 20 % der Patienten sterben innerhalb der ersten vier Wochen nach dem Anfall.

