Facharzt des Artikels
Neue Veröffentlichungen
Subakute nekrotisierende Encephalomyopathie Leia
Zuletzt überprüft: 23.04.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Über die Krankheit wurde erstmals im Jahr 1951 erwähnt. Bis heute wurden mehr als 120 Fälle beschrieben. Die Lei-Krankheit (OMIM 256000) ist eine genetisch heterogene Krankheit, die sowohl vom Kerntyp (autosomal-rezessiv oder mit dem X-Chromosom verbunden) als auch mitochondrial (seltener) vererbt werden kann.
Ursachen von Leias Syndrom
Die Krankheit beruht auf einer Enzymmangel, Bildung Bereitstellung von Energie hauptsächlich durch Stoffwechselstörungen Pyruvinsäure und Defektelektronentransport der Atmungskette. Pyruvat-Dehydrogenase-Komplex-Mangel entwickelt (A-E1-Untereinheit), Pyruvat-Carboxylase, Komplex 1 (NAD Coenzym Q-Reduktase) und komplexen 4 (Cytochromoxidase) die Atmungskette.
Es wurde gefunden, dass Defekte Pyruvat, Komplex 1 (NAD Coenzym Q-Reduktase) und komplexer 4 (Cytochromoxidase) die Atmungskette in autosomal-rezessiv, Defekte des Pyruvat-Dehydrogenase-Komplexes (A-E1-Untereinheit) geerbt - X-chromosomal-rezessiv. Wenn mtDNA Punktmutationen, die beeinflussen, 6-ATPase-Untereinheit, die mitochondriale Vererbung charakteristisch. Tritt am häufigsten Mutation mistsens im Zusammenhang mit dem Austausch von Thymin zu Guanin oder Cytosin an Position 8993 mtDNA. Seltenere Mutation an Position 9176 von mtDNA. Aufgrund der Tatsache, dass Mutationen T8993G - in der Familie beschrieben mit der Anwesenheit dieser beiden Krankheiten Basisdefekt in dem Syndrom NARP. Die Kinder haben auch bei mtDNA-Mutation Position 8344 beschrieben, die in dem Syndrom MERRF gefunden wird.
Es wird vermutet, dass sich im Falle der Akkumulation der mutierten mtDNA in den meisten Mitochondrien ein schwerer Verlauf des Leia-Syndroms entwickelt. In der mitochondrialen Genese dieses Zustandes wird mutante mtDNA in 90% aller Mitochondrien nachgewiesen. Pathogenese ist mit einer Verletzung der Energieproduktion in Zellen und der Entwicklung von Laktatazidose verbunden.
Symptome von Leias Syndrom
Die ersten Anzeichen der Krankheit debütieren in einem frühen Alter (1-3 Jahre). Jedoch sind Fälle von Manifestation der Krankheit bei den 2-Wochen- und 6-7-Jährigen bekannt. Anfangs entwickeln sich unspezifische Störungen: Verzögerung der psychomotorischen Entwicklung, verminderter Appetit, Episoden von Erbrechen und Mangel an Körpergewicht. In den nachfolgenden wachsenden neurologische Symptome: Muskelhypotonie oder Dystonie mit dem Übergang zu Hypertonus, Krampfanfälle, Myoklonien oder tonisch-klonische Anfälle, Zittern der Glieder, choreoathetosis, Koordinationsstörungen, verringerte Sehnenreflexe, Lethargie, Schläfrigkeit. Zerebrale Neurodegeneration hat eine progressive Natur. Die Symptome der pyramidalen und extrapyramidalen Insuffizienz wachsen, der Schluckakt ist gebrochen. Oft gibt es eine solche Änderung der Autorität als Ptosis, ophthalmoplegia, Optikusatrophie, Retinitis pigmentosa weniger. Manchmal entwickelt sich eine hypertrophe Kardiomyopathie, Tachypnoe-Episoden treten auf.
In seltenen Fällen verläuft die Krankheit entsprechend der Art der akuten Enzephalopathie. Charakteristischer ist ein chronischer oder subakuter Strom, der einige Jahre nach Ausbruch der Krankheit zu einem tödlichen Ausgang führt. Bei einem schnellen Fluss (mehrere Wochen) tritt der Tod als Folge einer Lähmung des Atemzentrums auf.
Diagnose von Leias Syndrom
In einem biochemischen Bluttest wird Lactat-Azidose aufgrund der Akkumulation von Milch- und Brenztraubensäuren im Blut und Liquor sowie einer Erhöhung des Gehalts an Alanin im Blut nachgewiesen. Außerdem kann der Gehalt an Ketonkörpern erhöht werden. Im Urin gibt es eine erhöhte Ausscheidung von organischen Säuren: Milchsäure, Fumarsäure usw. Der Gehalt an Carnitin im Blut und in den Geweben ist oft reduziert.
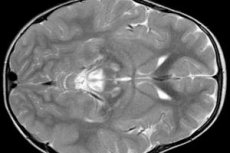
EEG-Ergebnisse zeigen fokale Anzeichen von epileptischer Aktivität. Nach MRT-Daten werden eine Erweiterung der Hirnventrikel, bilaterale Hirnschädigungen, Verkalkungen der Basalganglien (Nucleus caudatus, Schale, schwarze Substanz, blasser Ball) nachgewiesen. Es ist auch möglich, eine Atrophie der Großhirnhemisphären und Hirnsubstanzen zu identifizieren.
Morphologische Studie zeigt grobe Veränderungen in der Hirnsubstanz: symmetrische Nekrose, Demyelinisierung und schwammig Degeneration des Gehirns, in erster Linie Mittelteile, Brücke, Basalganglien, Thalamus, Sehnerv. Das histologische Bild umfasst zystische Degeneration des Hirngewebes, astrozytische Gliose, Tod von Neuronen, eine Zunahme der Mitochondrien in Zellen. Im Skelettmuskel - die Anhäufung von Einschlüssen Lipid verringern histochemische Reaktion auf Komplexe von 1, 4 Atmungskette der Mitochondrien subsarkolemmalnoe Staus, abnormal Mitochondrien mit Unterbrechung der Cristae. Das Phänomen von RRF wird oft nicht erkannt.
Wie zu prüfen?
Welche Tests werden benötigt?
Использованная литература


 [
[