Facharzt des Artikels
Neue Veröffentlichungen
Hepatitis-A-Virus
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
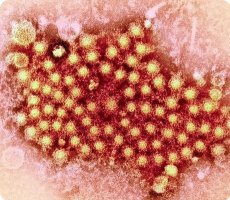
Die virale Hepatitis A ist eine Infektionskrankheit des Menschen, die vor allem durch Leberschäden gekennzeichnet ist und sich klinisch durch Intoxikation und Gelbsucht manifestiert. Das Hepatitis-A-Virus wurde 1973 von S. Feinstone (et al.) mithilfe der Immunelektronenmikroskopie und durch Infektion von Affen – Schimpansen und Weißbüschelaffen – entdeckt. Der Kern der Immunelektronenmikroskopie besteht darin, dem Stuhlfiltrat eines Patienten mit Hepatitis A spezifische Antikörper (Rekonvaleszentenserum) zuzusetzen und das Sediment einer Elektronenmikroskopie zu unterziehen. Durch die Interaktion von Viren mit spezifischen Antikörpern kommt es zu einer spezifischen Aggregation. In diesem Fall sind sie leichter nachweisbar, und die Aggregation unter dem Einfluss von Antikörpern bestätigt die Spezifität des Erregers. S. Feinstones Entdeckung wurde in Experimenten an Freiwilligen bestätigt.
Das Hepatitis-A-Virus ist kugelförmig, der Virionendurchmesser beträgt 27 nm. Das Genom wird durch einzelsträngige positive RNA mit 2,6 mm MD repräsentiert. Es gibt kein Superkapsid. Der Symmetrietyp ist kubisch – Ikosaeder. Das Kapsid hat 32 Kapsomere und wird von vier Polypeptiden (VP1–VP4) gebildet. Seinen Eigenschaften nach gehört das Hepatitis-A-Virus zur Gattung Heparnovirus, Familie Picornaviridae. In Bezug auf Antigene ist das Hepatitis-A-Virus (HAV – Hepatitis-A-Virus) homogen. HAV vermehrt sich gut im Körper von Schimpansen, Pavianen, Mantelpavianen und Weißbüschelaffen. Lange Zeit konnte das Virus nicht kultiviert werden. Erst in den 1980er Jahren gelang es, Zellkulturen zu erhalten, in denen sich HAV vermehrt. Zunächst wurden hierfür kontinuierliche Zelllinien aus Nierenembryos von Rhesusaffen (Kultur FRhK-4) verwendet, heute kommt eine kontinuierliche Zelllinie aus Nierenzellen von Grünen Meerkatzen (Kultur 4647) zum Einsatz.
Gemäß den Empfehlungen der WHO-Experten wurde die folgende Nomenklatur der Hepatitis-A-Virusmarker übernommen: Hepatitis-A-Virus – HAV-Antikörper gegen das Hepatitis-A-Virus: Anti-HAV-IgM und Anti-HAV-IgG.
HAV ist ein kleines Partikel mit einem Durchmesser von 27–30 nm, ikosaedrischer Symmetrie und Homogenität. Das mittels Immunaggregationsmethode erhaltene Elektronenbild zeigt elektronendichte Partikel mit oberflächlich symmetrisch angeordneten Kapsomeren. Bei negativer Kontrastierung sind in den Präparaten sowohl volle als auch leere Partikel erkennbar. Das Nukleokapsid von HAV weist im Gegensatz zu dem der Influenza weder Oberflächenvorsprünge noch eine Membran auf. Wichtig ist auch, dass das HAV-Virion keine herzförmige Struktur aufweist.
Aufgrund seiner physikochemischen Eigenschaften wird das Hepatitis-A-Virus der Familie der Picornaviren zugeordnet, der Gattung Enteroviren mit der Seriennummer 72. Diese Taxonomie erwies sich jedoch als zu ungewöhnlich, und die WHO hielt es für möglich, die Terminologie „Hepatitis-A-Virus“ beizubehalten.
Wie alle Viren der Familie Picornaviridae enthält das Hepatitis-A-Virus Ribonukleinsäure. Einige Labore haben die Möglichkeit nachgewiesen, das Genom des Hepatitis-A-Virus zu klonen, was die Aussicht auf die Entwicklung von Impfstoffen eröffnet.
Resistenz gegen das Hepatitis-A-Virus
Das Virus ist relativ resistent gegen hohe Temperaturen, Säuren, Fettlösemittel (keine Lipide) und Desinfektionsmittel und verträgt niedrige Temperaturen gut. All dies trägt zu seiner langfristigen Konservierung in der äußeren Umgebung bei. Bei Raumtemperatur überlebt es mehrere Wochen, bei 60 °C verliert es seine Infektiosität teilweise nach 4–12 Stunden und vollständig – nach einigen Minuten bei 85 °C. Es ist sehr resistent gegen Chlor, wodurch es durch die Barrieren von Wasseraufbereitungsanlagen ins Leitungswasser eindringen kann.
Zusammenfassend lässt sich das Hepatitis-A-Virus wie folgt charakterisieren:
- der natürliche Wirt ist der Mensch;
- Versuchstiere - Weißbüschelaffen, Schimpansen;
- die Infektionsquelle sind Fäkalien;
- die Krankheit ist epidemisch und endemisch;
- Übertragungsweg: fäkal-oral;
- Inkubationszeit - 14-40 Tage;
- Übergang zur chronischen Hepatitis - nicht beobachtet.
Die immunologischen Eigenschaften von HAV sind wie folgt:
- Prototypische Stämme – Ms-1, CR-326, GВG. Alle sind immunologisch ähnlich oder identisch;
- Antikörper – IgM und IgG – werden als Reaktion auf die Einführung von Strukturproteinen des Virus produziert und haben eine schützende Wirkung.
- I. Die schützende Wirkung von menschlichem Serum-Gammaglobulin – verhindert oder lindert die Krankheit, wenn es vor der Infektion oder während der Inkubationszeit verabreicht wird.
Die physikochemischen Eigenschaften von NAU sind wie folgt:
- Morphologie: schalenloses kugelförmiges Partikel mit kubischer Symmetrie, Kapsid besteht aus 32 Kapsomeren;
- Durchmesser - 27–30 nm;
- Dichte in CsCl (g/cm3) – 1,38–1,46 (offene Partikel), 1,33–1,34 (reifes Virion), 1,29–1,31 (unreife Virionen, leere Partikel);
- Sedimentationskoeffizient – 156–160 reife Virionen;
- Nukleinsäure ist eine einzelsträngige, lineare RNA;
- Relatives Molekulargewicht - 2,25 106-2,8 106 kD;
- Die Anzahl der Nukleotide beträgt 6.500–8.100.
Die Stabilität von HAV gegenüber physikalischen und chemischen Einflüssen ist wie folgt:
- Chloroform, Ether – stabil;
- Chlor, 0,5–1,5 mg/l, 5 °C, 15 min – teilweise Inaktivierung;
- Chloramin, 1 g/l, 20 °C, 15 min – vollständige Inaktivierung;
- Formalin, 1:4000, 35–37 °C, 72 h – vollständige Inaktivierung, 1:350, 20 °C, 60 min – teilweise Inaktivierung.
Temperatur:
- 20–70 °C – stabil;
- 56 °C, 30 min - stabil;
- 60 °C, 12 h – teilweise Inaktivierung;
- 85 °C, 1 min – vollständige Inaktivierung;
- Autoklavieren, 120 °C, 20 Min. – vollständige Inaktivierung;
- Trockene Hitze, 180 °C, 1 Stunde – vollständige Inaktivierung;
- UFO, 1,1 W, 1 Min. – vollständige Inaktivierung.
Die präsentierten Daten zeigen, dass das Hepatitis-A-Virus in seinen physikochemischen Eigenschaften den Enteroviren am nächsten steht. Wie andere Enteroviren ist HAV gegenüber vielen Desinfektionslösungen resistent und wird bei 85 °C und Autoklavieren innerhalb weniger Minuten vollständig inaktiviert.
Es ist erwiesen, dass sich das Hepatitis-A-Virus in primären und kontinuierlichen Monolayer-Linien menschlicher und Affenzellkulturen vermehren kann. Eine besonders aktive Vermehrung des Hepatitis-A-Virus in In-vitro-Kulturen wird beobachtet, wenn Leberextrakte kranker Affen als Ausgangsmaterial verwendet werden. Es ist jedoch zu beachten, dass bei allen Experimenten zur Vermehrung des Hepatitis-A-Virus in In-vitro-Kulturen die lange Inkubationszeit während der Primärpassagen (bis zu 4–10 Wochen) hervorgehoben wird. Anschließend nimmt die Akkumulation viralen genetischen Materials zu, die absoluten Werte bleiben jedoch sehr unbedeutend, was viele Forscher dazu veranlasst, von einer unvollständigen Replikation des Hepatitis-A-Virus in Gewebekulturen zu sprechen.
Fasst man die Literaturdaten zur Reproduktion des Hepatitis-A-Virus in extrazellulären Kulturen zusammen, lässt sich sagen, dass das langfristige Überleben von HAV in vitro außer Zweifel steht. Optimale Bedingungen für eine stabile, hohe Virusreplikation sind noch nicht endgültig identifiziert, was die Erforschung seiner biologischen Eigenschaften sowie die Gewinnung von Reagenzien für die Diagnostik und die Impfstoffentwicklung erschwert.
Gleichzeitig finden sich in der Literatur optimistischere Einschätzungen zu diesem Problem. Die Lösung aller Probleme im Zusammenhang mit der Kultivierung des Hepatitis-A-Virus ist eine Frage der nahen Zukunft. Bei der Untersuchung der optimalen Bedingungen für die Reproduktion von HAV in der Kultur embryonaler Nierenzellen des Rhesusaffen wurden zwei Phasen identifiziert: die Phase der Produktion des infektiösen Virus (bis zu 6–8 Tage auf der Ebene der 5. Passage) und die Phase der intensiven Akkumulation des viralen Antigens. Es wurde auch gezeigt, dass die stärkste Akkumulation des viralen Antigens unter den Bedingungen der sogenannten Rollenkultivierung (rotierende Kolben) auftritt. Diese Methode eröffnet breite Möglichkeiten zur Gewinnung von kulturellem Antigen in großen Mengen und wird folglich das Ausgangsmaterial für die Vorbereitung diagnostischer Systeme und die Herstellung von Impfstoffen bereitstellen.
Epidemiologie der Hepatitis A
Das Hepatitis-A-Virus ist für den Menschen hochpathogen. Laut WHO (1987) reicht eine Infektion mit nur einem Virion aus, um die Erkrankung auszulösen. Die praktische Infektionsdosis ist jedoch vermutlich wesentlich höher. Die einzige Infektionsquelle ist ein infizierter Mensch. Das Virus wird 12–14 Tage vor Beginn der Gelbsucht und während der 3 Wochen der ikterischen Periode in großen Mengen mit dem Stuhl ausgeschieden. Es wurden keine signifikanten Unterschiede in der Ausscheidung des Erregers bei Patienten mit ikterischer, anikterischer und asymptomatischer Form der Hepatitis A festgestellt. Die Infektion erfolgt fäkal-oral, vorwiegend über Wasser sowie über den Haushalt und Lebensmittel. Die Infektion erfolgt fäkal-oral, vorwiegend über Wasser sowie über den Haushalt und Lebensmittel. Der wichtigste (primäre) Übertragungsweg des Virus ist über Wasser. Auch eine Infektion durch Tröpfchen in der Luft ist möglich. Die Anfälligkeit der Bevölkerung ist universell. Vorwiegend sind Kinder unter 14 Jahren betroffen. Die Krankheit weist eine ausgeprägte Herbst-Winter-Saisonalität auf.
 [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Symptome von Hepatitis A
Die Inkubationszeit variiert je nach Infektionsdosis des Virus zwischen 15 und 50 Tagen, beträgt aber im Durchschnitt 28-30 Tage. Im Körper vermehrt sich das Hepatitis-A-Virus in den regionalen Lymphknoten, dringt in das Blut und dann in die Leberzellen ein und verursacht eine akute diffuse Hepatitis, die mit einer Schädigung der Hepatozyten und retikuloendothelialen Elemente der Leber sowie einer Abnahme ihrer Entgiftungs- und Barrierefunktionen einhergeht. Die Schädigung der Hepatozyten erfolgt nicht durch die direkte Wirkung des Virus, sondern durch immunpathologische Mechanismen. Das typischste Bild der Hepatitis A ist eine akute ikterische zyklische Form: Inkubationszeit, Prodromalphase (präikterisch), ikterische Phase und Rekonvaleszenz. In den Infektionsherden wird jedoch eine große Anzahl von Patienten mit anikterischen und asymptomatischen Infektionsformen nachgewiesen, deren Anzahl die der ikterischen deutlich überwiegt ("Eisbergphänomen").
Die Immunität nach der Infektion ist stark und langanhaltend und wird durch virusneutralisierende Antikörper und Immungedächtniszellen verursacht.
Mikrobiologische Diagnostik der Hepatitis A
Die Diagnostik der Hepatitis A (mit Ausnahme von Infektionen bei Tieren – Schimpansen, Weißbüschelaffen, Pavianen, die wir nicht kennen) basiert auf verschiedenen immunologischen Methoden: RSC, Immunfluoreszenzmethode, Hämagglutination der Immunadhäsion (der Komplex aus viralem Antigen + Antikörper adsorbiert in Gegenwart von Komplement an Erythrozyten und bewirkt deren Verklebung). Die Anwendungsmöglichkeiten dieser Methoden sind jedoch aufgrund des Mangels an spezifischen viralen Antigenen eingeschränkt, und die Immunfluoreszenzreaktion erfordert eine Leberbiopsie, was unerwünscht ist. Die Methode der Immunelektronenmikroskopie ist zuverlässig und spezifisch, aber sehr arbeitsintensiv. Daher ist die einzige akzeptable immunologische Reaktion bisher die Methode der Immunosorbentanalyse der Festphase in Form von IFM oder RIM, insbesondere in der Modifikation der „Erfassung“ von Immunglobulinen der Klasse M. In unserem Land wurde zu diesem Zweck ein Testsystem vorgeschlagen – „DIAGN-A-HEP“. Das Funktionsprinzip dieses Testsystems ist wie folgt. Zunächst werden Antikörper gegen Immunglobuline der Klasse M (Antiimmunglobuline M) an den Wänden von Polystyrol-Vertiefungen sorbiert, anschließend wird das zu testende Patientenserum hinzugefügt. Enthält es IgM-Antikörper, binden diese an Anti-Antikörper der Klasse M. Anschließend wird ein spezifisches virales Antigen (Hepatitis-A-Virus) hinzugefügt, das durch Züchtung in Zellkultur gewonnen wird. Das System wird gewaschen und mit Meerrettichperoxidase markierte antivirale Antikörper hinzugefügt. Wenn alle vier Komponenten des Systems interagieren, entsteht ein vierschichtiges „Sandwich“:
- Antiimmunglobuline M,
- Immunglobuline M (gegen das Hepatitis-A-Virus - im Serum des untersuchten Patienten),
- virales Antigen,
- enzymmarkierte antivirale Antikörper.
Um diesen Komplex zu detektieren, wird ein Substrat für das Enzym in die Vertiefungen gegeben. Unter dem Einfluss des Enzyms wird es zerstört und ein farbiges Produkt entsteht. Die Farbintensität kann mit einem Spektralphotometer oder Photokolorimeter quantitativ gemessen werden.
Der Vorteil der IgM-„Capture“-Methode besteht darin, dass Antikörper dieser Immunglobulinklasse während der primären Immunantwort auftreten und das aktive Stadium der Infektion anzeigen. Nach Durchlaufen der Krankheit verschwinden sie wieder. Antivirale Antikörper der IgG-Klasse hingegen bleiben lange nach Durchlaufen der Krankheit bestehen und vermitteln erworbene Immunität. Zum Nachweis des Hepatitis-A-Virus wurde eine DNA-Sondenmethode vorgeschlagen: Komplementäre vRNA-DNA wird als Sonde verwendet.
Spezifische Prävention von Hepatitis A
Die bisher weit verbreitete Seroprophylaxe der Hepatitis A mit Gammaglobulin rechtfertigte sich nicht, daher wurde der Schwerpunkt auf die Durchführung einer Impfprophylaxe gelegt, d. h. eine Impfung gegen Hepatitis A wird durchgeführt. Zu diesem Zweck werden verschiedene Impfstoffe entwickelt und bereits eingesetzt. In Russland wurde bereits 1995 ein wirksamer Impfstoff gegen Hepatitis A entwickelt, der heute erfolgreich eingesetzt wird.

