Facharzt des Artikels
Neue Veröffentlichungen
Diagnose der Osteoarthritis: Magnetresonanztomographie
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
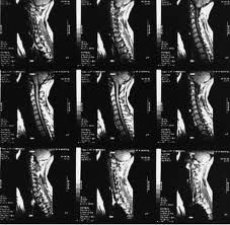
Die Magnetresonanztomographie (MRT) hat sich in den letzten Jahren zu einer der führenden Methoden zur nicht-invasiven Diagnostik von Arthrose entwickelt. Seit den 1970er Jahren, als die Prinzipien der Magnetresonanztomographie (MRT) erstmals zur Untersuchung des menschlichen Körpers eingesetzt wurden, hat sich diese Methode der medizinischen Bildgebung dramatisch verändert und entwickelt sich weiterhin rasant weiter.
Technische Geräte und Software werden verbessert, Bildaufnahmemethoden weiterentwickelt und MR-Kontrastmittel entwickelt. Dadurch erschließen sich ständig neue Anwendungsgebiete für die MRT. War ihre Anwendung zunächst auf Untersuchungen des zentralen Nervensystems beschränkt, wird sie heute in nahezu allen Bereichen der Medizin erfolgreich eingesetzt.
1946 entdeckten Forschergruppen der Universitäten Stanford und Harvard unabhängig voneinander ein Phänomen namens Kernspinresonanz (NMR). Sein Kern bestand darin, dass die Kerne einiger Atome in einem Magnetfeld unter dem Einfluss eines externen elektromagnetischen Feldes Energie absorbieren und dann in Form eines Funksignals abgeben können. Für diese Entdeckung erhielten F. Bloch und E. Parmel 1952 den Nobelpreis. Das neue Phänomen wurde bald für die Spektralanalyse biologischer Strukturen (NMR-Spektroskopie) genutzt. 1973 demonstrierte Paul Rautenburg erstmals die Möglichkeit, mithilfe von NMR-Signalen ein Bild zu erhalten. So entstand die NMR-Tomographie. Die ersten NMR-Tomogramme der inneren Organe eines lebenden Menschen wurden 1982 auf dem Internationalen Radiologenkongress in Paris vorgeführt.
Zwei Klarstellungen sind angebracht. Obwohl die Methode auf dem NMR-Phänomen basiert, wird sie Magnetresonanz (MR) genannt, wobei das Wort „nuklear“ weggelassen wird. Dies geschieht, damit die Patienten nicht an Radioaktivität im Zusammenhang mit dem Zerfall von Atomkernen denken. Und der zweite Umstand: MR-Tomographen sind nicht zufällig auf Protonen, also Wasserstoffkerne, „abgestimmt“. Dieses Element ist in Geweben in großen Mengen vorhanden, und seine Kerne haben das größte magnetische Moment aller Atomkerne, was ein relativ hohes MR-Signalniveau bedingt.
Gab es 1983 weltweit nur wenige für die klinische Forschung geeignete Geräte, so waren Anfang 1996 weltweit rund 10.000 Tomographen im Einsatz. Jährlich werden 1.000 neue Geräte eingeführt. Mehr als 90 % der MR-Tomographen sind Modelle mit supraleitenden Magneten (0,5–1,5 T). Interessant ist, dass sich die Hersteller von MR-Tomographen Mitte der 80er Jahre noch vom Prinzip „je höher das Feld, desto besser“ leiten ließen und sich auf Modelle mit einer Feldstärke von 1,5 T und mehr konzentrierten, Ende der 80er Jahre jedoch klar wurde, dass sie in den meisten Anwendungsbereichen keine nennenswerten Vorteile gegenüber Modellen mit durchschnittlicher Feldstärke haben. Daher widmen die wichtigsten Hersteller von MR-Tomographen (General Electric, Siemens, Philips, Toshiba, Picker, Bruker usw.) derzeit der Produktion von Modellen mit mittleren und sogar niedrigen Feldern große Aufmerksamkeit, die sich von Hochfeldsystemen durch ihre Kompaktheit und Wirtschaftlichkeit bei zufriedenstellender Bildqualität und deutlich geringeren Kosten unterscheiden. Hochfeldsysteme werden hauptsächlich in Forschungszentren für die MR-Spektroskopie eingesetzt.
Prinzip der MRT-Methode
Die Hauptkomponenten eines MRT-Scanners sind: ein extrem starker Magnet, ein Funksender, eine Empfangsspule für Hochfrequenz, ein Computer und ein Bedienfeld. Die meisten Geräte verfügen über ein Magnetfeld mit einem magnetischen Moment parallel zur Längsachse des menschlichen Körpers. Die magnetische Feldstärke wird in Tesla (T) gemessen. Für klinische MRT-Untersuchungen werden Felder mit einer Stärke von 0,2–1,5 T verwendet.
Wird ein Patient einem starken Magnetfeld ausgesetzt, drehen sich alle Protonen, die magnetische Dipole sind, in Richtung des äußeren Feldes (wie eine Kompassnadel, die auf das Magnetfeld der Erde ausgerichtet ist). Zusätzlich beginnen die magnetischen Achsen jedes Protons, sich um die Richtung des äußeren Magnetfelds zu drehen. Diese spezielle Drehbewegung wird Prozession genannt, ihre Frequenz Resonanzfrequenz. Werden kurze elektromagnetische Hochfrequenzimpulse durch den Körper des Patienten geleitet, bewirkt das Magnetfeld der Radiowellen, dass die magnetischen Momente aller Protonen um das magnetische Moment des äußeren Feldes rotieren. Dazu muss die Frequenz der Radiowellen gleich der Resonanzfrequenz der Protonen sein. Dieses Phänomen wird Magnetresonanz genannt. Um die Ausrichtung der magnetischen Protonen zu ändern, müssen die Magnetfelder der Protonen und der Radiowellen in Resonanz sein, d. h. die gleiche Frequenz haben.
Im Gewebe des Patienten entsteht ein magnetisches Nettomoment: Das Gewebe wird magnetisiert, und sein Magnetismus ist streng parallel zum äußeren Magnetfeld ausgerichtet. Der Magnetismus ist proportional zur Anzahl der Protonen pro Gewebevolumen. Aufgrund der enormen Anzahl an Protonen (Wasserstoffkernen), die in den meisten Geweben enthalten sind, ist das magnetische Nettomoment groß genug, um in einer außerhalb des Patienten befindlichen Empfangsspule einen elektrischen Strom zu induzieren. Diese induzierten MR-Signale dienen zur Rekonstruktion des MR-Bildes.
Der Übergang der Elektronen eines Atomkerns vom angeregten in den Gleichgewichtszustand wird als Spin-Gitter-Relaxation oder longitudinale Relaxation bezeichnet. Er ist durch T1 – die Spin-Gitter-Relaxationszeit – gekennzeichnet. Diese Zeit benötigt T1, um 63 % der Atomkerne nach ihrer Anregung durch einen 90°-Impuls in den Gleichgewichtszustand zu überführen. T2 – die Spin-Spin-Relaxationszeit – wird ebenfalls unterschieden.
Es gibt mehrere Methoden zum Erstellen von MR-Tomogrammen. Sie unterscheiden sich in der Reihenfolge und Art der Erzeugung der Radiofrequenzimpulse und den Methoden der MR-Signalanalyse. Die beiden am weitesten verbreiteten Methoden sind Spin-Gitter und Spin-Echo. Bei der Spin-Gitter-Analyse wird hauptsächlich die T1-Relaxationszeit analysiert. Verschiedene Gewebe (graue und weiße Substanz des Gehirns, Zerebrospinalflüssigkeit, Tumorgewebe, Knorpel, Muskeln usw.) enthalten Protonen mit unterschiedlichen T1-Relaxationszeiten. Die Intensität des MR-Signals hängt von der T1-Dauer ab: Je kürzer T1, desto intensiver ist das MR-Signal und desto heller erscheint der jeweilige Bildbereich auf dem Fernsehmonitor. Fettgewebe ist auf MR-Tomogrammen weiß, gefolgt von Gehirn und Rückenmark, dichten inneren Organen, Gefäßwänden und Muskeln in absteigender Reihenfolge der MR-Signalintensität. Luft, Knochen und Verkalkungen erzeugen praktisch kein MR-Signal und werden daher schwarz dargestellt. Diese T1-Relaxationszeitbeziehungen schaffen die Voraussetzungen für die Visualisierung von normalem und verändertem Gewebe auf MRT-Scans.
Bei einem anderen MRT-Verfahren, dem Spin-Echo-Verfahren, werden eine Reihe von Radiofrequenzimpulsen auf den Patienten gerichtet, wodurch die präzedierenden Protonen um 90° rotieren. Nach dem Ende der Impulse werden die MRT-Antwortsignale aufgezeichnet. Die Intensität des Antwortsignals hängt jedoch unterschiedlich von der T2-Dauer ab: Je kürzer T2, desto schwächer das Signal und folglich desto geringer die Helligkeit des Leuchtens auf dem Fernsehbildschirm. Daher ist das endgültige MRT-Bild bei der T2-Methode das Gegenteil von dem bei der T1-Methode (da ein Negativ das Gegenteil eines Positivs ist).
MRT-Tomogramme stellen Weichteile besser dar als CT-Scans: Muskeln, Fettschichten, Knorpel und Blutgefäße. Einige Geräte können Bilder von Blutgefäßen erzeugen, ohne ein Kontrastmittel zu injizieren (MRT-Angiographie). Aufgrund des geringen Wassergehalts im Knochengewebe erzeugt dieses keinen abschirmenden Effekt wie bei der Röntgen-CT, d. h. es beeinträchtigt nicht die Abbildung von beispielsweise Rückenmark, Bandscheiben usw. Natürlich sind Wasserstoffkerne nicht nur im Wasser enthalten, sondern im Knochengewebe sind sie in sehr großen Molekülen und dichten Strukturen fixiert und stören die MRT nicht.
Vor- und Nachteile der MRT
Zu den Hauptvorteilen der MRT zählen Nichtinvasivität, Unbedenklichkeit (keine Strahlenbelastung), dreidimensionale Bildaufnahme, natürlicher Kontrast durch fließendes Blut, keine Artefakte durch Knochengewebe, hohe Weichteildifferenzierung und die Möglichkeit der MP-Spektroskopie für In-vivo-Gewebestoffwechselstudien. Die MRT ermöglicht die Aufnahme von Bildern dünner Schichten des menschlichen Körpers in jedem beliebigen Bereich – in der Frontal-, Sagittal-, Axial- und Schrägebene. Es ist möglich, volumetrische Bilder von Organen zu rekonstruieren und die Aufnahme von Tomogrammen mit den Aufnahmen des Elektrokardiogramms zu synchronisieren.
Zu den Hauptnachteilen zählen in der Regel die relativ lange Zeit, die zum Erhalten von Bildern benötigt wird (normalerweise Minuten), was zum Auftreten von Artefakten durch Atembewegungen führt (dies verringert insbesondere die Wirksamkeit der Lungenuntersuchung), Arrhythmien (bei der Herzuntersuchung), die Unfähigkeit, Steine, Verkalkungen und einige Arten von Knochenpathologien zuverlässig zu erkennen, die hohen Kosten der Geräte und ihrer Bedienung, besondere Anforderungen an die Räumlichkeiten, in denen sich die Geräte befinden (Abschirmung vor Störungen), die Unmöglichkeit, Patienten mit Klaustrophobie zu untersuchen, künstliche Herzschrittmacher, große Metallimplantate aus nicht medizinischen Metallen.
 [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Kontrastmittel für die MRT
Zu Beginn der MRT-Anwendung glaubte man, der natürliche Kontrast zwischen verschiedenen Geweben mache Kontrastmittel überflüssig. Bald stellte sich heraus, dass der Signalunterschied zwischen verschiedenen Geweben, d. h. der Kontrast des MR-Bildes, durch Kontrastmittel deutlich verbessert werden konnte. Mit der Markteinführung des ersten MR-Kontrastmittels (mit paramagnetischen Gadoliniumionen) erhöhte sich der diagnostische Informationsgehalt der MRT deutlich. Der Einsatz von MR-Kontrastmitteln besteht im Wesentlichen in der Veränderung der magnetischen Parameter von Gewebe- und Organprotonen, d. h. in der Veränderung der Relaxationszeit (TR) von T1- und T2-Protonen. Heute gibt es mehrere Klassifikationen von MR-Kontrastmitteln (bzw. Kontrastmitteln – CA).
Entsprechend der vorherrschenden Wirkung auf die Relaxationszeit wird MR-KA unterteilt in:
- T1-CA, die T1 verkürzen und dadurch die Intensität des Gewebe-MP-Signals erhöhen. Sie werden auch als positive CA bezeichnet.
- T2-CAs, die T2 verkürzen und die Intensität des MR-Signals reduzieren. Dies sind negative CAs.
Abhängig von ihren magnetischen Eigenschaften werden MR-CA in paramagnetische und superparamagnetische unterteilt:
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Paramagnetische Kontrastmittel
Paramagnetische Eigenschaften besitzen Atome mit einem oder mehreren ungepaarten Elektronen. Dies sind magnetische Ionen von Gadolinium (Gd), Chrom, Nickel, Eisen und Mangan. Gadoliniumverbindungen haben die größte klinische Anwendung gefunden. Die Kontrastwirkung von Gadolinium beruht auf der Verkürzung der Relaxationszeiten T1 und T2. Bei niedrigen Dosen überwiegt der Effekt auf T1, was die Signalintensität erhöht. Bei hohen Dosen überwiegt der Effekt auf T2, was die Signalintensität verringert. Paramagnete werden heute in der klinisch-diagnostischen Praxis am häufigsten eingesetzt.
Superparamagnetische Kontrastmittel
Der dominierende Effekt von superparamagnetischem Eisenoxid ist die Verkürzung der T2-Relaxation. Mit steigender Dosis nimmt die Signalintensität ab. Ferromagnetische CAs, zu denen ferromagnetische Eisenoxide gehören, die strukturell dem Magnetitferrit (Fe 2+ OFe 23+ O 3 ) ähneln, können ebenfalls dieser Gruppe von CAs zugeordnet werden.
Die folgende Klassifizierung basiert auf der Pharmakokinetik von CA (Sergeev PV et al., 1995):
- extrazellulär (gewebeunspezifisch);
- Magen-Darm-Trakt;
- organotrop (gewebespezifisch);
- makromolekulare, die zur Bestimmung des Gefäßraums verwendet werden.
In der Ukraine sind vier MR-CA bekannt, die extrazelluläre wasserlösliche paramagnetische CA sind. Gadodiamid und Gadopentetsäure werden häufig verwendet. Die übrigen CA-Gruppen (2-4) werden im Ausland klinisch getestet.
Extrazelluläres wasserlösliches MR-CA
Internationaler Name |
Chemische Formel |
Struktur |
Gadopentetsäure |
Gadoliniumdimeglumindiethylentriaminpentaacetat ((NMG)2Gd-DTPA) |
Linear, ionisch |
Gadotersäure |
(NMG)Gd-DOTA |
Zyklisch, ionisch |
Gadodiamid |
Gadoliniumdiethylentriaminpentaacetat-bis-methylamid (Gd-DTPA-BMA) |
Linear, nichtionisch |
Gadoteridol |
Gd-HP-D03A |
Zyklisch, nichtionisch |
Extrazelluläre CA werden intravenös verabreicht, werden zu 98 % über die Nieren ausgeschieden, durchdringen die Blut-Hirn-Schranke nicht, haben eine geringe Toxizität und gehören zur Gruppe der paramagnetischen Substanzen.
Kontraindikationen für die MRT
Absolute Kontraindikationen sind Bedingungen, unter denen die Untersuchung eine Gefahr für das Leben des Patienten darstellt. Ein Beispiel hierfür sind Implantate, die elektronisch, magnetisch oder mechanisch aktiviert werden – das sind in erster Linie künstliche Herzschrittmacher. Die Einwirkung von Hochfrequenzstrahlung eines MRT-Scanners kann die Funktion eines im Herzschrittmachersystem betriebenen Schrittmachers stören, da Veränderungen der Magnetfelder die Herzaktivität imitieren können. Magnetische Anziehung kann auch dazu führen, dass sich der Schrittmacher in seiner Fassung verschiebt und die Elektroden bewegt. Darüber hinaus behindert das Magnetfeld die Funktion ferromagnetischer oder elektronischer Mittelohrimplantate. Künstliche Herzklappen sind gefährlich und stellen nur dann eine absolute Kontraindikation dar, wenn sie in MRT-Scannern mit hohen Feldern untersucht werden und ein klinischer Verdacht auf eine Klappenschädigung besteht. Absolute Kontraindikationen für die Untersuchung sind auch kleine chirurgische Metallimplantate (hämostatische Clips) im Zentralnervensystem, da ihre Verschiebung durch magnetische Anziehung Blutungsgefahr birgt. Ihr Vorhandensein in anderen Körperteilen stellt weniger ein Risiko dar, da nach der Behandlung Fibrose und Kapselung der Klammern zu ihrer Stabilität beitragen. Neben der potenziellen Gefahr verursacht das Vorhandensein metallischer Implantate mit magnetischen Eigenschaften jedoch in jedem Fall Artefakte, die die Interpretation der Studienergebnisse erschweren.
Kontraindikationen für die MRT
Absolute: |
Relativ: |
Herzschrittmacher |
Andere Stimulanzien (Insulinpumpen, Nervenstimulatoren) |
Ferromagnetische oder elektronische Mittelohrimplantate |
Nichtferromagnetische Innenohrimplantate, Herzklappenprothesen (bei hohen Feldern, bei Verdacht auf Funktionsstörungen) |
Hämostatische Clips der Hirngefäße |
Hämostatische Clips an anderen Stellen, dekompensierte Herzinsuffizienz, Schwangerschaft, Klaustrophobie, Notwendigkeit einer physiologischen Überwachung |
Zu den relativen Kontraindikationen zählen neben den oben genannten eine dekompensierte Herzinsuffizienz und die Notwendigkeit einer physiologischen Überwachung (mechanische Beatmung, elektrische Infusionspumpen). Klaustrophobie ist in 1-4 % der Fälle ein Hindernis für die Untersuchung. Sie kann einerseits durch die Verwendung von Geräten mit offenen Magneten und andererseits durch eine detaillierte Erklärung des Geräts und des Untersuchungsverlaufs überwunden werden. Es gibt keine Hinweise auf eine schädigende Wirkung der MRT auf den Embryo oder Fötus, es wird jedoch empfohlen, im ersten Schwangerschaftstrimester auf eine MRT zu verzichten. Der Einsatz einer MRT während der Schwangerschaft ist in Fällen angezeigt, in denen andere nichtionisierende bildgebende Diagnostikverfahren keine zufriedenstellenden Informationen liefern. Die MRT-Untersuchung erfordert eine stärkere Mitarbeit des Patienten als die Computertomographie, da Patientenbewegungen während der Untersuchung einen viel größeren Einfluss auf die Bildqualität haben, sodass die Untersuchung von Patienten mit akuten Erkrankungen, Bewusstseinsstörungen, spastischen Zuständen, Demenz sowie von Kindern oft schwierig ist.

