Facharzt des Artikels
Neue Veröffentlichungen
Arachnodaktylie
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
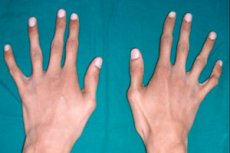
Zu den seltenen erblichen Bindegewebserkrankungen zählt die Arachnodaktylie – eine Deformation der Finger, die mit einer Verlängerung der Röhrenknochen, Skelettverkrümmungen, Störungen des Herz-Kreislauf-Systems und der Sehorgane einhergeht.
Die Krankheit wurde erstmals von Dr. Williams und dem französischen Kinderarzt Marfan beschrieben, die sie Dolichostenomelie nannten. Später tauchte der Begriff Marfan-Syndrom in der Weltmedizin auf, und seit 1902 wird der Name Arachnodaktylie verwendet. Die Pathologie steht im Zusammenhang mit angeborenen Bindegewebserkrankungen, und eines der Hauptsymptome sind verlängerte, verdünnte und gekrümmte „Spinnenfinger“. [ 1 ]
Epidemiologie
Arachnodaktylie gilt als erbliche monogene Bindegewebserkrankung mit autosomal-dominantem Erbgang, hoher Penetranz und unterschiedlicher Expressivität.
In etwa 75-80 % der Fälle ist die Krankheit erblich bedingt, in den übrigen Fällen entsteht sie durch spontane Mutationen (insbesondere durch Punkt-Missense-Mutationen). [ 2 ]
Es ist erwiesen, dass die pathogenetischen Merkmale der Arachnodaktylie durch Veränderungen in mehreren Genen verursacht werden (in 95 % der Fälle):
- im Fibrillin-1-Gen (etwa tausend Mutationen wurden untersucht) auf Chromosom 15q21.1;
- das TGFβR1- oder TGFβR2-Gen auf Chromosom 9 und 3p24.2-P25.
Diese Veränderungen wirken sich direkt auf das Ausmaß der klinischen Manifestationen aus.
Bei 5 % der Patienten wurden Mutationen in der α-2-Kette des Kollagen Typ I beschrieben.
Die Prävalenz der Arachnodaktylie liegt bei etwa 2 Fällen pro 5.000 Einwohner. Eine Unterscheidung nach Rasse oder Geschlecht ist nicht möglich. [ 3 ]
Ursachen Arachnodaktylie
Arachnodaktylie entsteht durch eine spontane Mutation. Die Krankheit ist nicht durch die allgemein bekannten Anzeichen angeborener Erbkrankheiten gekennzeichnet, und verlängerte Finger manifestieren sich hauptsächlich beim Marfan-Syndrom und bei Homocystinurie.
Die Erkrankung ist selten, und alle Patienten wiesen eine Mutation des FBN1-Gens (Fibrillin-Gen) auf Chromosom 15 in der Region q21.1 auf. Der klinische Polymorphismus des Syndroms lässt sich durch die Masse der Mutationen erklären, wobei etwa 15 % Mutationen sind, die während der Empfängnis auftraten. [ 4 ]
Atypische Varianten der Arachnodaktylie werden durch Mutationen in anderen Genen verursacht: Es wurde ein Zusammenhang zwischen der Entwicklung der Pathologie und Mutationen im LTBP3, R-Gen entdeckt, das auf Chromosom 14 in der Region q24 lokalisiert ist und den Wachstumsfaktor transformiert.
Die überwiegende Mehrheit der Mutationen sind sogenannte Missense-Mutationen (ca. 57 %). Mehr als 20 % sind kleine Deletionen mit Verlust von Chromosomenteilen, etwa 12 % sind Mutationen an Splicing-Sites, 8 % sind Nonsense-Mutationen und 2 % sind großflächige Rearrangements und Deletionen. [ 5 ]
Die kongenitale kontrakturale Arachnodaktylie beruht auf einer Störung der Synthese des Proteinwirkstoffs Fibrillin-2. Ursache ist eine Mutation im FBN2-Gen auf dem fünften Chromosom in der Region q23-q31. Bei allen Mutationen handelt es sich überwiegend um Punktmutationen, die das Codon so verändern, dass es für eine andere Aminosäure kodiert. [ 6 ]
Homocystinurie entwickelt sich vor dem Hintergrund eines gestörten Stoffwechsels der essentiellen Aminosäure Methionin. Die Grundlage der Pathologie kann der Aktivitätsverlust oder die Abnahme der folgenden Enzymsubstanzen sein:
- Cystathionin-Beta-Synthase (CBS)-Enzym. Die Pathologie ist B6 resistent und manifestiert sich mit für die B6-unabhängige Form charakteristischen Symptomen . Die Einführung eines B6-Vitaminpräparats führt jedoch nicht zu einer Besserung.
- Enzym N5, N10 Methylentetrahydrofolatreduktase (MTHFR). Dieses Enzym ist ein Substrat, das die Demethylierung von Homocystein und dessen Umwandlung in Methionin bewirkt, eine essentielle Aminosäure, die Bestandteil vieler Protein- und Peptidsubstanzen ist.
- Enzym N5 Methylentetrahydrofolat. Es handelt sich um eine B6 abhängige Form der Pathologie, die bei Vitamin-B6-Mangel auftritt . Die Einführung eines Vitaminpräparats in den Körper ermöglicht eine Verbesserung des Zustands des Patienten.
- Homocystein-Transmethylase-Enzym. Entwickelt sich vor dem Hintergrund von Stoffwechselstörungen von Cobalamin – Vitamin B 12.
Risikofaktoren
Arachnodaktylie ist eine genetisch bedingte Erkrankung, die durch systemische Bindegewebsschäden gekennzeichnet ist. Die Pathologie ist mit Veränderungen im Fibrillin-1-Gen verbunden, das auf dem kurzen Arm des Chromosoms 15 im Locus 21.1 lokalisiert ist.
Die Arachnodaktylie wird autosomal-dominant vererbt, mit hoher Penetranz und variabler Expressivität. Die Erkrankung kann sowohl auf der männlichen als auch auf der weiblichen Seite auftreten.
Pathogenese
Mehr als 50 % der menschlichen Körpermasse bestehen aus Bindegewebsstrukturen, insbesondere Skelett, Haut, Gefäßnetz, Lymphe und Blut.
Bindegewebszellen werden durch Fibroblasten und ihre Untertypen repräsentiert: Osteoblasten, Chondrozyten, Keratoblasten, Odontoblasten sowie Makrophagen und Mastzellen.
Embryonales Bindegewebe ist das Material für die Bildung konstitutioneller, genetischer und epigenetischer Komponenten. Bindegewebserkrankungen wirken sich in unterschiedlichem Ausmaß auf den gesamten Körper, seine Funktionsfähigkeit und Konstitution aus.
Bei der Arachnodaktylie kommt es zu einem Nukleotidaustausch im Gen, das Strukturinformationen zum Peptid Fibrillin-1 enthält. Diese Eiweißsubstanz gehört zur Gruppe der Glykoproteine, ist am mikrofibrillären System beteiligt und bildet die Grundlage der elastischen Fibrillen des Bindegewebes.
Die stabile Struktur des Gewebes wird durch die interzelluläre Matrix gewährleistet, die zahlreiche Wachstumsfaktoren enthält, die für eine systematische Zellerneuerung sorgen. Große Gefäße und Bänder enthalten zahlreiche Elastinfibrillen, deren Schädigung die Hauptsymptome der Arachnodaktylie verursacht.
Der transformierende Wachstumsfaktor β wird erheblich geschädigt: Seine inaktive Form wird nicht gebunden, was zu einer Erhöhung der biologischen Aktivität dieses Faktors führt.
Fibrilläre Störungen führen zu einer abnormalen Faserbildung, was zu einem Verlust der Festigkeit und Elastizität der Haut und anderer Bindegewebsstrukturen führt.
Wenn die Kollagenstruktur zerstört wird, wird auch die primäre Verbindung der Hämostase zerstört.
Experten weisen auf die Beteiligung hormoneller Ungleichgewichte an der Entstehung und dem Fortschreiten von Anomalien in Bindegewebsstrukturen, einschließlich Arachnodaktylie, hin. Thrombotische Symptome werden durch rheologische Störungen verursacht – insbesondere durch Veränderungen der Blutviskosität in den veränderten Gefäßen der Brachiozephalie.
Der Verdauungstrakt ist aufgrund von Kollagenstörungen betroffen: Es werden hypomotorische Gallendyskinesien, Hernien der Speiseröhrenöffnung des Zwerchfells, hepatobiliäre Anomalien, eine chronische Form der „gelöschten“ Gastroduodenitis und Dolichosigma beobachtet.
Wie wird Arachnodaktylie vererbt?
Arachnodaktylie wird autosomal-dominant vererbt, kann aber auch durch spontane Mutationen entstehen. Das heißt, die Krankheit muss nicht unbedingt bei einem nahen Verwandten – zum Beispiel bei Eltern oder Großeltern – auftreten. Die der Krankheit zugrunde liegenden Mutationen können zufällig auftreten.
Symptome Arachnodaktylie
In der Medizin unterscheidet man zwischen latenter und manifester Arachnodaktylie. Bei der latenten Arachnodaktylie sind zwar Veränderungen vorhanden, diese sind jedoch isoliert und auf ein oder zwei Organsysteme beschränkt. Die manifeste Arachnodaktylie manifestiert sich in mehreren sichtbaren Störungen mit unterschiedlicher Symptomintensität. Dabei kann der Zustand des Patienten über Jahrzehnte relativ stabil sein oder sich stetig weiterentwickeln und sich in anderen Organen und Systemen manifestieren.
Oftmals kann das Arachnodaktylie-Syndrom bereits in den ersten Tagen nach der Geburt des Babys festgestellt werden.
Das wichtigste äußere Zeichen der Arachnodaktylie sind dünne und verlängerte Finger, die aufgrund kurzer Sehnen eine typische Krümmung annehmen und Spinnenbeinen ähneln.
Spinnenfinger oder Arachnodaktylie sind fast schon im Neugeborenenalter deutlich sichtbar. Im Alter von etwa drei Jahren wird das Symptom jedoch deutlicher.
Auch Wachstumsindikatoren sind charakteristisch: Kinder sind meist groß, Unterarme und Schienbeine lang, Gliedmaßen unproportional und dünn. Besonders deutlich wird das Missverhältnis in der hohen Lage der Taille und der Kniescheiben. [ 7 ]
Zu den weiteren Skeletterkrankungen zählen:
- verschmälerte und verlängerte Schädelform (dolichozephal) mit abnorm geformter Gesichtspartie;
- trichterförmige Konfiguration der Brust (der sogenannte "Vogel");
- gekrümmte Wirbelsäule;
- angeborene Hüftluxationen;
- gewohnheitsmäßige Knie-Schulter-Verrenkungen;
- Krümmung des Fersenbeins;
- Osteophytenbildungen – Knochenwucherungen;
- Plattfüße;
- unzureichende Entwicklung der Fettschicht.
Weitere Anzeichen einer Arachnodaktylie können sein:
- Kurzsichtigkeit;
- bläuliche Sklera;
- Subluxation der Linse;
- Erkrankungen des Herzens und der Blutgefäße (Herzfehler, Aortenaneurysma);
- ausgeprägte Dünnheit;
- Gelenkhypermobilität;
- "gewölbter" Himmel.
Charakteristisch für die Arachnodaktylie sind verlängerte Röhrenknochen, die verschiedene Skelettkrümmungen verursachen. Darüber hinaus leiden viele Patienten unter Pyramidenstörungen, Asymmetrie der Sehnenreflexe, Anosokorie und Nystagmus vor dem Hintergrund einer normalen geistigen Entwicklung.
Wenn es sich um eine Arachnodaktylie handelt, die mit einer Homocystinurie einhergeht, können beim Patienten folgende Symptome auftreten:
- periodische Krampfanfälle;
- sekundäres Glaukom mit Linsensubluxation;
- Netzhautablösung, Astigmatismus;
- Schäden an Arterienstämmen (einschließlich Nieren, Gehirn);
- Osteoporose;
- Thrombose;
- geistige Behinderung.
Arachnodaktylie bei Neugeborenen
In den meisten Fällen kann Arachnodaktylie bei einem Kind innerhalb der ersten Lebenstage festgestellt werden. Mit zunehmendem Alter verschlimmern sich die Symptome jedoch tendenziell.
Die ersten Anzeichen, die einen Verdacht auf die Erkrankung zulassen, sind meist folgende:
- ungewöhnlich lange Gliedmaßen und Finger;
- Untergewicht bei ausreichender körperlicher Verfassung des Kindes;
- längliches, langes Gesicht;
- Mangel an Körperfett, schlecht entwickelte Muskeln;
- übermäßige Gelenkflexibilität.
Ab einem Alter von etwa vier Jahren kommt es vor dem Hintergrund der Arachnodaktylie zu Veränderungen im Brustkorb, einer Krümmung der Wirbelsäule und der Entwicklung von Plattfüßen.
An den Sehorganen treten Myopie, Linsenektopie, veränderte Hornhautkonfiguration, Strabismus sowie hypoplastische Prozesse in Iris und Netzhaut auf. Solche Störungen können bereits in den ersten zwei bis drei Lebensjahren eines Kindes auftreten, schreiten jedoch im Laufe der Jahre fort.
Die größte Gefahr geht von Erkrankungen des Herz-Kreislauf-Systems aus. Liegen solche Erkrankungen vor, besteht ohne entsprechende Behandlung bereits im Kindesalter ein hohes Sterberisiko für den Patienten. Zu den besonders gefährlichen Erkrankungen zählen Schäden an den Gefäßwänden, Herzfehlbildungen und Defekte der Herzkranzgefäße. Manchmal wird bei Kindern im ersten Lebensjahr bereits eine zunehmende Herzinsuffizienz festgestellt.
Arachnodaktylie kann mit Schäden an anderen Organen einhergehen, insbesondere am Nervensystem, den Bronchien und Lungen, der Haut und dem Urogenitalsystem. Solche Störungen werden im Rahmen diagnostischer Verfahren erkannt.
Komplikationen und Konsequenzen
Die häufigsten Nebenwirkungen der Arachnodaktylie sind Schädigungen des Herzens und der Atmungsorgane. Darüber hinaus treten Sehstörungen bis hin zum Verlust des Sehvermögens auf.
Patienten mit Arachnodaktylie benötigen eine komplexe Therapie aller bestehenden Pathologien. Wird eine solche Behandlung nicht durchgeführt, verkürzt sich die Lebenserwartung der Patienten erheblich: Seltene Patienten erreichen ohne medizinische Intervention das 40. Lebensjahr. Im Laufe der Jahre verschlimmern sich die Probleme des Herz-Kreislauf-Systems, das Risiko ausgedehnter Blutungen mit tragischem Ausgang steigt.
Menschen, die an Arachnodaktylie leiden, sollten sich regelmäßig untersuchen lassen und Begleiterkrankungen behandeln lassen: Nur unter dieser Voraussetzung haben sie alle Chancen auf ein langes Leben ohne schwerwiegende Komplikationen.
Das Marfan-Syndrom und die Arachnodaktylie erfordern besondere Aufmerksamkeit, wenn die Patientin schwanger wird. In einer solchen Situation ist es wichtig, die Patientin regelmäßig und gründlich zu untersuchen und ihr Herz-Kreislauf-System medizinisch zu unterstützen. Nur so können eine erfolgreiche Schwangerschaft und eine sichere Geburt des Kindes gewährleistet werden.
Um Nebenwirkungen zu vermeiden, sollten Patienten mit Arachnodaktylie regelmäßig von Ärzten untersucht werden, um die Entwicklung von Herz-Kreislauf- und Muskel-Skelett-Erkrankungen zu verhindern. Ihnen wird empfohlen, einen ausschließlich gesunden Lebensstil mit mäßiger körperlicher Aktivität zu führen.
Diagnose Arachnodaktylie
Die klinische Diagnostik der Arachnodaktylie umfasst die Erhebung von Beschwerden, die Familienanamnese, die Beurteilung des Phänotyps sowie anthropometrische und körperliche Untersuchungen. Es ist wichtig, das Vorhandensein von Manifestationen von Bindegewebserkrankungen bei direkten Verwandten festzustellen. Zu diesem Zweck wird eine genealogische Studie durchgeführt. [ 8 ]
Die Labordiagnostik der Arachnodaktylie umfasst die Untersuchung des Zustands bestimmter Bindegewebsarten, die durch Knochen- und Knorpelgewebe, Blut und Lymphe repräsentiert werden. Am aussagekräftigsten ist die Untersuchung der Oxyprolin- und Glykosaminoglykanspiegel im täglichen Urinvolumen. Zusätzlich wird der Gehalt an Lysin, Prolin und Oxyprolin im Blut bestimmt. Um veränderte Verhältnisse verschiedener Kollagentypen und strukturelle Anomalien der Kollagenfasern zu bestimmen, wird eine Typisierung mittels indirekter Immunfluoreszenz unter Verwendung polyklonaler Antikörper gegen Kollagen und Fibronektin vorgeschrieben. [ 9 ] Abhängig von den Indikationen werden folgende Tests durchgeführt, um die Qualität der Stoffwechselprozesse im Bindegewebe zu beurteilen:
- Glykosaminoglykane, Fibrillin, Fibronektin;
- Untersuchung von Hydroxyprolin, Markern der Biosynthese von Kollagen Typ 1, aminoterminalen Propeptiden von Prokollagen Typ 1, Markern des Abbaus von Kollagen Typ 1, Galactosyloxylysin, Desoxypyridinolin;
- Analyse der Regulierung des Kollagenstoffwechsels (Untersuchung von Matrix-Metalloproteinasen und Gewebeinhibitoren von Matrix-Metalloproteinasen, transformierender Wachstumsfaktor);
- Analyse von Mikro- und Makroelementen (Gehalt an Calcium und Magnesium, Phosphor, Eisen, Schwefel und Kupfer, Kobalt und Selen, Zink und Mangan, Fluor und Vanadium, Silizium und Bor);
- Untersuchung von Markern der Knochengewebebildung und der Geschwindigkeit von Umbauprozessen (Analyse des Gehalts an Osteocalcin, alkalischer Knochenphosphatase, Parathormon, somatotropem Hormon, Prolaktin, Vitamin D3 , Pentosidin, Homocystein in Urin und Blut).
Die instrumentelle Diagnostik zielt darauf ab, bestehende Entwicklungsstörungen zu identifizieren und den Funktionszustand von Organen und Systemen zu beurteilen. Herz-Kreislauf-Erkrankungen bei Arachnodaktylie erfordern die obligatorische Aufnahme in die diagnostische Liste solcher Verfahren wie:
- Elektrokardiographie;
- 24-Stunden-EKG-Überwachung;
- Ultraschalluntersuchung des Herzens und der Blutgefäße.
Gefäßanomalien werden mittels Computertomographie oder Magnetresonanztomographie untersucht. Weitere diagnostische Verfahren können sein:
- Ultraschall der Bauchorgane, des Urogenitalsystems;
- Röntgen der Brustorgane, Hüftgelenke; [ 10 ]
- CT oder MRT der Wirbelsäule.
Nach allen notwendigen Tests wird der Patient zur genetischen Beratung überwiesen.
Differenzialdiagnose
Es besteht eine phänotypische Ähnlichkeit zwischen dem Beals-Syndrom und der Arachnodaktylie beim Marfan-Syndrom (Mutationen der Gene FBN2 bzw. FBN1), die auf die fast vollständige Identität der Eiweißstoffe Fibrillin 1 und Fibrillin 2 zurückzuführen ist. Es ist nicht überraschend, dass der zweite Name des Beals-Syndroms Kontraktur-Arachnodaktylie lautet. [ 11 ]
Eine Differenzierung erfolgt auch bei anderen Bindegewebserkrankungen:
- Stickler-Syndrom;
- Ehlers-Danlos-Syndrom;
- Homocystinurie;
- Arthrogrypose.
Das Beals-Syndrom ist gekennzeichnet durch einen marfanoiden Phänotyp, angeborene Beugekontrakturen großer und kleiner Gelenke, Arachnodaktylie an Handgelenk und Fuß, eine Verkrümmung der Wirbelsäule und eine abnorme Ohrform (sogenannte „zerknitterte“ Ohrmuscheln). Zur Bestätigung der Diagnose wird eine molekulare Analyse des FBN2-Gens durchgeführt.
Die Arthrogrypose ist durch multiple Gelenkkontrakturen, Kleinwuchs und verminderte Intelligenz gekennzeichnet. Die Form der Finger und Ohren ist unauffällig. [ 12 ]
Das Ehlers-Danlos-Syndrom ist gekennzeichnet durch Kyphoskoliose, trichterförmige Krümmung des Brustkorbs, ausgeprägte Plattfüße und eine beeinträchtigte Refraktion. Typisch sind erhöhte Beweglichkeit und Gelenkverrenkungen sowie hohe Dehnbarkeit und Empfindlichkeit der Haut.
Das Stickler-Syndrom ist durch Veränderungen des Gelenkvolumens und der Gelenksteifheit gekennzeichnet.
Wen kann ich kontaktieren?
Behandlung Arachnodaktylie
Arachnodaktylie ist eine genetische Erkrankung, und die Medizin verfügt derzeit nicht über Methoden zur Korrektur von Gendefekten. Daher zielt die Behandlung darauf ab, den Zustand des Patienten zu optimieren, eine Verschlimmerung der Erkrankung zu verhindern und symptomatische Manifestationen zu beseitigen. Je nach Art der ausgeprägtesten Symptome wird eine komplexe Therapie verordnet, an der mehrere Fachärzte gleichzeitig beteiligt sind: Oft ist zusätzlich die Hinzuziehung eines Orthopäden, Kardiologen, Augenarztes, Gastroenterologen und anderer Fachärzte erforderlich. [ 13 ]
Zu den Empfehlungen für die klinische Behandlung von Patienten zählen die folgenden allgemeinen Grundsätze:
- Einschränkung der körperlichen Aktivität, aber nicht völlige Beseitigung (als Teil der Unterstützung des Herz-Kreislauf-Systems);
- medikamentöse Therapie;
- bei Bedarf – chirurgische Korrektur der am stärksten betroffenen Bereiche des Herzens und der Blutgefäße;
- orthopädische Korrektur;
- Kurbehandlung, Physiotherapie, Heilgymnastik.
Die Ernährung von Patienten mit Arachnodaktylie sollte eine ausreichende Menge an proteinreichen Produkten enthalten, die mit Spurenelementen, Vitaminen und Fettsäuren angereichert sind. Es wird empfohlen, Fleisch, Fisch, Meeresfrüchte, Bohnen und Nüsse zu essen. Wenn die Arachnodaktylie durch Homocystinurie verursacht wird, ist der Verzehr von tierischem Eiweiß stark eingeschränkt.
Kindern mit schlanker Statur und großer Statur wird empfohlen, schon früh Baumwollsamen- und Sojaöl, Sonnenblumenkerne, Schweinefett und Schmalz in ihre Ernährung aufzunehmen. Zusätzlich bieten sie Präparate mit mehrfach ungesättigten Fettsäuren wie Omega an, die die Produktion des somatotropen Hormons hemmen.
Zur Normalisierung des Eiweißstoffwechsels werden Vitamine der B-Gruppe verschrieben, die auch aus Lebensmitteln gewonnen werden können: Buchweizen, Erbsen, Leber.
Es ist sehr wichtig, dass Ascorbinsäure mit der Nahrung in den Körper des Patienten gelangt. Zu diesem Zweck sind Hagebuttenaufguss, Paprika, Kohl, Zitrusfrüchte sowie Sanddorn und Lauch unbedingt in die Ernährung aufgenommen.
Bei Bedarf wird den Patienten eine orthopädische Korrektur angeboten, die notwendig ist, um die Belastung der Wirbelsäule und der Gelenke zu reduzieren. Zu diesem Zweck werden orthopädische Schuhe, Knie- und andere Geräte, Einlegesohlen und elastische Bandagen verwendet.
Die chirurgische Behandlung erfolgt je nach Indikation.
Medikamente
Die medikamentöse Behandlung der Arachnodaktylie erfolgt 1-2 Mal pro Jahr, abhängig vom Zustand des Patienten und der Schwere der pathologischen Symptome. Die Dauer des Behandlungsverlaufs wird individuell festgelegt und beträgt durchschnittlich 4 Monate. [ 14 ]
Zur Stimulierung der Kollagenbildung werden folgende Medikamente verschrieben: Piaskledin 300, L-Lysin oder L-Prolin in Kombination mit komplexen Multivitaminpräparaten, die Ascorbinsäure, B-Vitamine, Tocopherol, Magnesium, Zink, Selen, Kupfer enthalten.
Unter den Chondroprotektoren sind Chondroitinsulfat und Glucosaminsulfat am besten geeignet – Arzneimittel, die an der Regulierung des Chondrozytenstoffwechsels, der Unterdrückung der Enzymsynthese, der Erhöhung der Empfindlichkeit der Chondrozyten gegenüber enzymatischer Wirkung, der Stimulation anabilistischer Prozesse usw. beteiligt sind. Kombinationsmittel wie Teraflex, Arthroflex, Arthra usw. gelten als optimal.
Der Mineralstoffwechsel wird durch Medikamente stimuliert, die die Phosphor-Kalzium-Prozesse normalisieren. Die Medikamente der Wahl sind oft aktive Formen von Vitamin D: Alpha D 3 – Teva, Oxidevit, Bonviva usw. Gleichzeitig werden Phosphor-, Kalzium- und Magnesiumpräparate verwendet. Während der Behandlung wird etwa alle 20 Tage der Kalzium- und Phosphorspiegel im Blut oder Urin überprüft und ein Bluttest auf alkalische Phosphatase durchgeführt.
Um den bioenergetischen Zustand des Körpers zu verbessern, können Phosphaden, Riboxin, Lecithin, Elkar und Coenzym Q10 verschrieben werden.
Ein ungefähres Behandlungsschema könnte folgendermaßen aussehen:
- Chondroprotektor in der altersgerechten Dosis, eingenommen mit Nahrung und ausreichend Wasser. Die Dauer einer Behandlung beträgt 3-4 Monate.
- L-Prolin in einer Dosierung von 500 mg (für Kinder ab 12 Jahren und Erwachsene) wird sechs Wochen lang 1-2 mal täglich eine halbe Stunde vor den Mahlzeiten eingenommen. Bei Bedarf kann zusätzlich ein Aminosäurekomplex verschrieben werden – L-Prolin, L-Lysin, L-Leucin in einer Menge von 10-12 mg/Kilogramm Körpergewicht. Die Einnahme erfolgt 1-2 mal täglich über zwei Monate.
- Vitamin- und Mineralstoffkomplexpräparate Centrum, Vitrum oder Unicap in altersgerechter Dosierung. Die Einnahmedauer beträgt 4 Wochen.
Dieses Behandlungsschema ist angebracht, wenn ein Patient mit Arachnodaktylie über Probleme mit dem Bewegungsapparat klagt und Testergebnisse bei einer täglichen Urinuntersuchung eine erhöhte Ausscheidung von Glykosaminoglykanen sowie verringerte Werte freier Aminosäuren im Blut anzeigen.
In der Regel wird die Behandlung von den Patienten gut angenommen, ohne dass besondere Nebenwirkungen auftreten. Sollten Überempfindlichkeitsreaktionen festgestellt werden, werden die Medikamente ersetzt und das Behandlungsschema angepasst.
Physiotherapeutische Behandlung
Physiotherapeutische Verfahren bei Arachnodaktylie werden je nach Indikation verordnet. Beispielsweise wird bei unzureichender Osteogenese, zur Verbesserung der Heilung von Knochenbrüchen oder bei Anzeichen einer Osteoporose eine Elektrophorese mit 5 % Calciumchlorid, 4 % Magnesiumsulfat, 2 % Kupfersulfat oder 2 % Zinksulfat empfohlen.
Bei nachgewiesenen vegetativ-vaskulären Störungen kommen 1%iges Natriumcoffeinbenzoat, Ephedrinhydrochlorid oder Mesaton zum Einsatz.
Um die Funktion der Nebennierenrinde zu aktivieren, werden eine medikamentöse Elektrophorese mit 1,5%igem Ethimizol und eine Dezimetertherapie der Nebennierenregion verordnet. [ 15 ]
Um den Tonus der Blutgefäße zu stabilisieren, werden Wasserbehandlungen empfohlen, die die Gefäßgymnastik fördern. Bäder wie Kohlendioxid-, Kiefer-, Chlorwasserstoff-, Schwefelwasserstoff- und Radonbäder sind hervorragend geeignet. Es werden Abreibungen, Übergüsse, Wechselduschen, Schaum- und Salzbäder praktiziert.
Zur Verbesserung des Zustands des Knorpelgewebes werden Magnetfeldtherapie, Induktionstherapie, Lasertherapie und Elektrophorese mit Dimethylsulfoxid (Dimexid) eingesetzt.
Chirurgische Behandlung
Chirurgische Eingriffe bei Arachnodaktylie werden streng nach Indikation verordnet. Beispielsweise werden bei schweren hämodynamischen Störungen vor dem Hintergrund eines Klappensegelprolaps, eines massiven Aortenaneurysmas, eines Klappenersatzes und eines beschädigten Aortensegments durchgeführt. [ 16 ]
Liegen ausgeprägte Funktionsstörungen der Atmungs- und Herz-Kreislaufsysteme vor, die infolge einer starken Brustkorbverkrümmung entstehen, wird eine Thorakoplastik durchgeführt.
Bei einem progressiven Schmerzsyndrom, das durch eine schwere Skoliose von 3–4 Grad verursacht wird, ist ebenfalls ein chirurgischer Eingriff angezeigt. Aus ophthalmologischer Sicht sind eine Linsensubluxation, die durch ein sekundäres Glaukom kompliziert ist, sowie Katarakte und degenerative Veränderungen der Netzhaut mit hohem Ablösungsrisiko absolute Indikationen für eine Linsenentfernung.
Jede Operation bei Patienten mit Arachnodaktylie und anderen Erkrankungen des Bindegewebes wird erst durchgeführt, wenn eine relative klinische und biochemische Linderung erreicht ist. Nach dem Eingriff sind eine langfristige medizinische Überwachung und eine intensive Therapie mit Medikamenten zur Verbesserung des Bindegewebsstoffwechsels unerlässlich.
Verhütung
Arachnodaktylie ist eine seltene genetische Erkrankung. Manchmal tritt sie spontan bei scheinbar gesunden Eltern auf. Daher ist es sehr, sehr schwierig, der Krankheit im Voraus vorzubeugen.
Wenn einer der potenziellen Elternteile eine belastete Familienanamnese hat – das heißt, es ist bekannt, dass jemand in der Familie an Arachnodaktylie litt –, sollten die Ehepartner im Stadium der Kinderplanung einen Genetiker aufsuchen und sich einer genetischen Untersuchung unterziehen. Nach Bestätigung der Schwangerschaft führt der Arzt eine pränatale Diagnostik durch, die eine Ultraschalluntersuchung des Fötus und eine Reihe biochemischer Tests umfasst:
- mütterlicher Bluttest;
- Fruchtwasseranalyse;
- Chorionzottenbiopsie;
- Analyse von Plazentazellen und Nabelschnurblut.
Patienten mit Arachnodaktylie stehen lebenslang unter ärztlicher Aufsicht. Präventive Maßnahmen zielen darauf ab, Komplikationen vorzubeugen. Zu diesem Zweck wird eine herzchirurgische Korrektur durchgeführt und eine medikamentöse Behandlung verordnet, um das Risiko einer Thrombusbildung auszuschließen. Regelmäßig werden Antibiotikatherapien durchgeführt.
Prognose
Die Lebensprognose von Patienten mit Arachnodaktylie wird in erster Linie durch die Schwere der Begleiterkrankungen bestimmt – insbesondere Erkrankungen des Herz-Kreislauf-Systems, des Bewegungsapparates und der Sehorgane. Am häufigsten wird die Pathologie durch eine Ruptur und Dissektion der Aorta kompliziert. Dies muss berücksichtigt und eine rechtzeitige herzchirurgische Korrektur durchgeführt werden, die dazu beiträgt, das Leben des Patienten zu verlängern und seine Lebensqualität zu verbessern.
Wenn die Diagnose rechtzeitig gestellt wurde und die Empfehlungen des Arztes befolgt werden, kann die Prognose als bedingt günstig bezeichnet werden. Medizinische Unterstützung lindert den Verlauf der Arachnodaktylie erheblich und die Patienten haben die Möglichkeit, ein normales und relativ erfülltes Leben zu führen, ohne ernsthafte Komplikationen zu entwickeln.

