Facharzt des Artikels
Neue Veröffentlichungen
Synthese, Sekretion und Metabolismus von Katecholaminen
Zuletzt überprüft: 06.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Das Nebennierenmark produziert Verbindungen, deren Struktur weit von Steroiden entfernt ist. Sie enthalten einen 3,4-Dihydroxyphenylkern (Catechol) und werden als Katecholamine bezeichnet. Dazu gehören Adrenalin, Noradrenalin und Dopamin-Beta-Hydroxytyramin.
Der Ablauf der Katecholaminsynthese ist recht einfach: Tyrosin → Dihydroxyphenylalanin (DOPA) → Dopamin → Noradrenalin → Adrenalin. Tyrosin gelangt mit der Nahrung in den Körper, kann aber auch in der Leber unter Einwirkung der Phenylalaninhydroxylase aus Phenylalanin gebildet werden. Die Endprodukte der Tyrosinumwandlung in Geweben sind unterschiedlich. Im Nebennierenmark gelangt der Prozess zur Adrenalinbildung, in den Endigungen der sympathischen Nerven – Noradrenalin – und in einigen Neuronen des Zentralnervensystems endet die Katecholaminsynthese mit der Bildung von Dopamin.
Die Umwandlung von Tyrosin in DOPA wird durch Tyrosinhydroxylase katalysiert, deren Cofaktoren Tetrahydrobiopterin und Sauerstoff sind. Es wird angenommen, dass dieses Enzym die Geschwindigkeit des gesamten Prozesses der Katecholaminbiosynthese begrenzt und durch die Endprodukte des Prozesses gehemmt wird. Tyrosinhydroxylase ist das Hauptziel regulatorischer Effekte auf die Katecholaminbiosynthese.
Die Umwandlung von DOPA in Dopamin wird durch das Enzym DOPA-Decarboxylase (Cofaktor - Pyridoxalphosphat) katalysiert, das relativ unspezifisch ist und andere aromatische L-Aminosäuren decarboxyliert. Es gibt jedoch Hinweise auf die Möglichkeit, die Synthese von Katecholaminen durch Veränderung der Aktivität dieses Enzyms zu modifizieren. Einigen Neuronen fehlen Enzyme für die weitere Umwandlung von Dopamin, und es ist das Endprodukt. Andere Gewebe enthalten Dopamin-Beta-Hydroxylase (Cofaktoren - Kupfer, Ascorbinsäure und Sauerstoff), die Dopamin in Noradrenalin umwandelt. Im Nebennierenmark (aber nicht in den Enden der sympathischen Nerven) ist Phenylethanolamin vorhanden - eine Methyltransferase, die aus Noradrenalin Adrenalin bildet. In diesem Fall dient S-Adenosylmethionin als Spender von Methylgruppen.
Es ist wichtig zu bedenken, dass die Synthese der Phenylethanolamin-N-Methyltransferase durch Glukokortikoide induziert wird, die über das portale Venensystem aus der Rinde in das Mark gelangen. Dies könnte die Tatsache erklären, dass zwei verschiedene endokrine Drüsen in einem Organ vereint sind. Die Bedeutung von Glukokortikoiden für die Adrenalinsynthese wird dadurch unterstrichen, dass die noradrenalinproduzierenden Zellen des Nebennierenmarks in der Nähe der arteriellen Gefäße liegen, während die adrenalinproduzierenden Zellen hauptsächlich aus den venösen Sinus in der Nebennierenrinde mit Blut versorgt werden.
Der Abbau von Katecholaminen erfolgt hauptsächlich unter dem Einfluss zweier Enzymsysteme: Catechol-O-Methyltransferase (COMT) und Monoaminooxidase (MAO). Die Hauptwege des Adrenalin- und Noradrenalinabbaus sind in Abb. 54 schematisch dargestellt. Unter dem Einfluss von COMT in Gegenwart des Methylgruppenspenders S-Adrenosylmethionin werden Katecholamine in Normetanephrin und Metanephrin (3-O-Methylderivate von Noradrenalin und Adrenalin) umgewandelt, die unter dem Einfluss von MAO in Aldehyde und dann (in Gegenwart von Aldehydoxidase) in Vanillinmandelsäure (VMA), das Hauptabbauprodukt von Noradrenalin und Adrenalin, umgewandelt werden. Im gleichen Fall werden Katecholaminen, wenn sie zunächst MAO statt COMT ausgesetzt sind, in 3,4-Dioxomandelaminaldehyd und dann unter dem Einfluss von Aldehydoxidase und COMT in 3,4-Dioxomandelaminsäure und VMC umgewandelt. In Gegenwart von Alkoholdehydrogenase kann aus Katecholaminen 3-Methoxy-4-oxyphenylglykol entstehen, das Hauptendprodukt des Adrenalin- und Noradrenalinabbaus im ZNS.
Der Abbau von Dopamin verläuft ähnlich, mit der Ausnahme, dass seinen Metaboliten die Hydroxygruppe am Beta-Kohlenstoffatom fehlt und daher anstelle von Vanillinmandelsäure Homovanillinsäure (HVA) oder 3-Methoxy-4-hydroxyphenylessigsäure entsteht.
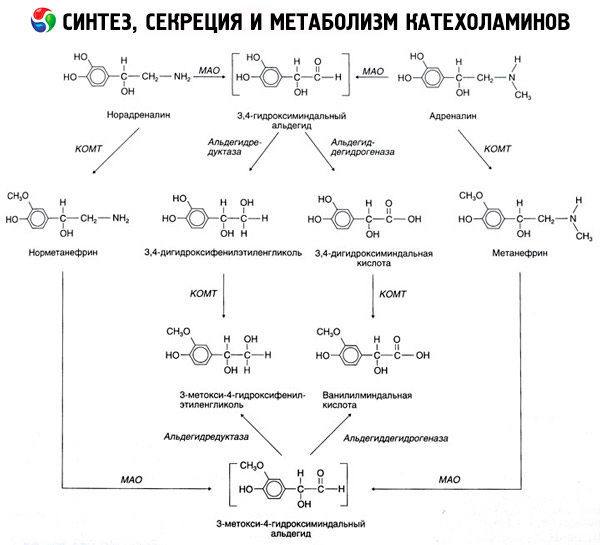
Darüber hinaus wird die Existenz eines chinoiden Oxidationsweges des Katecholaminmoleküls postuliert, der Zwischenprodukte mit ausgeprägter biologischer Aktivität erzeugen kann.
Noradrenalin und Adrenalin, die unter der Einwirkung zytosolischer Enzyme in den sympathischen Nervenendigungen und im Nebennierenmark gebildet werden, gelangen in die sekretorischen Granula, die sie vor der Einwirkung von Abbauenzymen schützen. Die Aufnahme von Katecholaminen durch Granula erfordert Energieaufwand. In den chromaffinen Granula des Nebennierenmarks sind Katecholamine fest an ATP (im Verhältnis 4:1) und spezifische Proteine – Chromogranine – gebunden, was die Diffusion von Hormonen aus den Granula ins Zytoplasma verhindert.
Der direkte Reiz für die Katecholaminsekretion ist offenbar das Eindringen von Kalzium in die Zelle, wodurch die Exozytose (Verschmelzung der Granulamembran mit der Zelloberfläche und deren Bruch mit der vollständigen Freisetzung löslicher Inhaltsstoffe – Katecholaminen, Dopamin-Beta-Hydroxylase, ATP und Chromograninen – in die extrazelluläre Flüssigkeit) stimuliert wird.
Physiologische Wirkungen von Katecholaminen und ihr Wirkungsmechanismus
Die Wirkung von Katecholaminen beginnt mit der Interaktion mit spezifischen Rezeptoren der Zielzellen. Während Rezeptoren für Schilddrüsen- und Steroidhormone im Zellinneren lokalisiert sind, befinden sich Rezeptoren für Katecholamin (sowie für Acetylcholin und Peptidhormone) auf der äußeren Zelloberfläche.
Es ist seit langem bekannt, dass Adrenalin oder Noradrenalin bei manchen Reaktionen wirksamer sind als das synthetische Katecholamin Isoproterenol, bei anderen hingegen ist die Wirkung von Isoproterenol stärker als die von Adrenalin oder Noradrenalin. Auf dieser Grundlage wurde die Theorie entwickelt, dass Gewebe zwei Arten von Adrenorezeptoren haben: Alpha- und Beta-Rezeptoren, und in manchen Geweben kann nur einer der beiden Typen vorhanden sein. Isoproterenol ist der stärkste Agonist der Beta-Adrenorezeptoren, während die synthetische Verbindung Phenylephrin der stärkste Agonist der Alpha-Adrenorezeptoren ist. Natürliche Katecholamine – Adrenalin und Noradrenalin – können mit Rezeptoren beider Typen interagieren, aber Adrenalin hat eine größere Affinität zu Beta- und Noradrenalin zu Alpha-Rezeptoren.
Katecholamine aktivieren kardiale Beta-adrenerge Rezeptoren stärker als Beta-Rezeptoren der glatten Muskulatur, wodurch der Beta-Typ in Untertypen unterteilt werden konnte: Beta1-Rezeptoren (Herz, Fettzellen) und Beta2-Rezeptoren (Bronchien, Blutgefäße usw.). Die Wirkung von Isoproterenol auf Beta1-Rezeptoren übertrifft die Wirkung von Adrenalin und Noradrenalin nur um das Zehnfache, während es auf Beta2-Rezeptoren 100-1000-mal stärker wirkt als natürliche Katecholamine.
Die Verwendung spezifischer Antagonisten (Phentolamin und Phenoxybenzamin für Alpha- und Propranolol für Beta-Rezeptoren) bestätigte die Angemessenheit der Klassifizierung von Adrenorezeptoren. Dopamin kann sowohl mit Alpha- als auch mit Beta-Rezeptoren interagieren, aber verschiedene Gewebe (Gehirn, Hypophyse, Gefäße) haben auch ihre eigenen dopaminergen Rezeptoren, deren spezifischer Blocker Haloperidol ist. Die Anzahl der Beta-Rezeptoren variiert zwischen 1000 und 2000 pro Zelle. Die biologischen Wirkungen von Katecholaminen, die durch Beta-Rezeptoren vermittelt werden, sind üblicherweise mit der Aktivierung der Adenylatcyclase und einer Erhöhung des intrazellulären Gehalts an cAMP verbunden. Obwohl der Rezeptor und das Enzym funktionell verbunden sind, handelt es sich um unterschiedliche Makromoleküle. Guanosintriphosphat (GTP) und andere Purinnukleotide sind an der Modulation der Adenylatcyclase-Aktivität unter dem Einfluss des Hormon-Rezeptor-Komplexes beteiligt. Durch die Erhöhung der Enzymaktivität scheinen sie die Affinität der Beta-Rezeptoren für Agonisten zu verringern.
Das Phänomen der erhöhten Empfindlichkeit denervierter Strukturen ist seit langem bekannt. Im Gegenteil, eine längere Exposition gegenüber Agonisten verringert die Empfindlichkeit der Zielgewebe. Die Untersuchung von Beta-Rezeptoren hat es ermöglicht, diese Phänomene zu erklären. Es wurde gezeigt, dass eine längere Exposition gegenüber Isoproterenol aufgrund einer Abnahme der Anzahl der Beta-Rezeptoren zu einem Empfindlichkeitsverlust der Adenylatcyclase führt.
Der Desensibilisierungsprozess erfordert keine Aktivierung der Proteinsynthese und beruht wahrscheinlich auf der allmählichen Bildung irreversibler Hormon-Rezeptor-Komplexe. Im Gegenteil, die Einführung von 6-Oxidopamin, das sympathische Endungen zerstört, geht mit einer Zunahme der reagierenden Beta-Rezeptoren im Gewebe einher. Es ist möglich, dass eine Zunahme der sympathischen Nervenaktivität auch eine altersbedingte Desensibilisierung von Blutgefäßen und Fettgewebe gegenüber Katecholaminen verursacht.
Die Anzahl der Adrenorezeptoren in verschiedenen Organen kann durch andere Hormone gesteuert werden. So erhöht Östradiol die Anzahl der Alpha-Adrenorezeptoren in der Gebärmutter, während Progesteron sie verringert, was mit einer entsprechenden Zunahme und Abnahme ihrer kontraktilen Reaktion auf Katecholamine einhergeht. Wenn der intrazelluläre „Second Messenger“, der durch die Wirkung von Beta-Rezeptor-Agonisten gebildet wird, sicherlich cAMP ist, dann ist die Situation hinsichtlich des Transmitters alpha-adrenerger Effekte komplizierter. Es wird die Existenz verschiedener Mechanismen angenommen: eine Abnahme des cAMP-Spiegels, eine Zunahme des cAMP-Gehalts, eine Modulation der zellulären Calciumdynamik usw.
Um verschiedene Wirkungen im Körper zu reproduzieren, sind üblicherweise 5-10 mal geringere Dosen von Adrenalin erforderlich als Noradrenalin. Obwohl letzteres in Bezug auf α- und β1-Adrenorezeptoren wirksamer ist, darf nicht vergessen werden, dass beide endogenen Katecholamine sowohl mit α- als auch mit β-Rezeptoren interagieren können. Daher hängt die biologische Reaktion eines bestimmten Organs auf eine adrenerge Aktivierung weitgehend von der Art der darin vorhandenen Rezeptoren ab. Dies bedeutet jedoch nicht, dass eine selektive Aktivierung des nervösen oder humoralen Bindeglieds des sympathisch-nebennierenrindischen Systems unmöglich ist. In den meisten Fällen ist eine erhöhte Aktivität seiner verschiedenen Bindeglieder zu beobachten. So ist es allgemein anerkannt, dass Hypoglykämie das Nebennierenmark reflexartig aktiviert, während ein Blutdruckabfall (orthopädische Hypotonie) hauptsächlich mit der Freisetzung von Noradrenalin aus den Enden der sympathischen Nerven einhergeht.
Adrenorezeptoren und die Auswirkungen ihrer Aktivierung in verschiedenen Geweben
System, Organ |
Adrenerger Rezeptortyp |
Reaktion |
Herz-Kreislauf-System: |
||
Herz |
Beta |
Erhöhte Herzfrequenz, Leitfähigkeit und Kontraktilität |
Arteriolen: |
||
Haut und Schleimhäute |
Alpha |
Reduktion |
Skelettmuskulatur |
Beta |
Expansion Kontraktion |
Bauchorgane |
Alpha (mehr) |
Reduktion |
Beta |
Verlängerung |
|
Venen |
Alpha |
Reduktion |
Atmungssystem: |
||
Muskeln der Bronchien |
Beta |
Verlängerung |
Verdauungssystem: |
||
Magen |
Beta |
Verminderte motorische Fähigkeiten |
Darm |
Alpha |
Kontraktion der Schließmuskeln |
Milz |
Alpha |
Reduktion |
Beta |
Entspannung |
|
Exokrine Bauchspeicheldrüse |
Alpha |
Verminderte Sekretion |
Urogenitalsystem: |
Alpha |
Schließmuskelkontraktion |
Blase |
Beta |
Entspannung des Auswerfermuskels |
Männliche Genitalien |
Alpha |
Ejakulation |
Augen |
Alpha |
Pupillenerweiterung |
Leder |
Alpha |
Vermehrtes Schwitzen |
Speicheldrüsen |
Alpha |
Ausscheidung von Kalium und Wasser |
Beta |
Amylasesekretion |
|
Endokrine Drüsen: |
||
Inseln der Bauchspeicheldrüse |
||
Betazellen |
Alpha (mehr) |
Verminderte Insulinsekretion |
Beta |
Erhöhte Insulinsekretion |
|
Alpha-Zellen |
Beta |
Erhöhte Glucagonsekretion |
8 Zellen |
Beta |
Erhöhte Somatostatinsekretion |
Hypothalamus und Hypophyse: |
||
Somatotrophe |
Alpha |
Erhöhte Sekretion von STH |
Beta |
Verminderte Sekretion von STH |
|
Lactotrophe |
Alpha |
Verminderte Prolaktinsekretion |
Thyreotrophe |
Alpha |
Verminderte TSH-Sekretion |
Kortikotrophe |
Alpha |
Erhöhte ACTH-Sekretion |
| Beta | Verminderte ACTH-Sekretion | |
Schilddrüse: |
||
Follikelzellen |
Alpha |
Verminderte Thyroxinsekretion |
Beta |
Erhöhte Thyroxinausschüttung |
|
Parafollikuläre (K) Zellen |
Beta |
Erhöhte Calcitoninsekretion |
Nebenschilddrüsen |
Beta |
Erhöhte Parathormonsekretion |
Nieren |
Beta |
Erhöhte Reninsekretion |
Magen |
Beta |
Erhöhte Gastrinsekretion |
BX |
Beta |
Erhöhter Sauerstoffverbrauch |
Leber |
? |
Erhöhte Glykogenolyse und Gluconeogenese mit der Freisetzung von Glucose; erhöhte Ketogenese mit der Freisetzung von Ketonkörpern |
Fettgewebe |
Beta |
Erhöhte Lipolyse mit der Freisetzung von freien Fettsäuren und Glycerin |
Skelettmuskulatur |
Beta |
Erhöhte Glykolyse mit der Freisetzung von Pyruvat und Laktat; verminderte Proteolyse mit einer Verringerung der Freisetzung von Alanin, Glutamin |
Es ist wichtig zu berücksichtigen, dass die Ergebnisse der intravenösen Verabreichung von Katecholaminen die Wirkungen endogener Verbindungen nicht immer angemessen widerspiegeln. Dies gilt vor allem für Noradrenalin, da es im Körper hauptsächlich nicht ins Blut, sondern direkt in die synaptischen Spalten freigesetzt wird. Daher aktiviert endogenes Noradrenalin beispielsweise nicht nur vaskuläre Alpha-Rezeptoren (erhöhter Blutdruck), sondern auch Beta-Rezeptoren des Herzens (erhöhte Herzfrequenz), während die Einführung von Noradrenalin von außen hauptsächlich zur Aktivierung vaskulärer Alpha-Rezeptoren und einer reflektorischen (über den Vagus) Verlangsamung des Herzschlags führt.
Niedrige Adrenalindosen aktivieren hauptsächlich Beta-Rezeptoren der Muskelgefäße und des Herzens, was zu einer Verringerung des peripheren Gefäßwiderstands und einer Erhöhung des Herzzeitvolumens führt. In einigen Fällen kann der erste Effekt überwiegen und nach der Adrenalingabe entwickelt sich eine Hypotonie. In höheren Dosen aktiviert Adrenalin auch Alpha-Rezeptoren, was mit einer Erhöhung des peripheren Gefäßwiderstands einhergeht und vor dem Hintergrund einer Erhöhung des Herzzeitvolumens zu einem Anstieg des arteriellen Blutdrucks führt. Seine Wirkung auf die vaskulären Beta-Rezeptoren bleibt jedoch erhalten. Infolgedessen übersteigt der Anstieg des systolischen Drucks den ähnlichen Indikator des diastolischen Drucks (Anstieg des Pulsdrucks). Bei Einführung noch höherer Dosen beginnen die alpha-mimetischen Wirkungen von Adrenalin überzuwiegen: Der systolische und diastolische Druck steigen parallel an, wie unter dem Einfluss von Noradrenalin.
Die Wirkung von Katecholaminen auf den Stoffwechsel besteht aus direkten und indirekten Effekten. Erstere werden hauptsächlich über Beta-Rezeptoren realisiert. Komplexere Prozesse sind mit der Leber verbunden. Obwohl eine erhöhte Glykogenolyse in der Leber traditionell als Folge der Beta-Rezeptor-Aktivierung angesehen wird, gibt es auch Hinweise auf eine Beteiligung von Alpha-Rezeptoren. Indirekte Effekte von Katecholaminen sind mit der Modulation der Sekretion vieler anderer Hormone, wie beispielsweise Insulin, verbunden. Bei der Wirkung von Adrenalin auf seine Sekretion überwiegt eindeutig die alpha-adrenerge Komponente, da gezeigt wurde, dass jeglicher Stress mit einer Hemmung der Insulinsekretion einhergeht.
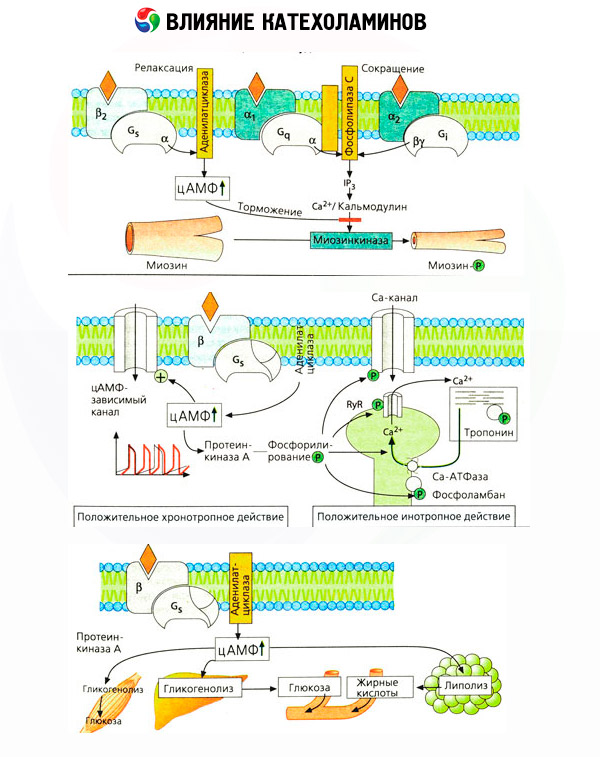
Die Kombination direkter und indirekter Katecholaminwirkungen führt zu Hyperglykämie, die nicht nur mit einer erhöhten Glukoseproduktion in der Leber, sondern auch mit einer Hemmung ihrer Verwertung durch periphere Gewebe einhergeht. Eine Beschleunigung der Lipolyse führt zu einer Hyperlipidämie mit erhöhter Fettsäurezufuhr zur Leber und einer Intensivierung der Ketonkörperproduktion. Eine erhöhte Glykolyse in den Muskeln führt zu einer erhöhten Freisetzung von Laktat und Pyruvat ins Blut, die zusammen mit dem aus dem Fettgewebe freigesetzten Glycerin als Vorläufer der hepatischen Gluconeogenese dienen.
Regulierung der Katecholaminausschüttung. Die Ähnlichkeit der Produkte und Reaktionsweisen des sympathischen Nervensystems und des Nebennierenmarks bildete die Grundlage für die Zusammenlegung dieser Strukturen zu einem einzigen sympathisch-adrenalen System des Körpers mit der Zuordnung seiner nervösen und hormonellen Verbindungen. Verschiedene afferente Signale konzentrieren sich im Hypothalamus und den Zentren des Rückenmarks und der Medulla oblongata, von wo aus efferente Nachrichten zu den Zellkörpern präganglionärer Neuronen in den Seitenhörnern des Rückenmarks auf Höhe des VIII. Hals-II-III. Lendensegments wechseln.
Die präganglionären Axone dieser Zellen verlassen das Rückenmark und bilden synaptische Verbindungen mit Neuronen in den Ganglien des sympathischen Nervenstrangs oder mit Zellen des Nebennierenmarks. Diese präganglionären Fasern sind cholinerg. Der erste grundlegende Unterschied zwischen sympathischen postganglionären Neuronen und chromaffinen Zellen des Nebennierenmarks besteht darin, dass letztere das von ihnen empfangene cholinerge Signal nicht über Nervenleitung (postganglionäre adrenerge Nerven), sondern über den humoralen Weg weiterleiten und adrenerge Verbindungen ins Blut abgeben. Der zweite Unterschied besteht darin, dass postganglionäre Nerven Noradrenalin produzieren, während Zellen des Nebennierenmarks hauptsächlich Adrenalin produzieren. Diese beiden Substanzen haben unterschiedliche Wirkungen auf das Gewebe.

