Facharzt des Artikels
Neue Veröffentlichungen
Pathogenese der Hepatitis B
Zuletzt überprüft: 07.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Bei der Pathogenese der Hepatitis B lassen sich mehrere Leitglieder der pathogenetischen Kette unterscheiden:
- Einschleppung des Erregers - Infektion;
- Fixierung am Hepatozyten und Eindringen in die Zelle;
- Vermehrung des Virus und sein „Herausdrücken“ auf die Oberfläche der Hepatozyten sowie ins Blut;
- Aktivierung immunologischer Reaktionen zur Eliminierung des Erregers;
- Immunkomplexschäden an Organen und Systemen;
- Immunbildung, Befreiung vom Erreger, Genesung.
Da die Infektion mit Hepatitis B stets parenteral erfolgt, kann davon ausgegangen werden, dass der Zeitpunkt der Infektion praktisch dem Eindringen des Virus ins Blut entspricht. Versuche einiger Forscher, enterale und regionale Phasen bei Hepatitis B zu unterscheiden, sind wenig fundiert. Es gibt weitere Gründe für die Annahme, dass das Virus mit dem Blutfluss sofort in die Leber gelangt.
Der Tropismus des Hepatitis-B-Virus zum Lebergewebe wird durch das Vorhandensein eines speziellen Rezeptors im HBsAg vorgegeben – eines Polypeptids mit einem Molekulargewicht von 31.000 Da (P31), das über Albumin-bindende Aktivität verfügt. Eine ähnliche Albuminzone findet sich auch auf der Membran von Hepatozyten in der Leber von Mensch und Schimpanse, was den Tropismus des HBV zur Leber von Mensch und Schimpanse maßgeblich bestimmt.
Wenn das Virus in den Hepatozyten eindringt, wird virale DNA freigesetzt, die in den Leberzellkern eindringt und als Matrix für die Nukleinsäuresynthese dient. Sie löst eine Reihe aufeinanderfolgender biologischer Reaktionen aus, deren Ergebnis der Aufbau des Nukleokapsids des Virus ist. Das Nukleokapsid wandert durch die Kernmembran ins Zytoplasma, wo die endgültige Zusammensetzung der Dane-Partikel – des vollständigen Hepatitis-B-Virus – erfolgt.
Es ist jedoch zu beachten, dass der Prozess bei einer Infektion eines Hepatozyten auf zwei Arten ablaufen kann – replikativ und integrativ. Im ersten Fall entwickelt sich ein Bild einer akuten oder chronischen Hepatitis, im zweiten Fall eine Virusbeförderung.
Die Gründe für die beiden Interaktionsarten zwischen viraler DNA und Hepatozyten sind noch nicht genau geklärt. Höchstwahrscheinlich ist die Art der Reaktion genetisch bedingt.
Das Ergebnis der replikativen Interaktion ist der Zusammenbau der Kernantigenstrukturen (im Zellkern) und der Zusammenbau des vollständigen Virus (im Zytoplasma), gefolgt von der Präsentation des vollständigen Virus oder seiner Antigene auf der Membran oder in der Struktur der Hepatozytenmembran.
Es ist allgemein anerkannt, dass die Virusreplikation keine Zellschäden auf Hepatozytenebene verursacht, da das Hepatitis-B-Virus keine zytopathische Wirkung hat. Diese Position kann nicht als unumstößlich angesehen werden, da sie auf experimentellen Daten basiert, die zwar auf das Fehlen einer zytopathischen Wirkung des Hepatitis-B-Virus hinweisen, jedoch an Gewebekulturen gewonnen wurden und daher nicht vollständig auf die Virushepatitis B beim Menschen übertragen werden können. In jedem Fall bedarf die Frage des Fehlens von Hepatozytenschäden während der Replikationsphase weiterer Untersuchungen.
Unabhängig von der Art der Interaktion des Virus mit der Zelle ist die Leber jedoch notwendigerweise in den immunpathologischen Prozess einbezogen. In diesem Fall ist die Schädigung der Hepatozyten damit verbunden, dass infolge der Expression viraler Antigene auf der Hepatozytenmembran und der Freisetzung viraler Antigene in den freien Kreislauf eine Kette sequentieller zellulärer und humoraler Immunreaktionen in Gang gesetzt wird, die letztendlich darauf abzielen, das Virus aus dem Körper zu entfernen. Dieser Prozess erfolgt in voller Übereinstimmung mit den allgemeinen Mustern der Immunantwort auf Virusinfektionen. Zur Eliminierung des Erregers werden zelluläre zytotoxische Reaktionen eingeleitet, die durch verschiedene Klassen von Effektorzellen vermittelt werden: K-Zellen, T-Zellen, natürliche Killerzellen, Makrophagen. Während dieser Reaktionen werden die infizierten Hepatozyten zerstört, was mit der Freisetzung viraler Antigene (HBcAg, HBeAg, HBsAg) einhergeht, die das Antikörpergenesesystem starten, wodurch sich spezifische Antikörper im Blut ansammeln, vor allem gegen das Kern-Anti-HBc und das E-Antigen-Anti-HBE. Folglich erfolgt die Freisetzung des Virus aus der Leberzelle im Zuge ihres Absterbens aufgrund der Reaktionen der zellulären Zytolyse.
Gleichzeitig binden spezifische Antikörper, die sich im Blut ansammeln, die Virusantigene und bilden Immunkomplexe, die von Makrophagen phagozytiert und über die Nieren ausgeschieden werden. In diesem Fall können verschiedene Immunkomplexläsionen in Form von Glomerulonephritis, Arteriitis, Arthralgie, Hautausschlägen usw. auftreten. Durch die Beteiligung spezifischer Antikörper wird der Körper vom Erreger gereinigt und es kommt zu einer vollständigen Genesung.
Gemäß dem skizzierten Konzept der Pathogenese der Hepatitis B erklärt sich die Vielfalt der klinischen Varianten des Krankheitsverlaufs in der Regel aus den Besonderheiten der Interaktion des Virus und der Kooperation immunkompetenter Zellen, also der Stärke der Immunantwort auf das Vorhandensein viraler Antigene. Nach modernen Konzepten ist die Stärke der Immunantwort genetisch bedingt und an die Histokompatibilitätsantigene des HLA-Locus erster Klasse gekoppelt.
Es ist allgemein anerkannt, dass sich unter Bedingungen einer ausreichenden Immunantwort auf Virusantigene klinisch eine akute Hepatitis mit zyklischem Verlauf und vollständiger Genesung entwickelt. Vor dem Hintergrund einer Abnahme der Immunantwort auf Virusantigene wird die immunvermittelte Zytolyse unbedeutend exprimiert, daher erfolgt keine wirksame Eliminierung infizierter Leberzellen, was zu leichten klinischen Manifestationen mit langfristiger Persistenz des Virus und möglicherweise zur Entwicklung einer chronischen Hepatitis führt. Gleichzeitig treten im Gegensatz dazu bei einer genetisch bedingten starken Immunantwort und einer massiven Infektion (Hämotransfusion) ausgedehnte Leberzellschäden auf, die klinisch schweren und bösartigen Formen der Erkrankung entsprechen.
Das vorgestellte Schema der Pathogenese der Hepatitis B zeichnet sich durch seine Kohärenz aus, enthält jedoch eine Reihe kontroverser und wenig erforschter Punkte.
Wenn wir Hepatitis B als immunpathologische Erkrankung betrachten, können wir mit zunehmender Schwere der Erkrankung eine Zunahme zellulärer Zytotoxizitätsreaktionen erwarten. Bei schweren Formen sind jedoch die Indizes der zellulären Immunität stark reduziert, darunter ein mehrfacher Abfall im Vergleich zu gesunden Kindern, sowie der K-Zell-Zytotoxizitätsindex. Bei der malignen Form, während der Entwicklung einer massiven Lebernekrose und insbesondere eines Leberkomas, kommt es zu einer vollständigen Unfähigkeit der Lymphozyten zur Blastentransformation unter dem Einfluss von Phytohämatlutinin, Staphylokokken-Endotoxin und HBsAg. Außerdem fehlt den Leukozyten die Fähigkeit, gemäß der Leukozytenmigrationshemmreaktion (LMIC) zu migrieren, und gemäß den Ergebnissen von Untersuchungen mit einer fluoreszierenden Tetracyclinsonde zeigt sich eine starke Zunahme der Permeabilität der Lymphozytenmembranen.
Wenn also die Fluoreszenzindizes der Lymphozyten bei Gesunden 9,9 ± 2 % betragen und bei typischer Hepatitis B mit gutartigem Verlauf auf 22,3 ± 2,7 % ansteigen, erreicht die Anzahl der fluoreszierenden Lymphozyten bei malignen Formen durchschnittlich 63,5 ± 5,8 %. Da eine erhöhte Permeabilität von Zellmembranen in der Literatur eindeutig als zuverlässiger Indikator für deren funktionelle Minderwertigkeit bewertet wird, kann der Schluss gezogen werden, dass bei Hepatitis B, insbesondere bei der malignen Form, eine schwere Schädigung der Lymphozyten vorliegt. Dies wird auch durch die Indizes der K-Zell-Zytotoxizität belegt. Bei einer schweren Form beträgt die Zytotoxizität in der 1.–2. Woche der Erkrankung 15,5±8,8 %, bei der malignen Form in der 1. Woche 6,0±2,6, in der 2. Woche 22,0±6,3 % bei einem Normwert von 44,8±2,6 %.
Die präsentierten Daten weisen eindeutig auf ausgeprägte Störungen der zellulären Immunitätsbindung bei Patienten mit schweren Formen der Hepatitis B hin. Es ist auch offensichtlich, dass diese Veränderungen sekundär auftreten, als Folge einer Schädigung immunkompetenter Zellen durch toxische Metaboliten und möglicherweise zirkulierende Immunkomplexe.
Wie Studien gezeigt haben, sinkt bei Patienten mit schweren Formen der Hepatitis B, insbesondere bei der Entwicklung einer massiven Lebernekrose, der Titer von HBsAg und HBeAg im Blutserum und gleichzeitig werden Antikörper gegen das Oberflächenantigen in hohen Titern nachgewiesen, was für gutartige Formen der Krankheit völlig untypisch ist, bei denen Anti-HBV erst im 3.-5. Monat der Krankheit auftreten.
Das schnelle Verschwinden von Hepatitis-B-Virus-Antigenen bei gleichzeitigem Auftreten hoher Titer antiviraler Antikörper deutet auf eine intensive Bildung von Immunkomplexen und deren mögliche Beteiligung an der Pathogenese der Entwicklung einer massiven Lebernekrose hin.
Daher erlauben uns die Fakten nicht, Hepatitis B nur vom Standpunkt der immunpathologischen Aggression eindeutig zu interpretieren. Und der Punkt ist nicht nur, dass kein Zusammenhang zwischen der Tiefe und Prävalenz morphologischer Veränderungen in der Leber einerseits und der Schwere zellulärer Immunitätsfaktoren andererseits gefunden wird. Theoretisch könnte dieser Umstand durch die späten Stadien der Untersuchung zellulärer Immunitätsindikatoren erklärt werden, als immunkompetente Zellen aufgrund zunehmender funktioneller Insuffizienz der Leber starken toxischen Wirkungen ausgesetzt waren. Natürlich kann davon ausgegangen werden, dass die Immunzytolyse von Hepatozyten in den frühesten Stadien des Infektionsprozesses auftritt, möglicherweise sogar vor dem Auftreten klinischer Symptome schwerer Leberschäden. Eine solche Annahme ist jedoch unwahrscheinlich, da bei Patienten mit dem akutesten (blitzartigen) Krankheitsverlauf ähnliche Indikatoren für die zelluläre Immunität festgestellt wurden und außerdem bei der morphologischen Untersuchung des Lebergewebes keine massive lymphatische Infiltration festgestellt wurde, während gleichzeitig kontinuierliche Felder nekrotischen Epithels ohne die Phänomene der Resorption und lymphatischen Aggression festgestellt wurden.
Es ist sehr schwierig, das morphologische Bild einer akuten Hepatitis nur vom Standpunkt der immunzellulären Zytolyse aus zu erklären, daher wurde in frühen Studien die zytotoxische Wirkung des Hepatitis-B-Virus nicht ausgeschlossen.
Derzeit wurde diese Annahme durch die Entdeckung des Hepatitis-B-Virus teilweise bestätigt. Studien haben gezeigt, dass die Häufigkeit des Nachweises von Hepatitis-D-Markern direkt vom Schweregrad der Erkrankung abhängt: Bei leichten Formen werden sie bei 14 % nachgewiesen, bei mittelschweren bei 18 %, bei schweren bei 30 % und bei bösartigen bei 52 % der Patienten. Angesichts der nekrogenen zytopathischen Wirkung des Hepatitis-D-Virus kann davon ausgegangen werden, dass eine Koinfektion mit Hepatitis-B- und D-Viren für die Entwicklung fulminanter Formen der Hepatitis B von großer Bedeutung ist.
Die Pathogenese der Hepatitis B lässt sich wie folgt darstellen: Nach dem Eindringen des Hepatitis-B-Virus in die Hepatozyten wird ein immunologischer Angriff auf die infizierten Hepatozyten durch T-Killer ausgelöst, die Lymphotoxine in Richtung der Leberzellen absondern.
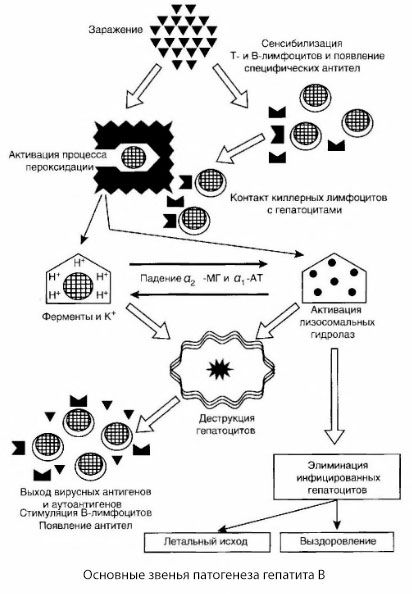
Die genauen Mechanismen der Hepatozytenschädigung bei Hepatitis B sind noch nicht geklärt. Die Hauptrolle spielen aktivierte Prozesse der Lipidperoxidation und lysosomaler Hydrolasen. Auslöser können Lymphotoxine sein, die von Effektorzellen bei Kontakt mit Hepatozyten freigesetzt werden. Es ist jedoch möglich, dass das Virus selbst die Peroxidationsprozesse initiiert. Anschließend entwickelt sich der pathologische Prozess höchstwahrscheinlich in der folgenden Reihenfolge.
- Wechselwirkung des Aggressionsfaktors (Lymphotoxine oder Viren) mit biologischen Makromolekülen (möglicherweise mit Komponenten der Membranen des endoplasmatischen Retikulums, die an Entgiftungsprozessen beteiligt sein können, analog zu anderen schädlichen Stoffen, wie dies im Zusammenhang mit Tetrachlorkohlenstoff gezeigt wurde).
- Bildung freier Radikale, Aktivierung von Lipidperoxidationsprozessen und erhöhte Durchlässigkeit aller Leberzellmembranen (Zytolyse-Syndrom).
- Bewegung biologisch aktiver Substanzen entlang des Konzentrationsgradienten – Verlust von Enzymen verschiedener intrazellulärer Lokalisation, Energiespendern, Kalium usw. Ansammlung von Natrium und Kalzium in den Zellen, pH-Verschiebung in Richtung intrazellulärer Azidose.
- Aktivierung und Freisetzung lysosomaler Hydrolasen (RNAse, DNAse, Cathepsine etc.) mit Abbau von Leberzellen und Freisetzung von Autoantigenen.
- Stimulation des T- und B-Immunsystems mit Ausbildung einer spezifischen Sensibilisierung der T-Lymphozyten gegen Leberlipoprotein sowie Bildung antihepatischer humoraler Autoantikörper.
Im vorgeschlagenen Schema der Hepatitis B-Pathogenese sind virale Antigene der auslösende Faktor, deren intensive Produktion in den frühesten Stadien der Krankheit und während der gesamten akuten Phase beobachtet wird, mit Ausnahme der malignen Formen, bei denen die Produktion viraler Antigene zum Zeitpunkt der Entwicklung einer massiven Lebernekrose praktisch aufhört, was eine schnelle Abnahme der Virusreplikation vorgibt.
Es ist auch offensichtlich, dass virale Antigene die T- und B-Systeme der Immunität aktivieren. Während dieses Prozesses kommt es zu einer charakteristischen Umverteilung der T-Lymphozyten-Subpopulationen, deren Ziel die Organisation einer adäquaten Immunantwort, die Eliminierung infizierter Hepatozyten, die Neutralisierung viraler Antigene, die Sanogenese und die Genesung ist.
Wenn immunkompetente Zellen mit viralen Antigenen auf Hepatozytenmembranen interagieren oder während der Virusreproduktion innerhalb eines Hepatozyten, entstehen Bedingungen für die Aktivierung von Lipidperoxidationsprozessen, die bekanntlich die Durchlässigkeit aller zellulären und subzellulären Membranen steuern.
Aus dieser Perspektive wird das Auftreten des Zytolysesyndroms, einer erhöhten Durchlässigkeit der Zellmembranen, das so natürlich und höchst charakteristisch für die Virushepatitis ist, verständlich.
Das Endergebnis des Zytolysesyndroms kann eine vollständige Entkopplung der oxidativen Phosphorylierung, ein Austritt von Zellmaterial und ein Absterben des Leberparenchyms sein.
In den allermeisten Fällen nehmen diese Prozesse jedoch keinen so fatalen Verlauf. Nur bei bösartigen Formen der Erkrankung verläuft der pathologische Prozess lawinenartig und irreversibel, da es zu massiven Infektionen, einem ausgeprägten Immunprozess, einer übermäßigen Aktivierung von Peroxidationsprozessen und lysosomalen Hydrodasen sowie zu autoimmunen Aggressionsphänomenen kommt.
Die gleichen Mechanismen werden im günstigen Verlauf der Hepatitis B beobachtet, mit der einzigen Besonderheit, dass sie alle auf einem qualitativ unterschiedlichen Niveau realisiert werden. Im Gegensatz zu Fällen massiver Lebernekrose ist im günstigen Verlauf der Krankheit die Anzahl der infizierten Hepatozyten und damit die Zone der immunpathologischen Zytolyse kleiner, die Prozesse der Lipidperoxidation sind nicht so signifikant verstärkt, die Aktivierung von sauren Hydrolasen führt nur zu einer begrenzten Autolyse mit unbedeutender Freisetzung von Autoantigenen und daher ohne massive Autoaggression, d. h. alle Stadien der Pathogenese im günstigen Verlauf verlaufen im Rahmen der erhaltenen strukturellen Organisation des Leberparenchyms und werden durch Abwehrsysteme (Antioxidantien, Inhibitoren usw.) gehemmt und haben daher keine so zerstörerische Wirkung.
Die Ursachen der Intoxikationssymptome bei Virushepatitis sind noch nicht vollständig geklärt. Der Vorschlag, zwischen der sogenannten primären (viralen) und der sekundären (Austausch- oder metabolischen) Intoxikation zu unterscheiden, kann als positiv angesehen werden, obwohl dies den genauen Mechanismus der Entstehung des allgemeinen toxischen Syndroms nicht aufdeckt. Erstens haben Hepatitis-Viren keine toxischen Eigenschaften, und zweitens korreliert die Konzentration vieler Metaboliten nicht immer mit der Schwere der Erkrankung und dem Grad der Ausprägung der Toxikosesymptome. Es ist auch bekannt, dass die Konzentration viraler Antigene nicht streng mit der Schwere der Intoxikation korreliert. Im Gegenteil, mit zunehmender Schwere der Erkrankung und damit dem Grad der Toxikose sinkt die HBsAg-Konzentration und ist bei malignen Formen zum Zeitpunkt des Einsetzens eines tiefen Leberkomas am niedrigsten. Gleichzeitig hängen die Nachweishäufigkeit und die Titer spezifischer antiviraler Antikörper direkt von der Schwere der Erkrankung ab.
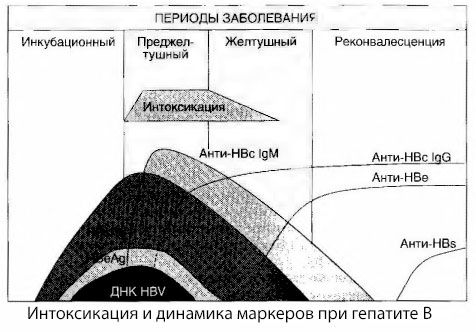
Die Intoxikation tritt nicht zum Zeitpunkt der Registrierung viraler Antigene auf, sondern während der Zirkulation antiviraler Antikörper der Klasse IgM gegen das Kuh-Antigen und das Antigen des E-Systems im Blut. Darüber hinaus hat bei schweren und insbesondere malignen Formen ein erheblicher Anteil der Patienten sogar Anti-HBs im Blut, was bei leichten und mittelschweren Formen der Erkrankung normalerweise nie beobachtet wird.
Die präsentierten Daten lassen den Schluss zu, dass das Toxikosesyndrom bei Virushepatitis, insbesondere Hepatitis B, nicht durch das Auftreten viraler Antigene im Blut entsteht, sondern eine Folge der Interaktion viraler Antigene mit antiviralen Antikörpern der IgM-Klasse ist. Das Ergebnis einer solchen Interaktion ist bekanntlich die Bildung von Immunkomplexen und möglicherweise toxischen Wirkstoffen.
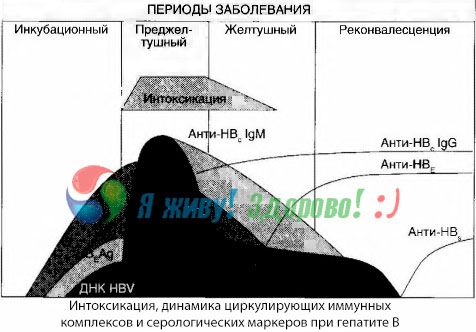
Die Symptome einer Vergiftung treten im Moment des Auftretens von Immunkomplexen im freien Kreislauf auf, später wird jedoch kein solcher Zusammenhang mehr beobachtet.
Eine teilweise Erklärung hierfür findet sich in der Untersuchung der Zusammensetzung von Immunkomplexen. Bei Patienten mit schweren Formen zirkulieren überwiegend mittelgroße Komplexe im Blut, und in ihrer Zusammensetzung überwiegen auf dem Höhepunkt des toxischen Syndroms Antikörper der Klasse, während in der Phase des Rückgangs der klinischen Manifestationen und der Rekonvaleszenz die Komplexe größer werden und in ihrer Zusammensetzung Antikörper der IgG-Klasse zu überwiegen beginnen.
Die vorgelegten Daten betreffen die Mechanismen der Entwicklung des toxischen Syndroms in der Anfangsphase der Krankheit, haben jedoch bei einer Toxikose, die auf dem Höhepunkt der klinischen Manifestationen auftritt, nur eine teilweise Bedeutung, insbesondere bei der Entwicklung eines Leberkomas.
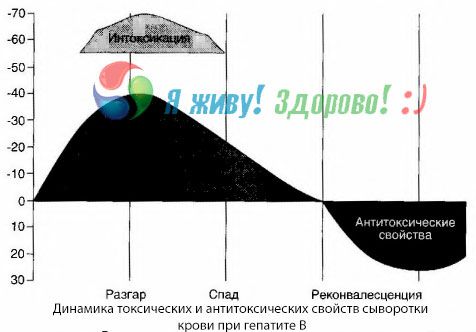
Die Methode der Blutkulturen hat gezeigt, dass sich bei Hepatitis B ständig Giftstoffe im Blut ansammeln, die aus dem geschädigten, zerfallenden Lebergewebe freigesetzt werden. Die Konzentration dieser Toxine ist proportional zur Schwere der Erkrankung, sie sind proteinartiger Natur.
Während der Erholungsphase treten Antikörper gegen dieses Toxin im Blut auf. Bei einem Leberkoma steigt die Konzentration des Toxins im Blut jedoch stark an und es werden keine Antikörper im Blut nachgewiesen.
Pathomorphologie der Hepatitis B
Aufgrund der Art der morphologischen Veränderungen werden drei Formen der akuten Hepatitis B unterschieden:
- zyklische Form,
- massive Lebernekrose;
- cholestatische pericholangiolytische Hepatitis.
Bei der zyklischen Form der Hepatitis B sind dystrophische, entzündliche und proliferative Veränderungen im Zentrum der Läppchen stärker ausgeprägt, während sie bei Hepatitis A entlang der Peripherie des Läppchens lokalisiert sind und sich zum Zentrum hin ausbreiten. Diese Unterschiede erklären sich durch unterschiedliche Wege der Viruspenetration in das Leberparenchym. Das Hepatitis-A-Virus gelangt über die Pfortader in die Leber und breitet sich bis zum Zentrum der Läppchen aus, das Hepatitis-B-Virus dringt über die Leberarterie und Kapillaräste, die alle Läppchen gleichmäßig versorgen, bis in deren Zentrum vor.
Der Grad der Schädigung des Leberparenchyms entspricht in den meisten Fällen der Schwere der klinischen Manifestationen der Erkrankung. Bei leichten Formen wird üblicherweise eine fokale Nekrose der Hepatozyten beobachtet, bei mittelschweren und schweren Formen eine zonale Nekrose (mit der Tendenz zur Verschmelzung und Bildung einer brückenartigen Nekrose bei schweren Formen der Erkrankung).
Die stärksten morphologischen Veränderungen im Leberparenchym werden auf dem Höhepunkt der klinischen Manifestationen beobachtet, was üblicherweise mit der ersten Dekade der Erkrankung zusammenfällt. Während der zweiten und insbesondere der dritten Dekade verstärken sich die Regenerationsprozesse. Zu diesem Zeitpunkt verschwinden nekrobiotische Veränderungen fast vollständig, und zelluläre Infiltrationsprozesse beginnen zu dominieren, mit anschließender langsamer Wiederherstellung der Struktur der Leberzellplatten. Eine vollständige Wiederherstellung der Struktur und Funktion des Leberparenchyms erfolgt jedoch erst 3–6 Monate nach Krankheitsbeginn und nicht bei allen Patienten.
Der generalisierte Charakter der Infektion bei Hepatitis B wird durch den Nachweis von HBsAg nicht nur in Hepatozyten, sondern auch in Nieren, Lunge, Milz, Bauchspeicheldrüse, Knochenmarkszellen usw. bestätigt.
Die cholestatische (pericholangiolytische) Hepatitis ist eine Sonderform der Erkrankung, bei der die stärksten morphologischen Veränderungen an den intrahepatischen Gallengängen auftreten, mit einem Bild von Cholangiolitis und Pericholangiolitis. Bei der cholestatischen Form kommt es zu einer Cholestase mit Erweiterung der Gallenkapillaren und Gallenstauung, mit Proliferation der Cholangiolen und der sie umgebenden Zellinfiltrate. Leberzellen sind bei dieser Hepatitisform nur unwesentlich betroffen. Klinisch ist die Erkrankung durch einen langwierigen Verlauf mit anhaltender Gelbsucht gekennzeichnet. Es hat sich gezeigt, dass die Ursache für diesen besonderen Krankheitsverlauf die vorherrschende Wirkung des Virus auf die Wände der Cholangiolen mit einer unbedeutenden Wirkung auf die Hepatozyten ist.

