Facharzt des Artikels
Neue Veröffentlichungen
Medikamente
Medikamente zur Verhinderung von Thrombose und zur Verbesserung der Blutfließfähigkeit
Zuletzt überprüft: 07.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Um die Bildung multipler Mikrothromben während eines Schocks und deren Zerstörung zu verhindern, können verschiedene pharmakologische Ansätze verwendet werden, bei denen Medikamente zum Einsatz kommen, die die Thrombusbildung verhindern und die Blutrheologie verbessern:
- Beseitigung systemischer hämodynamischer und Mikrozirkulationsstörungen mit vasoaktiven und inotropen Mitteln;
- Maßnahmen zur Verbesserung der Blutrheologie durch rationale Infusionstherapie und Medikamente, die die Elastizität der Erythrozytenmembranen wiederherstellen (Trental oder Pentoxifyllin);
- Verhinderung der Thrombozytenaggregation und der Bildung anfänglicher „weißer“ Thromben in kleinen Arteriengefäßen mit anschließender Einleitung der Gerinnungskaskade;
- Hemmung der Thrombusbildung nach Aktivierung der systemischen Gerinnungskaskade;
- Aktivierung der Fibrinolyse mit dem Ziel, neu gebildete Blutgerinnsel aufzulösen (Fibrinolysin, Streptokinase, Streptodecase, Urokinase usw.) oder im Gegenteil, Hemmung der Fibrinolyse, wenn sie bei einigen Patienten mit traumatischem Schock und Sepsis generalisiert ist (Aminocapronsäure, Amben, Contrical usw.).
Die meisten der aufgeführten Ansätze sind traditionell, in der Schockbehandlungspraxis gut entwickelt, haben ihre eigenen hämorheologischen Indikationen und werden in den entsprechenden Kapiteln spezifiziert. Daher empfiehlt es sich, in diesem Abschnitt näher auf den allgemeinen Ansatz zur Prävention der Thrombusbildung bei Schock mit pharmakologischen Wirkstoffen einzugehen, die die Prophase der Blutgerinnung beeinflussen. Es ist diese Ebene der Prävention von Gerinnungskomplikationen – das Auftreten, die Bildung und das Wachstum von „weißen arteriellen Thromben“ –, die die größte Aufmerksamkeit der Forscher auf sich zieht.
Verschiedene und oft multidirektionale Störungen der Blutgerinnung mit Verschlechterung ihrer Rheologie sind charakteristisch für verschiedene Schockarten. Am charakteristischsten für septische, endotoxinbedingte, Verbrennungs-, traumatische und hämorrhagische Schockarten ist die Bildung multipler Mikrothromben in den kleinsten Gefäßen, verursacht durch Störungen der systemischen Hämodynamik, Vasospasmen und Mikrozirkulationsstörungen, Blutverdickung, Schlammbildung, verminderte Elastizität der Erythrozytenmembranen sowie zahlreiche allgemeine und lokale Faktoren (Autokoide), die lokale Veränderungen der Gerinnungshämostase und den Einschluss der Prophase der Blutgerinnung auslösen.
In schematischer (gekürzter) Form werden das Anfangsstadium der Hämokoagulation und der Mechanismus der lokalen Hämokoagulationshomöostase wie folgt dargestellt.
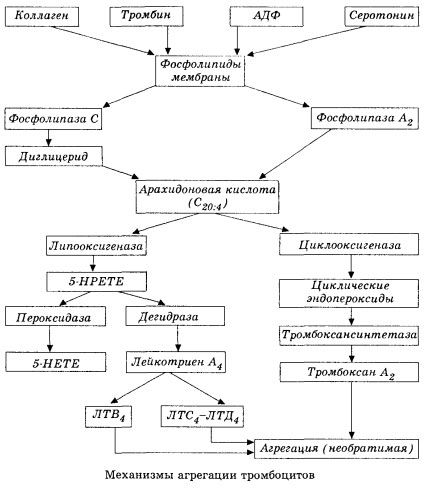
Es beginnt mit der Aktivierung der Membranphospholipase A2 infolge einer Kombination schädigender Faktoren (direkte Membranschädigung, Hypoxie, Lipidperoxidation, Einwirkung endogener chemischer Faktoren usw.). Durch den Abbau von Membranphospholipiden werden unveresterte langkettige Fettsäuren freigesetzt, von denen Arachidonsäure als Ausgangssubstrat die wichtigste ist. Ihre Umwandlung (Arachidonsäurekaskade) erfolgt über Lipoxygenase (Synthese von Leukotrienen) und Cyclooxygenase (Synthese von Prostaglandinen, Thromboxanen, Prostacyclin).
Die resultierenden Leukotriene (B4, C4, E4, D4 usw.) – Substanzen mit extrem hoher biologischer Aktivität, zu denen auch die langsam reagierende Substanz der Anaphylaxie gehört – sind von großer Bedeutung bei der Auslösung lokaler Gefäß-, Entzündungs- und Immunreaktionen, einschließlich Autoimmunprozessen. Leukotriene verursachen Mikrozirkulationsstörungen, erhöhte Blutgerinnung, die Freisetzung autolytischer lysosomaler Enzyme und die Freisetzung eines Faktors ins Blut, der die Myokardkontraktilität und Bronchialspasmen hemmt.
Aufgrund ihrer Fähigkeit, eine Kontraktion der glatten Muskulatur zu bewirken, beeinflussen Leukotriene die systemische Hämodynamik, die Koronargefäße und das Myokard erheblich, indem sie eine starke koronare konstriktorische und negativ inotrope Wirkung ausüben, die mit einer Verringerung des Herzzeitvolumens einhergeht und eine wichtige Rolle bei der Entwicklung von Hypotonie spielt.
Eine verminderte Herzleistung und eine hypotensive Reaktion auf Leukotriene gehen mit einer Schwächung des Herzmuskels und einer Einschränkung des venösen Rückflusses zum Herzen einher. Von wesentlicher Bedeutung für die Einschränkung des venösen Rückflusses ist die Fähigkeit der Leukotriene, die Permeabilität der Gefäßwand zu erhöhen und eine Plasmaextravasation zu verursachen. Leukotriene gelten als wichtig für die Pathogenese des Myokardinfarkts.
Bei anaphylaktischem und septischem (Endotoxin-) Schock spielt ihre Rolle offenbar noch eine größere Rolle. Dies wird durch die Fähigkeit von Leukotrienen belegt, sich bei allergischen Reaktionen in signifikanten Mengen im Plasma anzureichern und die für den anaphylaktischen Schock charakteristischen Veränderungen des systemischen Blutflusses zu verursachen. Auch die schützende Wirkung von Leukotrienrezeptorblockern und Lipoxygenasehemmern ist relevant. Die Entwicklung selektiver Leukotrienrezeptorblocker wird intensiv vorangetrieben und ist eine vielversprechende wissenschaftliche Richtung. In diesem Bereich wurden bereits einige Erfolge erzielt, und die Wirksamkeit solcher Blocker bei Myokardischämie, Endotoxin und hämorrhagischem Schock wurde experimentell bestätigt. Bis zur klinischen Umsetzung wird es jedoch voraussichtlich noch einige Jahre dauern.
Während in Venengefäßen Thromben unter gleicher Beteiligung von Thrombozyten und Plasmagerinnungsfaktoren entstehen, sind in Arterien die Thrombozyten die Hauptinitiatoren dieses Prozesses. Sie enthalten ADP, Ca2+, Serotonin, Phospholipide, Enzyme der Prostaglandin- und Thromboxansynthese, Thrombosthenin (das ebenso wie Muskel-Aktomyosin für die Kontraktionsfähigkeit dieser Zellen sorgt), thrombogenen Wachstumsfaktor der Epithel- und Muskelzellen der Gefäßwand und zahlreiche weitere Substanzen. Die humorale Regulierung der Thrombozytenfunktionen erfolgt über spezialisierte Rezeptoren ihrer Membranen (Alpha2- und Beta2-Adrenorezeptoren, Rezeptoren für Histamin und Serotonin, Acetylcholin, Thromboxan, Adenosin und zahlreiche andere). Eine besondere Eigenschaft der Thrombozyten ist eine hohe Affinität zu Kollagen und anderen subendothelialen Elementen der Gefäßwand, zu nicht benetzenden und negativ geladenen Oberflächen. Diese Eigenschaft verleiht Thrombozyten die außergewöhnliche Fähigkeit, an einem Gefäßabschnitt mit geschädigtem Endothel zu haften, der bei einem Schock reichlich Schaden nehmen kann. In diesem Fall breiten sich die Thrombozyten aus und setzen Pseudopodien frei, die aneinander und an der Gefäßwand haften können. Die Membrandurchlässigkeit steigt, und ADP, Serotonin, Thromboxan und einige an der Thrombozytenoberfläche adsorbierte Gerinnungsfaktoren werden aus den Thrombozyten freigesetzt. Diese Substanzen interagieren mit den entsprechenden Rezeptoren auf der Membran und verursachen unter Beteiligung von Calciumionen eine (zunächst reversible) Aggregation. Der Prozess wird selbsterhaltend, was durch humorale Regulationsfaktoren erleichtert wird; andere Faktoren können ihn hingegen stoppen oder sogar umkehren, was zur Desaggregation führt.
Wenn thrombusbildende Einflüsse und Bedingungen vorherrschen, werden die Phasen der Adhäsion und der reversiblen Aggregation durch die dritte Phase ersetzt – die irreversible Aggregation, die unter Beteiligung von Thrombosthenin erfolgt und zur Verengung des Gerinnsels führt; die Reaktion der Verstärkung des Aggregats und der Verengung erfolgt auch unter Beteiligung von Ca +, ATP und führt zur Bildung eines weißen Thrombus.
Der Cyclooxygenase-Weg der Arachidonsäure-Umwandlung in Thrombozyten, vaskulären Endothelzellen und anderen Geweben gewährleistet die lokale (die Halbwertszeit der Metaboliten ist sehr kurz) Gerinnungshomöostase, da während dieses Stoffwechsels starke pro- und antiaggregierende Substanzen gebildet werden. Der Hauptfaktor, der die Thrombozytenaggregation in der Cyclooxygenase-Reaktionskette aktiviert, ist Thromboxan A2, und sein nicht minder starker Antagonist ist Prostacyclin, das von Endothelzellen und in geringerem Maße von Prostaglandinen der E- und G-Reihe produziert wird. Schließlich wird die Thrombozytenaggregation stark durch weitere lokale und systemische humorale Faktoren beeinflusst.
Aktivatoren und Inhibitoren der Thrombozytenaggregation
Initiatoren und Aktivatoren der Thrombozytenaggregation |
Thrombozytenaggregationshemmer |
Kollagen |
- |
ADP |
Adenosin und seine Stabilisatoren |
Noradrenalin (über Alpha2-Rezeptoren) |
Alpha-adrenerge Blocker |
Serotonin |
Antiserotonin-Wirkstoffe |
Histamin |
Antihistaminika |
Thrombin |
Heparin |
Ca2+ |
Ca2+-Antagonisten |
CGMP – seine Induktoren (Acetylcholin?) und Stabilisatoren |
CAM – seine Induktoren (über Beta-Adrenozeptoren) und Stabilisatoren (Phosphodiesterasehemmer) |
Arachidonsäure |
Dextrane, Albumin |
Thromboxan A2 |
Prostacyclin I2 |
Pharmakologische Interventionen in der Anfangsphase der Thrombusbildung bei Schock und akuten ischämischen Prozessen im Herzen und Gehirn legen folgende Möglichkeit nahe:
- Hemmung der ersten Reaktionen (total und partiell) der Arachidonsäurekaskade;
- Hemmung einer bestimmten Reaktion der Thromboxansynthese;
- Blockade von Rezeptoren für Leukotriene und Thromboxane in Blutplättchen, glatten Muskeln und anderen Zellen;
- die Verwendung von Substanzen, die die Thrombozytenaggregation modulieren, dh deren Reaktion auf den Einfluss initiierender Faktoren (Kollagen, Thromboxan A2, Leukotriene usw.) auf andere Weise abschwächen.
Die Umsetzung der aufgeführten Methoden zur Korrektur von Störungen der rheologischen Eigenschaften des Blutes ermöglicht die Lösung der wichtigsten taktischen Aufgabe: Schutz der Thrombozytenaggregations- und -adhäsionsrezeptoren vor der Wirkung von Aktivatoren bzw. Unterdrückung der intrazellulären Synthesemechanismen dieser Rezeptoren. Die Hemmung der initialen Reaktionen der Arachidonsäurekaskade kann durch den Schutz der auf Polymeraktivatoren reagierenden Thrombozytenrezeptoren mittels niedermolekularer Dextrane erreicht werden, deren Moleküle mit Fibrin, Kollagen, aggregiertem Immunglobulin (IgE) und Komponenten des Komplementsystems konkurrieren.
Niedermolekulare Dextrane maskieren die Rezeptoren auf der Thrombozytenmembran und konkurrieren mit großdispersen Proteinen auf der Oberfläche der Erythrozyten. Sie verdrängen diese und zerstören die Brücken zwischen den Zellen. Dies liegt daran, dass Dextrane, die das Gefäßendothel und die Oberfläche der Blutzellenelemente umhüllen, deren negative Ladung erhöhen und dadurch ihre Antiaggregationseigenschaften verstärken.
Dextrane
Dextrane mit niedrigem Molekulargewicht verringern die durch Kollagen und ADP induzierte Thrombozytenaggregation sowie die aktivierende Wirkung von Thrombin auf Thrombozyten, hemmen das Wachstum des initialen weißen Thrombus, verbessern die Durchblutung, verringern den postoperativen Anstieg des Plasmafibrinogengehalts und verändern die Struktur und Stabilität des Fibrins.
Intravenöse Dextrane-Infusionen bei Trauma und Schock reduzieren nicht nur die Thrombozytenaggregation und -adhäsion, sondern mobilisieren auch endogenes Heparin und fördern dadurch die Bildung eines lockeren und schwer zurückziehbaren Blutgerinnsels, das durch Fibrinolytika leicht aufgelöst werden kann. Die Antithrombinaktivität niedermolekularer Dextrane ist mit ihrer spezifischen Wirkung auf die Struktur und Funktion des Blutgerinnungsfaktors VIII verbunden. Faktor VIII (Antihämophilie-Globulin), ein großes Molekül mit komplexer Struktur und Funktion, ist an der Thrombozytenaggregation und der Stabilität des entstehenden Gerinnsels beteiligt. Dextrane stören die Wirkung von Faktor VIII, verlangsamen dadurch die Thrombozytenaggregation und verringern die Gerinnselstabilität.
Dextrane mit niedrigem Molekulargewicht sind keine echten Antikoagulanzien und ihre korrigierende Wirkung bei hämorheologischen Störungen ist hauptsächlich mit der Hämodilution, der Auffüllung des zirkulierenden Plasmavolumens und der Verbesserung des Blutflusses im Mikrozirkulationssystem verbunden.
Die Fähigkeit von Dextrane, den Blutfluss bei hämodynamischen Störungen (Schock, Blutverlust) zu verbessern, beruht auf einem Komplex von Faktoren. Das Auftreten einer hohen vorübergehenden Konzentration des Polymers im Blut führt nicht nur zu einer „direkten Hämodilution“, sondern schafft auch Bedingungen für den Flüssigkeitsfluss aus dem Interstitium in den Blutkreislauf und den anschließenden Ausgleich der osmotischen Wirkung von Dextran. Infolge der Hämodilution sinkt die Blutviskosität, der venöse Zufluss zum Herzen nimmt zu und das Herzzeitvolumen steigt. Darüber hinaus bilden Dextrane Komplexe mit Fibrinogen und wirken antilipämisch.
Die antiaggregationshemmende Wirkung und die hämodynamischen Effekte niedermolekularer Dextrane tragen somit zur Senkung der Blutviskosität bei, was insbesondere bei niedrigen Schergeschwindigkeiten wichtig ist. Die Disaggregation der Blutzellen verbessert den systemischen Blutfluss und die Mikrozirkulation, insbesondere im venösen Bereich, wo die Geschwindigkeitsgradienten am geringsten sind. Die Anwendung niedermolekularer Dextranlösungen bei verschiedenen Schockzuständen, während der chirurgischen Behandlung von Verletzungen und deren Folgen sowie in der postoperativen Phase trägt dazu bei, Hyperkoagulation zu verhindern und das Risiko thrombotischer Prozesse und Embolien zu verringern.
Es ist jedoch zu beachten, dass Infusionen von Dextranlösungen in einigen Fällen mit anaphylaktischen und allergischen Reaktionen einhergehen (gefährlich bei Sensibilisierung und anaphylaktischem Schock). Dies liegt daran, dass Dextrane mit ihrem hohen Molekulargewicht und vielen Seitenketten als Antigen wirken können. Um die individuelle Empfindlichkeit festzustellen, wird daher empfohlen, vor Beginn der Anästhesie bis zu 20 ml einer niedermolekularen Dextranlösung als Hapten (15%ige Lösung, Molekulargewicht 1000) intravenös zu verabreichen und Infusionen eines Plasmaersatzes durchzuführen.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Thrombininhibitoren
Der pharmakologische Schutz von Thrombozytenrezeptoren, die mit Thrombozytenaktivatoren interagieren, kann auch durch Wirkstoffe erreicht werden, die mit nicht-polymeren Thrombozytenaktivatoren konkurrieren oder diese hemmen. Zu diesen Wirkstoffen gehören Thrombininhibitoren (Heparin und Hirudin, eine Reihe synthetischer Inhibitoren, Adrenalinantagonisten), Alpha-Rezeptorblocker (Phentolamin, Dihydroergotamin), ADP-Antagonisten (Dipyridamol, Adenosin und seine Strukturanaloga, Phosphokreatin) und Serotoninantagonisten (Methysergid). Nur wenige der aufgeführten Wirkstoffe werden tatsächlich zur Vorbeugung und Therapie von Schocks unterschiedlicher Genese eingesetzt.
Der Schutz intrazellulärer Mechanismen der Synthese von Proteinrezeptoren, die mit Aktivatoren der Thrombozytenaggregation und -adhäsion reagieren, sowie die Hemmung von Thromboxansyntheseprozessen sind mit Arzneimitteln verschiedener Gruppen möglich:
- Induktoren und Stabilisatoren von cATP, Prostacyclin und Prostaglandin PgE2;
- Phospholipase- und Phosphodiesterase-Hemmer.
Die intensive Entwicklung spezieller Thrombozytenaggregationshemmer begann erst vor relativ kurzer Zeit und hat noch nicht zu verlässlichen Ergebnissen geführt. Derzeit werden in der klinischen Praxis neben Dextranlösungen häufig Thrombozytenaggregationshemmer wie Acetylsalicylsäure, Indomethacin, Dipyradamol, Sulfinpyrazon (Persantin), Prostacyclin (Eicoprostenon) und Heparin eingesetzt, um die Bildung weißer Thrombozyten zu verhindern.
Nichtsteroidale Antirheumatika
Es wurde festgestellt, dass die pharmakologischen Wirkungen nichtsteroidaler Antirheumatika – Acetylsalicylsäure und Indomethacin – auf ihre Wirkung auf den Stoffwechsel von Eicosanoiden (Thromboxanen und Prostaglandinen) zurückzuführen sind. Fast alle Medikamente dieser Gruppe hemmen den als Prostaglandinsynthetase bekannten Enzymkomplex und entfalten dadurch ihre spezifischen und aggregationshemmenden Wirkungen.
Acetylsalicylsäure wird nach oraler Verabreichung sehr schnell absorbiert. Das Produkt seiner Hydrolyse, Salicylsäure, verursacht eine Hemmung der Thrombozytencyclooxygenase, was die Umwandlung von Arachidonsäure in Prostaglandin O2 und letztendlich Thromboxan A2 stört. Acetylsalicylsäure hemmt die durch Kollagen, ADP, Adrenalin und Serotonin induzierte Aggregation. Obwohl sein GG0 5 15 Minuten beträgt, hält die antiaggregative Wirkung mehrere Tage an, was anscheinend durch die irreversible Hemmung der Prostaglandinsynthesereaktionen und die Unterdrückung der Thrombozytenaggregationsfunktion während ihrer gesamten Lebensdauer (6-10 Tage) erklärt wird. Zusammen mit der Hemmung der Thrombozytencyclooxygenase hemmt Acetylsalicylsäure in hohen Dosen die Cyclooxygenase der Gefäßwand und hemmt gleichzeitig mit der Unterdrückung der Thromboxan-A2-Synthese die Prostacyclinsynthese in Endothelzellen. Daher sollte Acetylsalicylsäure als Antiaggregationsmittel in kleinen Dosen (3000–5000 mg/Tag) verschrieben werden, die vor allem die Thrombozytenaggregation hemmen.
In Anbetracht der Tatsache, dass Acetylsalicylsäure die Thrombozytencyclooxygenase mehrere Tage lang und die endotheliale Cyclooxygenase nicht länger als einen Tag blockiert, ist es sinnvoll, das Medikament nicht täglich, sondern alle 3-4 Tage zu verschreiben. Die Auswahl der optimalen Acetylsalicylsäure-Dosis für den Patienten sollte individuell erfolgen, da die Patienten unterschiedlich empfindlich auf die thrombozytenaggregationshemmende Wirkung des Arzneimittels reagieren. Bei reaktiven Patienten hemmt Acetylsalicylsäure in einer Dosis von 0,5 g die Thrombozytenaggregation um 40–50 %, bei hyperreaktiven Patienten vollständig oder um 80–90 %, und bei areaktiven Patienten ist das Fehlen einer thrombozytenaggregationshemmenden Wirkung bei Einnahme der gleichen Dosis des Arzneimittels charakteristisch.
Selektive Thromboxansynthetasehemmer sind Imidazol und seine Analoga, die die Cyclooxygenase nicht blockieren. Dipyridamol, das in der klinischen Praxis zur Behandlung der chronischen ischämischen Herzkrankheit als Koronardilatator eingesetzt wird, hemmt wie Imidazol selektiv die Thromboxansynthetase und verhindert die Synthese von Thromboxan A2. Es wird angenommen, dass das Arzneimittel und seine Analoga auch die Thrombozytenphosphodiesterase hemmen und dadurch die cAMP-Konzentration in den Thrombozyten erhöhen. Darüber hinaus hemmt Dipyridamol die Aktivität der Adenosindeaminase und die Aufnahme von Adenosin durch Thrombozyten, blockiert die Aufnahme von Serotonin durch Thrombozyten und deren durch Adrenalin und Kollagen induzierte Aggregation. Es gibt Berichte über eine schwache thrombozytenaggregationshemmende Wirkung des Arzneimittels und seine Fähigkeit, in kleinen Dosen die Thrombozytenaggregation zu verstärken. Die zuverlässigste thrombozytenaggregationshemmende Wirkung kann mit einer Kombination aus Dipyridamol und Acetylsalicylsäure erzielt werden.
Heparin
Unter den Antithrombotika ist Heparin einer der wirksamsten Regulatoren des Aggregatzustands des Blutes, insbesondere bei frühzeitiger Anwendung. Heparin hat eine hohe negative Ladung und kann sowohl mit großen als auch mit kleinen Ionen und Molekülen (Enzymen, Hormonen, biogenen Aminen, Plasmaproteinen usw.) interagieren, sodass sein biologisches Wirkungsspektrum recht breit ist. Das Medikament hat Antithrombin-, Antithromboplastin- und Antiprothrombin-Wirkungen, verhindert die Umwandlung von Fibrinogen in Fibrin, unterdrückt die Gerinnselretraktion und erhöht die Fibrinolyse.
Der Mechanismus der gerinnungshemmenden Wirkung von Heparin ist recht komplex. Es wurde nun festgestellt, dass die gerinnungshemmende Wirkung von Heparin mit der Verstärkung der Wirkung von Antithrombin III und der Verbesserung der Fähigkeit des Heparin-Antithrombin-III-Komplexes verbunden ist, die meisten Serinproteasen des Blutgerinnungssystems schnell zu inaktivieren. Für die antithrombotische Wirkung von Heparin ist seine Fähigkeit von großer Bedeutung, ein hohes elektronegatives Potenzial der Gefäßintima zu erhöhen und aufrechtzuerhalten, wodurch die Thrombozytenadhäsion und die Bildung von Thrombozytenmikrothromben verhindert werden. Heparin unterdrückt die Thrombusbildung in Venen am aktivsten und verhindert sowohl die lokale Thrombusbildung als auch die disseminierte intravaskuläre Gerinnung.
Prostacyclin und seine stabilen Analoga
Unter den Thrombozytenaggregationshemmern sind Prostacyclin und seine stabilen Analoga die stärksten Aggregationshemmer. Die thrombozytenaggregationshemmende Wirkung von Prostacyclin beruht auf der Stimulation der Adenylatcyclase und infolgedessen auf einer Erhöhung der cAMP-Konzentration in den Thrombozyten, einer Verringerung des Thromboxan-Gehalts, einer Verringerung des Thromboxan-A2-Gehalts und einer Blockade seiner Rezeptoren. Prostacyclin ist instabil und hydrolysiert schnell zu inaktiven Produkten. Daher wird es intravenös mit einer Rate von 2 bis 20 ng / kg pro Minute für 30-60 Minuten bis zu 6-mal täglich verabreicht.
Prostacyclin hat neben einer starken antiaggregatorischen Wirkung auch eine starke vasodilatatorische und bronchodilatatorische Wirkung. Das Medikament erweitert die Gefäße von Gehirn, Herz, Nieren, Skelettmuskulatur und Mesenterialgefäßen. Unter dem Einfluss von Prostacyclin erhöht sich der koronare Blutfluss, die Energieversorgung des Myokards steigt und sein Sauerstoffbedarf sinkt. Trotz seiner Instabilität im Körper können klinisch günstige Effekte mehrere Wochen und sogar Monate anhalten. Der Mechanismus dieser anhaltenden Wirkung ist noch nicht geklärt.
Prostacyclin ist ein wenig toxisches Medikament, seine Anwendung kann jedoch Nebenwirkungen verursachen: Gesichtsrötung, Kopfschmerzen, Blutdruckabfall, Bauchschmerzen, Anorexie. Neben Prostacyclin sind seine synthetischen stabilen Analoga (Iloprost usw.) vielversprechende Inhibitoren der Thrombozytenaggregation.
Medikamente, die die Blutviskosität verbessern
Störungen der rheologischen Eigenschaften des Blutes bei Trauma und Schock werden nicht nur durch Veränderungen der funktionellen Aktivität der Blutplättchen, sondern auch durch eine Erhöhung der Blutviskosität verursacht. Die Strukturviskosität des Blutes als komplexes, dynamisch verteiltes System wird maßgeblich durch die Viskosität des Plasmas und die Deformationsfähigkeit der Erythrozyten bestimmt. Die Plasmaviskosität hängt hauptsächlich von der Proteinkonzentration im Blut ab. Proteine mit geringem Molekulargewicht, wie Albumin, haben wenig Einfluss auf die Plasmaviskosität, während Proteine mit großem Molekül (Fibrinogen, Alpha- und Gammaglobuline, andere Makromoleküle) diese deutlich erhöhen.
Bei niedrigen Schergeschwindigkeiten führt die Adsorption von Fibrinogen und Globulinen an der Oberfläche von Erythrozyten zur Bildung von Brücken zwischen benachbarten Zellen und zur Bildung von Aggregaten aus Erythrozyten. Die Geschwindigkeit der Aggregatbildung ist ein komplexer biophysikalischer Prozess und hängt nicht nur von der Stärke der Scherung ab, sondern auch von den elektrokinetischen Eigenschaften der Erythrozyten, der Konzentration, Masse und Sorptionskapazität der Makromolekül-Aggregatoren sowie von der Form und Plastizität der Erythrozyten.
Die Erhaltung der Form und der mechanischen Eigenschaften der Erythrozytenmembran erfordert einen erheblichen Energieaufwand. Es wird angenommen, dass die während der Glykolyse in Erythrozyten produzierte Energie für die Phosphorylierung von Spektrin verwendet wird, was zu Veränderungen der Sekundärstruktur des Proteins und zur Interaktion mit benachbarten Komponenten der inneren Membran führt. Die Interaktion zwischen den Strukturproteinen der Membran, Spektrin und Aktin, spielt eine wichtige Rolle bei der Bildung der mechanischen Eigenschaften der Erythrozytenmembran, bei der Aufrechterhaltung einer konstanten Oberfläche des Erythrozyten und seiner Dicke bei jeder Verformung.
Bei systemischen hämodynamischen und Organdurchblutungsstörungen führt die erhöhte Steifigkeit der Erythrozytenmembranen und die Bildung von Erythrozytenaggregaten zu einer Verringerung der Passagegeschwindigkeit der Erythrozyten durch die Kapillaren, wodurch die Gastransportfunktion des Blutes gestört wird. Daher sollte die Korrektur von Störungen der rheologischen Eigenschaften des Blutes im Schockzustand neben der Verhinderung der Erythrozytenaggregation auch die Normalisierung der Plasma- und Blutviskosität sowie der Aggregation und Deformation der Erythrozyten umfassen.
Albuminlösungen zählen neben niedermolekularen Dextrane zu den wirksamsten Mitteln zur Erhöhung der Suspensionsstabilität von Blut. In der Spätphase des Schocks kommt es vor dem Hintergrund einer Abnahme der Albuminkonzentration im Blutplasma und einer Zunahme der Konzentrationen von Fibrinogen und Globulinen, insbesondere der Alpha2-Fraktion, Lipoproteinen und Lipiden, zu einer generalisierten Erythrozytenaggregation. Unter diesen Bedingungen beruhen die rheologischen Effekte von Albumin auf zwei Hauptfaktoren: Hämodilution und Normalisierung des Verhältnisses zwischen mikro- und makroglobulären Proteinen im Plasma. Gleichzeitig bindet Albumin freie Säuren, deren Labilisierung bei Trauma und Schock die Aggregation zellulärer Blutstrukturen und die intravaskuläre Gerinnung stimuliert und eine Fettembolie verursachen kann.
Anti-Schock-Maßnahmen zur Wiederherstellung des zirkulierenden Blutvolumens, zur Beseitigung von Gewebehypoxie und metabolischer Azidose tragen zur Normalisierung der Elastizität der Erythrozytenmembranen bei, da Hypoxie und Azidose die Verformbarkeit der Erythrozyten deutlich reduzieren. Eine erhöhte Steifigkeit der Erythrozytenmembranen im Schockzustand ist wahrscheinlich mit einer Hemmung der ATP-Synthese in Erythrozyten verbunden. Eine Abnahme der ATP-Konzentration wiederum trägt zu einer Erhöhung der Ca2+-Konzentration in Erythrozyten bei, die durch Bindung an Membranproteine die Steifigkeit der Membran erhöht.
Eines der pharmakologischen Arzneimittel, das den ATP-Gehalt in Erythrozyten und die Elastizität der Erythrozytenmembranen erhöht, ist Trental (Pentoxifyllin), das in der klinischen Praxis zur Behandlung ischämischer Erkrankungen eingesetzt wird.
Trental verringert nicht nur die Steifheit der Erythrozytenmembranen, sondern bewirkt auch eine Gefäßerweiterung, verbessert die Sauerstoffversorgung des Gewebes, hemmt die Phosphodiesteraseaktivität im Gewebe, erhöht die cAMP-Konzentration und hemmt die Thrombozytenaggregation.
Unter anderen pharmakologischen Wirkstoffen, die die Elastizität der Erythrozytenmembran aufrechterhalten, sind Ca2+-Antagonisten erwähnenswert, die den Ionenfluss in die Erythrozyten begrenzen (Flunarizin, Nifedipin usw.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Beachtung!
Um die Wahrnehmung von Informationen zu vereinfachen, wird diese Gebrauchsanweisung der Droge "Medikamente zur Verhinderung von Thrombose und zur Verbesserung der Blutfließfähigkeit" übersetzt und in einer speziellen Form auf der Grundlage der offiziellen Anweisungen für die medizinische Verwendung des Medikaments präsentiert . Vor der Verwendung lesen Sie die Anmerkung, die direkt zu dem Medikament kam.
Beschreibung zu Informationszwecken zur Verfügung gestellt und ist kein Leitfaden zur Selbstheilung. Die Notwendigkeit für dieses Medikament, der Zweck des Behandlungsregimes, Methoden und Dosis des Medikaments wird ausschließlich durch den behandelnden Arzt bestimmt. Selbstmedikation ist gefährlich für Ihre Gesundheit.

