Facharzt des Artikels
Neue Veröffentlichungen
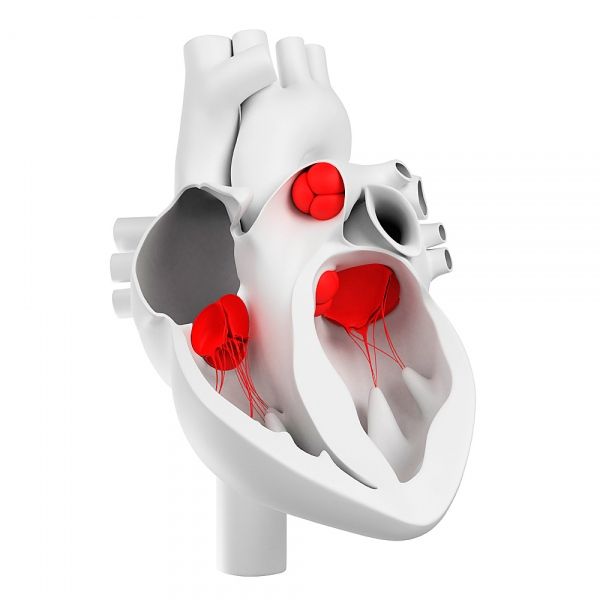
Herzklappen
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Früher ging man davon aus, dass alle Herzklappen einfache Strukturen seien, deren Beitrag zum unidirektionalen Blutfluss lediglich eine passive Bewegung als Reaktion auf einen angelegten Druckgradienten sei. Dieses Verständnis passiver Strukturen führte zur Entwicklung passiver mechanischer und biologischer Klappenersatzprodukte.
Es zeigt sich, dass Herzklappen eine komplexere Struktur und Funktion haben. Daher setzt die Entwicklung eines „aktiven“ Herzklappenersatzes eine signifikante Ähnlichkeit in Struktur und Funktion mit der natürlichen Herzklappe voraus, was dank der Entwicklung des Tissue Engineering in Zukunft durchaus realistisch ist.
Herzklappen entwickeln sich aus embryonalen Rudimenten mesenchymalen Gewebes während der Bildung des Endokards. Während der Morphogenese werden der Atrioventrikularkanal (Trikuspidal- und Mitralklappe) und der ventrikuläre Ausflusstrakt (Aorten- und Pulmonalklappe) ausgebildet.
Wie sind Herzklappen angeordnet?
Die Untersuchung der Blutversorgung der Klappen wurde von N. Luschka (1852) initiiert, der den Herzgefäßen ein Kontrastmittel injizierte. Er entdeckte zahlreiche Blutgefäße in den Segeln der Atrioventrikular- und Taschenklappen der Aorta und der Pulmonalarterie. Gleichzeitig enthielten mehrere Handbücher zur pathologischen Anatomie und Histologie Hinweise darauf, dass unveränderte menschliche Herzklappen keine Blutgefäße enthalten und diese in den Klappen nur bei verschiedenen pathologischen Prozessen auftreten - Arteriosklerose und Endokarditis unterschiedlicher Ätiologie. Informationen über das Fehlen von Blutgefäßen basierten hauptsächlich auf histologischen Untersuchungen. Man ging davon aus, dass bei fehlenden Blutgefäßen im freien Teil der Segel deren Ernährung durch Filterung von Flüssigkeit aus dem Blutplasma erfolgt, das die Segel spült. Es wurde das Eindringen einiger Gefäße zusammen mit Fasern aus quergestreiftem Muskelgewebe in die Basen der Klappen und Sehnen festgestellt.
Bei der Injektion verschiedener Farbstoffe (Tusche in Gelatine, Wismut in Gelatine, wässrige Suspension schwarzer Tusche, Lösungen von Karmin- oder Trypanblau) in Herzgefäße zeigte sich jedoch, dass die Gefäße die Atrioventrikularklappen, die Aortenklappen und die Pulmonalarterie zusammen mit dem Herzmuskelgewebe durchdringen und dabei knapp den freien Rand der Klappe erreichen.
Im lockeren Bindegewebe der Atrioventrikularklappensegel wurden einzelne Hauptgefäße gefunden, die mit Gefäßen in benachbarten Bereichen des quergestreiften Herzmuskelgewebes anastomosierten.
Die meisten Blutgefäße befanden sich an der Basis und eine vergleichsweise kleinere Anzahl im freien Teil dieser Klappen.
Nach KI Kulchitsky et al. (1990) weist die Mitralklappe einen größeren Durchmesser der arteriellen und venösen Gefäße auf. An der Basis der Segel dieser Klappe befinden sich hauptsächlich die Hauptgefäße mit einem engmaschigen Netzwerk von Kapillaren, die in den basalen Teil der Segel eindringen und 10 % ihrer Fläche einnehmen. In der Trikuspidalklappe haben die arteriellen Gefäße einen kleineren Durchmesser als in der Mitralklappe. In den Segeln dieser Klappe befinden sich hauptsächlich verstreute Gefäße und vergleichsweise weite Schleifen von Blutkapillaren. Bei der Mitralklappe wird die vordere Segelklappe intensiver mit Blut versorgt, bei der Trikuspidalklappe die vordere und hintere Segelklappe, die die Hauptschließfunktion erfüllen. Das Verhältnis der Durchmesser der arteriellen und venösen Gefäße in den Atrioventrikularklappen des Herzens erwachsener Menschen beträgt 1:1,5. Die Kapillarschlingen sind polygonal und verlaufen senkrecht zur Basis der Klappensegel. Die Gefäße bilden ein flächiges Netzwerk unter dem Endothel auf der Vorhofseite. Blutgefäße finden sich auch in den Sehnenfäden, wo sie von den Papillarmuskeln des rechten und linken Ventrikels in einer Entfernung von bis zu 30 % der Länge der Sehnenfäden austreten. Zahlreiche Blutgefäße bilden an der Basis der Sehnenfäden bogenförmige Schlingen. Die Herzklappen der Aorta und des Truncus pulmonalis unterscheiden sich hinsichtlich der Blutversorgung deutlich von den Atrioventrikularklappen. Die Hauptgefäße mit relativ kleinerem Durchmesser nähern sich der Basis der Taschensegel der Aorta und der Klappen des Truncus pulmonalis. Die kurzen Äste dieser Gefäße enden in Kapillarschlingen von unregelmäßig ovaler und polygonaler Form. Sie befinden sich hauptsächlich in der Nähe der Basis der Taschensegel. Die venösen Gefäße an der Basis der Aorten- und Pulmonalklappen haben ebenfalls einen kleineren Durchmesser als die an der Basis der Atrioventrikularklappen. Das Verhältnis der Durchmesser der arteriellen und venösen Gefäße in den Aorten- und Pulmonalklappen des Herzens erwachsener Menschen beträgt 1:1,4. Von den größeren Gefäßen gehen kurze Seitenäste ab, die in unregelmäßig ovalen und polygonalen Kapillarschleifen enden.

Mit zunehmendem Alter kommt es zu einer Vergröberung der Bindegewebsfasern, sowohl kollagen als auch elastisch, sowie zu einer Abnahme des losen, faserigen, ungeformten Bindegewebes. Es entwickelt sich eine Sklerose des Gewebes der atrioventrikulären Klappensegel und der Taschensegel der Aorten- und Pulmonalarterienklappen. Die Länge der quergestreiften Herzmuskelfasern in den Klappen nimmt ab, und folglich verringern sich ihre Menge und die Anzahl der die Herzklappen durchdringenden Blutgefäße. Durch diese Veränderungen verlieren die Herzklappen ihre elastischen und federnden Eigenschaften, was den Klappenschlussmechanismus und die Hämodynamik beeinträchtigt.
Die Herzklappen besitzen Netzwerke aus Lymphkapillaren und eine kleine Anzahl von Lymphgefäßen, die mit Klappen ausgestattet sind. Die Lymphkapillaren der Klappensegel haben ein charakteristisches Aussehen: Ihr Lumen ist sehr ungleichmäßig, dieselbe Kapillare hat in verschiedenen Bereichen einen unterschiedlichen Durchmesser. An Stellen, an denen mehrere Kapillaren zusammenlaufen, bilden sich Erweiterungen – Lakunen unterschiedlicher Form. Die Schleifen der Netzwerke sind oft unregelmäßig polygonal, seltener oval oder rund. Oft sind die Schleifen der Lymphnetzwerke nicht geschlossen und die Lymphkapillaren enden blind. Die Schleifen der Lymphkapillaren verlaufen meist vom freien Rand der Klappe zu ihrer Basis. In einigen Fällen wurde in den Klappensegeln der Atrioventrikularklappe ein zweischichtiges Netzwerk aus Lymphkapillaren gefunden.
Die Nervengeflechte des Endokards befinden sich in ihren verschiedenen Schichten, hauptsächlich unter dem Endothel. Am freien Rand der Klappensegel verlaufen die Nervenfasern hauptsächlich radial und verbinden sich mit denen der Sehnenfäden. Näher an der Basis der Segel bildet sich ein großmaschiges Nervengeflecht, das mit dem um die Faserringe gelegenen Geflecht verbunden ist. An den Taschensegeln ist das Nervengeflecht des Endokards spärlicher. An der Ansatzstelle der Klappen wird es dicht und vielschichtig.
Zellstruktur der Herzklappen
Die für die Aufrechterhaltung der Klappenstruktur verantwortlichen interstitiellen Zellen sind länglich und weisen zahlreiche feine Fortsätze auf, die sich durch die gesamte Klappenmatrix ziehen. Es gibt zwei Populationen interstitieller Klappenzellen, die sich in Morphologie und Struktur unterscheiden; die eine hat kontraktile Eigenschaften und ist durch das Vorhandensein kontraktiler Fibrillen gekennzeichnet, die andere hat sekretorische Eigenschaften und verfügt über ein gut entwickeltes endoplasmatisches Retikulum und einen gut entwickelten Golgi-Apparat. Die kontraktile Funktion widersteht dem hämodynamischen Druck und wird zusätzlich durch die Produktion kontraktiler Herz- und Skelettproteine unterstützt, zu denen die schweren Ketten von Alpha- und Beta-Myosin sowie verschiedene Isoformen von Troponin gehören. Eine Kontraktion des Herzklappensegels wurde als Reaktion auf eine Reihe vasoaktiver Substanzen nachgewiesen, was auf einen koordinierten biologischen Stimulus für eine erfolgreiche Klappenfunktion hindeutet.
Interstitielle Zellen sind zudem wesentliche Bestandteile des Reparatursystems von Strukturen wie Herzklappen. Die ständige Bewegung der Klappensegel und die damit verbundene Verformung des Bindegewebes verursachen Schäden, auf die interstitielle Klappenzellen reagieren, um die Integrität der Klappe zu erhalten. Der Reparaturprozess scheint für die normale Klappenfunktion unerlässlich zu sein. Das Fehlen dieser Zellen in aktuellen künstlichen Klappenmodellen trägt wahrscheinlich zur Strukturschädigung von Bioprothesen bei.
Ein wichtiges Forschungsgebiet interstitieller Zellen ist die Untersuchung ihrer Interaktionen mit der umgebenden Matrix, vermittelt durch fokale Adhäsionsmoleküle. Fokale Adhäsionen sind spezialisierte Zell-Matrix-Interaktionsstellen, die das Zellzytoskelett über Integrine mit Matrixproteinen verbinden. Sie fungieren zudem als Signaltransduktionsstellen und leiten mechanische Informationen aus der extrazellulären Matrix weiter, die Reaktionen wie Zelladhäsion, -migration, -wachstum und -differenzierung auslösen können. Das Verständnis der Zellbiologie interstitieller Klappenzellen ist entscheidend für die Aufklärung der Mechanismen, durch die diese Zellen miteinander und mit ihrer Umgebung interagieren, damit diese Funktion in künstlichen Klappen nachgebildet werden kann.
Im Zusammenhang mit der Entwicklung einer vielversprechenden Richtung des Tissue Engineering von Herzklappen werden Untersuchungen an interstitiellen Zellen mit einem breiten Spektrum an Techniken durchgeführt. Das Vorhandensein des Zellzytoskeletts wird durch Färbung mit Vimentin, Desmin, Troponin, Alpha-Aktin und Glattmuskelmyosin, schweren Ketten von Alpha- und Beta-Myosin, leichten Ketten-2 von Herzmyosin sowie Alpha- und Beta-Tubulin bestätigt. Die Zellkontraktilität wird durch eine positive Reaktion auf Adrenalin, Angiotensin II, Bradykinin, Carbachol, Kaliumchlorid und Endothel I bestätigt. Zellinteraktionen werden durch funktionelle Spaltinteraktionen bestimmt und durch Mikroinjektionen von Carboxyfluorescein verifiziert. Die Matrixsekretion wird durch Färbung mit Prolyl-4-Hydroxylase / Kollagen Typ II, Fibronektin, Chondroitinsulfat und Laminin nachgewiesen. Die Innervation wird durch die Nähe der motorischen Nervenendigungen gewährleistet, was sich in der Aktivität von Neuropeptid Y, Tyrosinhydroxylase, Acetylcholinesterase, vasoaktivem intestinalem Polypeptid, Substanz P und Capsicum-Gen-verwandtem Peptid widerspiegelt. Mitogene Faktoren werden durch den Plättchenwachstumsfaktor, den basischen Fibroblastenwachstumsfaktor und Serotonin (5-HT) bestimmt. Die untersuchten interstitiellen Zellfibroblasten zeichnen sich durch eine unvollständige Basalmembran, lange, dünne zytoplasmatische Fortsätze, eine enge Verbindung mit der Matrix, ein gut entwickeltes, ungleichmäßiges endoplasmatisches Retikulum und einen gut entwickelten Golgi-Apparat, einen Reichtum an Mikrofilamenten und die Bildung von Adhäsionsverbindungen aus.
Klappenendokardzellen bilden eine funktionelle athrobogene Hülle um jede Herzklappe, ähnlich dem Gefäßendothel. Die weit verbreitete Methode des Klappenersatzes hebt die Schutzfunktion des Endokards auf, was zu Thrombozyten- und Fibrinablagerungen auf künstlichen Klappen, der Entwicklung bakterieller Infektionen und Gewebeverkalkung führen kann. Eine weitere wahrscheinliche Funktion dieser Zellen ist die Regulierung der darunterliegenden interstitiellen Klappenzellen, ähnlich der Regulierung glatter Muskelzellen durch das Endothel. Es bestehen komplexe Wechselwirkungen zwischen dem Endothel und benachbarten Zellen, die teilweise durch lösliche Faktoren vermittelt werden, die von den Endothelzellen abgesondert werden. Diese Zellen bilden eine riesige, mit Mikroprotrusionen bedeckte Oberfläche auf der luminalen Seite, wodurch die Exposition und mögliche Wechselwirkung mit Stoffwechselsubstanzen im zirkulierenden Blut erhöht wird.
Das Endothel weist häufig morphologische und funktionelle Unterschiede auf, die durch die Scherspannungen an der Gefäßwand aufgrund des Blutflusses verursacht werden. Dies gilt auch für die valvulären Endokardzellen, die entweder eine längliche oder eine polygonale Form annehmen. Veränderungen der Zellstruktur können durch die Einwirkung der lokalen Hämodynamik auf Komponenten des Zellzytoskeletts oder durch Sekundäreffekte aufgrund von Veränderungen der darunter liegenden extrazellulären Matrix auftreten. Auf ultrastruktureller Ebene besitzen valvuläre Endokardzellen interzelluläre Verbindungen, Plasmavesikel, ein raues endoplasmatisches Retikulum und einen Golgi-Apparat. Obwohl sie sowohl in vivo als auch in vitro den Von-Willebrand-Faktor produzieren, fehlen ihnen die Weibel-Palade-Körper (spezifische Granula, die den Von-Willebrand-Faktor enthalten), die für das Gefäßendothel charakteristische Organellen. Charakteristisch für valvuläre Endokardzellen sind starke Verbindungen, funktionelle Spaltinteraktionen und überlappende Randfalten.
Endokardzellen behalten ihre Stoffwechselaktivität auch in vitro: Sie produzieren von-Willebrand-Faktor, Prostacyclin, Stickoxidsynthase, zeigen Angiotensin-Converting-Enzym-Aktivität und sezernieren intensiv die Adhäsionsmoleküle ICAM-1 und ELAM-1, die für die Bindung mononukleärer Zellen während der Entwicklung einer Immunantwort wichtig sind. All diese Marker sollten bei der Züchtung einer idealen Zellkultur zur Herstellung einer künstlichen Herzklappe mittels Tissue Engineering berücksichtigt werden. Das immunstimulierende Potenzial der valvulären Endokardzellen selbst kann jedoch ihren Einsatz einschränken.
Die extrazelluläre Matrix der Herzklappen besteht aus faserigem Kollagen und Elastinmakromolekülen, Proteoglykanen und Glykoproteinen. Kollagen macht 60 % des Trockengewichts der Klappe aus, Elastin 10 % und Proteoglykane 20 %. Die Kollagenkomponente sorgt für die hauptsächliche mechanische Stabilität der Klappe und wird durch Kollagene der Typen I (74 %), II (24 %) und V (2 %) repräsentiert. Bündel von Kollagenfäden sind von einer Elastinhülle umgeben, die Wechselwirkungen zwischen ihnen vermittelt. Die Glykosaminoglykan-Seitenketten von Proteoglykanmolekülen neigen dazu, eine gelartige Substanz zu bilden, in der andere Matrixmoleküle interagieren, um dauerhafte Bindungen zu bilden, und in der andere Komponenten abgelagert werden. Glykosaminoglykane menschlicher Herzklappen bestehen hauptsächlich aus Hyaluronsäure, in geringerem Maße aus Dermatansulfat, Chondroitin-4-sulfat und Chondroitin-6-sulfat und einer minimalen Menge an Heparansulfat. Der Umbau und die Erneuerung des Matrixgewebes werden durch Matrix-Metalloproteinasen (MMPs) und ihre Gewebeinhibitoren (TIs) reguliert. Diese Moleküle sind zudem an einer Vielzahl physiologischer und pathologischer Prozesse beteiligt. Einige Metalloproteinasen, darunter interstitielle Kollagenasen (MMP-1, MMP-13) und Gelatinasen (MMP-2, MMP-9) und ihre Gewebeinhibitoren (TI-1, TI-2, TI-3), kommen in allen Herzklappen vor. Eine übermäßige Produktion von Metalloproteinasen ist charakteristisch für pathologische Zustände der Herzklappe.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Herzklappen und ihre morphologische Struktur
Herzklappen bestehen aus drei morphologisch unterschiedlichen und funktionell bedeutsamen Schichten der Klappenmatrix: der faserigen, der schwammigen und der ventrikulären Schicht.
Die Faserschicht bildet ein belastbares Gerüst für das Klappensegel und besteht aus mehreren Schichten von Kollagenfasern. Diese Fasern sind radial in Falten angeordnet, um die Dehnung der Arterienklappen beim Schließen zu ermöglichen. Die Faserschicht liegt nahe der äußeren Auslassfläche dieser Klappen. Die Faserschicht der Atrioventrikularklappen dient als Fortsetzung der Kollagenbündel der Sehnenfäden. Sie befindet sich zwischen der schwammigen (Einlass-) und der ventrikulären (Auslass-)Schicht.
Zwischen der fibrösen und der ventrikulären Schicht befindet sich die schwammartige Schicht (Spongiosa). Die schwammartige Schicht besteht aus schlecht organisiertem Bindegewebe in einem viskosen Medium. Die dominierenden Matrixkomponenten dieser Schicht sind Proteoglykane mit zufällig angeordnetem Kollagen und dünnen Elastinschichten. Die Seitenketten der Proteoglykanmoleküle tragen eine starke negative Ladung, die ihre hohe Wasserbindungsfähigkeit und die Bildung eines porösen Matrixgels beeinträchtigt. Die schwammartige Schicht der Matrix reduziert die mechanische Belastung der Herzklappensegel und erhält deren Flexibilität.
Die ventrikuläre Schicht ist deutlich dünner als die übrigen und reich an elastischen Fasern, die dem Gewebe Widerstand gegen ständige Verformungen ermöglichen. Elastin hat eine schwammartige Struktur, die die Kollagenfasern umgibt, verbindet und sie in einem neutral gefalteten Zustand hält. Die Eingangsschicht der Klappe (ventrikulär – bei Arterienklappen und schwammartig – bei Atrioventrikulären) enthält mehr Elastin als die Ausgangsschicht, was für die Abschwächung des hydraulischen Stoßes beim Schließen der Klappenklappen sorgt. Dieses Verhältnis von Kollagen und Elastin ermöglicht eine Dehnung der Klappenklappen um bis zu 40 %, ohne dass es zu einer dauerhaften Verformung kommt. Bei geringer Belastung richten sich die Kollagenstrukturen dieser Schicht in Belastungsrichtung aus, und ihre Widerstandsfähigkeit gegen weiteres Belastungswachstum nimmt zu.
Die Vorstellung von Herzklappen als einfachen endokardialen Duplikationen ist daher nicht nur vereinfacht, sondern auch grundsätzlich falsch. Herzklappen sind komplexe Organe, die aus quergestreiften Muskelfasern, Blut- und Lymphgefäßen sowie Nervenelementen bestehen. Sowohl in ihrer Struktur als auch in ihrer Funktion sind die Klappen integraler Bestandteil aller Herzstrukturen. Die Analyse der normalen Klappenfunktion muss ihre zelluläre Organisation sowie die Interaktion der Zellen untereinander und mit der Matrix berücksichtigen. Die aus solchen Studien gewonnenen Erkenntnisse sind richtungsweisend für die Entwicklung von Klappenprothesen mittels Tissue Engineering.

