Facharzt des Artikels
Neue Veröffentlichungen
Fibroelastose
Zuletzt überprüft: 05.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
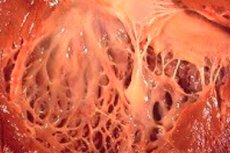
In der Medizin bezeichnet der Begriff „Fibroelastose“ Veränderungen des Bindegewebes, das die Oberfläche innerer Organe und Blutgefäße bedeckt und durch eine Wachstumsstörung elastischer Fasern verursacht wird. Gleichzeitig kommt es zu einer Verdickung der Organwände und ihrer Strukturen, was zwangsläufig die Funktion lebenswichtiger Systeme, insbesondere des Herz-Kreislauf- und Atmungssystems, beeinträchtigt. Dies wiederum führt zu einer Verschlechterung des Wohlbefindens des Patienten, insbesondere bei körperlicher Anstrengung, was sich auf die Lebensqualität und -dauer auswirkt.
Epidemiologie
Generell lassen sich Erkrankungen, die mit Veränderungen des Bindegewebes einhergehen und zu einer Verdickung der Membranen und Septen innerer Organe führen, in zwei Gruppen einteilen: Herzfibroelastose und Lungenfibroelastose. Herzerkrankungen können sowohl angeboren als auch erworben sein; bei der pulmonalen Form der Erkrankung handelt es sich um eine erworbene Erkrankung.
Die pulmonale Fibroelastose entwickelt sich ab dem mittleren Lebensalter (etwa 55–57 Jahre), wobei in der Hälfte der Fälle der Ursprung der Erkrankung im Kindesalter gesucht werden muss. Charakteristisch ist eine leichte Phase, in der keine Krankheitssymptome auftreten. Die Erkrankung ist geschlechtsunabhängig und kann Frauen und Männer gleichermaßen betreffen. Diese eher seltene Erkrankung ist durch Veränderungen des Pleura- und Lungenparenchymgewebes (funktionelle Zellen), vor allem im Oberlappen, gekennzeichnet. Da Ätiologie und Pathogenese der Erkrankung unklar bleiben, wird sie als idiopathische Erkrankung eingestuft. In der medizinischen Terminologie spricht man von einer pleuroparenchymatösen Fibroelastose. [ 1 ]
Kardiale Fibroelastose ist eine allgemeine Bezeichnung für eine Erkrankung der Herzmembranen, die durch deren Verdickung und eingeschränkte Funktionalität gekennzeichnet ist. Angeborene Formen der Erkrankung sind durch eine diffuse (weit verbreitete) Verdickung der inneren Herzmembran gekennzeichnet. Dabei handelt es sich um ein dünnes Bindegewebe, das die Herzhöhle (seine Abschnitte) auskleidet und die Herzklappen bildet.
Bei erwachsenen Patienten wird üblicherweise eine fokale Form der Erkrankung diagnostiziert, bei der die innere Oberfläche des Herzens mit Flecken aus stärkerem und dickerem Gewebe bedeckt zu sein scheint (dazu können nicht nur überwucherte Fasern, sondern auch thrombotische Massen gehören).
Bei der Hälfte der Fälle einer kardialen Fibroelastose kommt es nicht nur zu einer Verdickung der Organwand, sondern auch der Klappen (Mitralklappen zwischen Vorhof und gleichnamiger Herzkammer, Trikuspidalklappen zwischen linker Herzkammer und Aorta, Pulmonalklappen zwischen rechter Herzkammer und Lungenarterie). Dies kann wiederum die Funktion der Klappen beeinträchtigen und zu einer Verengung der im Vergleich zu anderen Herzhöhlen ohnehin kleinen Arterienöffnung führen.
In der medizinischen Terminologie wird die Endokardfibroelastose als Endokardfibroelastose (pränatale Fibroelastose, Endokardsklerose, fetale Endokarditis usw.) bezeichnet. Häufig kann aber auch die mittlere Muskelschicht der Herzmembran an dem Prozess beteiligt sein. [ 2 ]
Anomalien in der Struktur des Myokards (der Muskelschicht des Herzens, bestehend aus Kardiomyozyten), Genmutationen und schwere Infektionsprozesse können eine häufige Form der Fibroelastose verursachen, wenn nicht nur das Endokard, sondern auch das Myokard an dem Prozess beteiligt sind. Normalerweise treten dysplastische Prozesse im Endokard, verursacht durch verschiedene Ursachen, an der Grenze seines Kontakts mit der Muskelmembran auf und stören die Kontraktilität dieser Schicht. In einigen Fällen kommt es sogar zum Einwachsen der inneren Schicht in das Myokard, wobei Kardiomyozyten durch Fibroblasten und Fasern ersetzt werden, was die Leitfähigkeit von Nervenimpulsen und die rhythmische Arbeit des Herzens beeinflusst.
Durch die Kompression der Blutgefäße in der Dicke der Herzmembran durch das verdickte Myokard wird die Ernährung des Myokards gestört (Myokardischämie), was wiederum zur Nekrose des Herzmuskelgewebes führen kann.
Eine endokardiale Fibroelastose mit Schädigung des Herzmyokards wird als subendokardiale oder endomyokardiale Fibroelastose bezeichnet.
Laut Statistik wird bei dieser seltenen Erkrankung in den meisten Fällen (nur 0,007 % aller Neugeborenen) eine Fibroelastose der linken Herzkammer diagnostiziert, obwohl sich der Prozess in einigen Fällen auch auf die rechte Herzkammer und die Vorhöfe einschließlich der sie trennenden Klappen ausbreitet.
Die kardiale Fibroelastose geht häufig mit einer Schädigung großer Herzkranzgefäße einher, die ebenfalls mit Bindegewebe bedeckt sind. Im Erwachsenenalter tritt sie häufig vor dem Hintergrund einer fortschreitenden vaskulären Arteriosklerose auf.
Die Krankheit tritt häufiger in tropischen afrikanischen Ländern bei Bevölkerungen mit niedrigem Lebensstandard auf, was durch schlechte Ernährung, häufige Infektionen und den Verzehr bestimmter Nahrungsmittel und Pflanzen als Nahrungsmittel begünstigt wird.
Eine Verdickung des Endokards wird auch im Endstadium der fibroplastischen Endokarditis Löffler beobachtet, die vor allem Männer mittleren Alters betrifft. Die Pathogenese dieser Erkrankung ist ebenfalls mit Infektionserregern verbunden, die die Entwicklung einer schweren Eosinophilie verursachen, die eher für innere parasitäre Infektionen typisch ist. In diesem Fall kommt es zu Sauerstoffmangel (Hypoxie) im Körpergewebe (vor allem im Herzmuskel und im Gehirn). Trotz der Ähnlichkeit der Symptome der Herzfibroelastose und der fibrösen Endokarditis Löffler betrachten Ärzte sie als völlig unterschiedliche Erkrankungen.
Ursachen Fibroelastose
Fibroelastose bezeichnet Veränderungen des Bindegewebes in lebenswichtigen Organen wie Herz und Lunge. Sie gehen mit Funktionsstörungen einher und beeinträchtigen das Aussehen und den Zustand des Patienten. Ärzte kennen die Krankheit seit Jahrzehnten. Die Fibroelastose der Herzinnenhaut (Endokard) wurde bereits im frühen 18. Jahrhundert beschrieben, und ähnliche Veränderungen in der Lunge wurden zweieinhalb Jahrhunderte später erstmals diskutiert. Über die Ursachen der pathologischen Bindegewebsvermehrung herrscht jedoch noch keine Einigkeit.
Es bleibt unklar, was genau die Störung des Wachstums und der Entwicklung von Bindegewebe verursacht. Wissenschaftler identifizieren jedoch bestimmte Risikofaktoren für solche Veränderungen und betrachten sie als mögliche (aber nicht endgültige) Ursachen der Krankheit.
In der Pathogenese der Lungenfibroelastose, die als Erkrankung älterer Menschen gilt, kommt daher wiederkehrenden infektiösen Läsionen des Organs, die bei der Hälfte der Patienten auftreten, eine besondere Rolle zu. Infektionen provozieren Entzündungen des Lungengewebes und der Pleura, und eine langfristige Entzündung prädisponiert für deren fibröse Transformation.
Bei manchen Patienten ist Fibroelastose in der Familie aufgetreten, was auf eine erbliche Veranlagung schließen lässt. In ihrem Körper wurden unspezifische Autoantikörper nachgewiesen, die langfristige Entzündungsprozesse unklarer Ätiologie auslösen.
Es besteht die Meinung, dass fibröse Veränderungen im Lungengewebe durch eine gastroösophageale Refluxkrankheit verursacht werden können. Dieser Zusammenhang ist jedoch höchstwahrscheinlich indirekt. Es wird auch angenommen, dass das Risiko einer Fibroelastose bei Patienten mit Herz-Kreislauf-Erkrankungen oder Lungenthrombose höher ist.
Lungenfibroelastose im jungen und jugendlichen Alter kann während der Schwangerschaft an sich selbst erinnern. Normalerweise bleibt die Krankheit etwa 10 Jahre oder länger verborgen, kann sich aber auch früher manifestieren, möglicherweise aufgrund der erhöhten Belastung des Körpers der werdenden Mutter und hormoneller Veränderungen, für die es jedoch noch keine genaue Erklärung gibt. Dennoch wurde bei 30 % der untersuchten Patientinnen im gebärfähigen Alter ein ähnliches Bild der Krankheitsentwicklung beobachtet.
Eine Schwangerschaft selbst kann die Krankheit nicht auslösen, sie kann jedoch den Verlauf der Krankheit beschleunigen, was sehr bedauerlich ist, da die Sterblichkeitsrate der Krankheit sehr hoch und die Lebenserwartung bei Fibroelastose kurz ist.
In den meisten Fällen ist die Herzfibroelastose auf Kinderkrankheiten zurückzuführen. Angeborene Pathologien werden bereits in der pränatalen Phase bei einem 4-7 Monate alten Fötus festgestellt, die Diagnose kann jedoch erst nach der Geburt des Kindes bestätigt werden. Bei der Pathogenese dieser Krankheitsform werden mehrere mögliche negative Faktoren berücksichtigt: auf den Fötus übertragene Infektions- und Entzündungserkrankungen der Mutter, Anomalien in der Entwicklung der Herzhäute, Durchblutungsstörungen des Herzgewebes, genetische Mutationen und Sauerstoffmangel.
Es wird angenommen, dass Viren unter den Infektionen den größten pathogenetischen Beitrag zur Entstehung der Herzfibroelastose leisten, da sie sich in Körperzellen einnisten, diese zerstören und die Eigenschaften von Geweben verändern. Das noch nicht ausgebildete Immunsystem des Fötus kann ihn im Gegensatz zur Immunität der werdenden Mutter nicht vor diesen Krankheitserregern schützen. Letztere erleidet möglicherweise keine Folgen einer Virusinfektion, während beim Fötus eine intrauterine Infektion das Auftreten verschiedener Anomalien hervorrufen kann.
Einige Wissenschaftler glauben, dass die entscheidende Rolle bei der Pathogenese der infektiösen Form der Fibroelastose eine Infektion spielt, die den Fötus bis zum Alter von 7 Monaten betrifft. Später kann es nur noch zu entzündlichen Erkrankungen des Herzens (Myokarditis, Endokarditis) kommen.
Anomalien in der Entwicklung der Herzmembranen und -klappen können sowohl durch den Entzündungsprozess als auch durch unzureichende Autoimmunreaktionen hervorgerufen werden, in deren Folge die Zellen des Immunsystems beginnen, körpereigene Zellen anzugreifen.
Genmutationen führen zu einer abnormalen Entwicklung des Bindegewebes, da Gene Informationen über die Struktur und das Verhalten von Proteinstrukturen (insbesondere Kollagen- und Elastinproteinen) enthalten.
Hypoxie und Ischämie des Herzgewebes können eine Folge einer abnormalen Herzentwicklung sein. In diesem Fall spricht man von einer sekundären Fibroelastose, die durch angeborene Herzfehler (AHF) hervorgerufen wird. Dazu gehören Anomalien, die eine Obstruktion (Beeinträchtigung der Durchgängigkeit des Herzens und seiner Gefäße) verursachen:
- Stenose oder Verengung der Aorta in der Nähe der Klappe,
- Aortenisthmusstenose oder segmentale Verengung der Aorta an der Verbindungsstelle zwischen ihrem Bogen und dem absteigenden Abschnitt,
- Atresie oder Fehlen einer natürlichen Öffnung in der Aorta,
- Unterentwicklung des Herzgewebes (meistens der linken Herzkammer, seltener der rechten Herzkammer und der Vorhöfe), die die Pumpfunktion des Herzens beeinträchtigt.
Es besteht die Meinung, dass eine Toxikose während der Schwangerschaft auch als prädisponierender Faktor für die Fibroelastose beim Fötus wirken kann.
In der postnatalen Phase kann die Entwicklung einer Herzfibroelastose durch infektiöse und entzündliche Erkrankungen der Organmembranen, hämodynamische Störungen infolge von Verletzungen, vaskuläre Thromboembolien, Myokardblutungen, Stoffwechselstörungen (erhöhte Fibrinbildung, Protein- und Eisenstoffwechselstörungen: Amyloidose, Hämochromatose) begünstigt werden. Die gleichen Gründe verursachen die Entwicklung der Krankheit bei Erwachsenen.
Pathogenese
Bindegewebe ist ein spezielles Gewebe des menschlichen Körpers, das Bestandteil fast aller Organe ist, aber nicht aktiv an deren Funktionen beteiligt ist. Bindegewebe werden unterstützende und schützende Funktionen zugeschrieben. Es bildet eine Art Skelett (Gerüst, Stroma) und begrenzt die funktionellen Zellen des Organs, wodurch dessen endgültige Form und Größe gewährleistet wird. Dank seiner ausreichenden Festigkeit schützt Bindegewebe die Organzellen zudem vor Zerstörung und Verletzung, verhindert das Eindringen von Krankheitserregern und absorbiert mithilfe spezieller Makrophagenzellen veraltete Strukturen: abgestorbene Gewebezellen, Fremdproteine, Blutbestandteile usw.
Dieses Gewebe kann als Hilfsgewebe bezeichnet werden, da es keine zellulären Elemente enthält, die die Funktionalität eines bestimmten Organs gewährleisten. Dennoch spielt es eine große Rolle im Leben des Körpers. Als Teil der Membranen von Blutgefäßen gewährleistet Bindegewebe die Sicherheit und Funktionalität dieser Strukturen, wodurch die Ernährung und Atmung (Trophäe) des umgebenden Gewebes der inneren Körperumgebung gewährleistet wird.
Es gibt verschiedene Arten von Bindegewebe. Die Membran, die die inneren Organe bedeckt, wird als lockeres Bindegewebe bezeichnet. Es ist eine halbflüssige, farblose Substanz, die wellige Kollagenfasern und gerade Elastinfasern enthält, zwischen denen verschiedene Zelltypen zufällig verstreut sind. Einige dieser Zellen (Fibroblasten) sind für die Bildung faseriger Strukturen verantwortlich, andere (Endotheliozyten und Mastzellen) bilden eine durchscheinende Bindegewebsmatrix und produzieren spezielle Substanzen (Heparin, Histamin), andere (Makrophagen) sorgen für die Phagozytose usw.
Die zweite Art von Bindegewebe ist dichtes Bindegewebe, das nicht viele einzelne Zellen enthält und wiederum in Weiß und Gelb unterteilt ist. Weißes Gewebe besteht aus dicht gepackten Kollagenfasern (Bänder, Sehnen, Periost), und gelbes Gewebe besteht aus chaotisch ineinander verschlungenen Elastinfasern mit Einschlüssen von Fibroblasten (Teil von Bändern, Membranen von Blutgefäßen, Lunge).
Zum Bindegewebe gehören auch Blut, Fett, Knochen und Knorpelgewebe, die uns aber noch nicht interessieren, da wir mit Fibroelastose Veränderungen der Faserstrukturen meinen. Elastische und elastische Fasern kommen nur in lockerem und dichtem Bindegewebe vor.
Die Synthese von Fibroblasten und die Bildung von Bindegewebsfasern aus ihnen wird auf Gehirnebene reguliert. Dies gewährleistet die Konstanz seiner Eigenschaften (Festigkeit, Elastizität, Dicke). Wenn aus pathologischen Gründen die Synthese und Entwicklung von Hilfsgewebe gestört ist (die Anzahl der Fibroblasten nimmt zu, ihr „Verhalten“ ändert sich), kommt es zu einer Vermehrung starker Kollagenfasern oder einer Veränderung des Wachstums elastischer Fasern (sie bleiben kurz, verdrehen sich), was zu einer Veränderung der Eigenschaften der Organmembran und einiger mit Bindegewebe bedeckter innerer Strukturen führt. Sie nehmen eine größere Dicke als nötig an, werden dichter, fester und unelastisch und ähneln dem Bindegewebe in Bändern und Sehnen, dessen Dehnung große Anstrengungen erfordert.
Dieses Gewebe ist nicht dehnbar und schränkt die Organbewegungen ein (automatische rhythmische Bewegungen des Herzens und der Blutgefäße, Größenveränderungen der Lunge beim Ein- und Ausatmen). Dadurch kommt es zu einer Störung der Blutversorgung und der Atmungsorgane, was zu Sauerstoffmangel führt.
Tatsache ist, dass die Blutversorgung des Körpers durch das Herz, das als Pumpe fungiert, und zwei Blutkreislaufkreisläufe gewährleistet wird. Der Lungenkreislauf ist für die Blutversorgung und den Gasaustausch in der Lunge verantwortlich. Von dort gelangt Sauerstoff mit dem Blutfluss zum Herzen und von dort in den Körperkreislauf und verteilt sich im ganzen Körper, wodurch Organe und Gewebe atmen können.
Die elastische Membran, die die Kontraktion des Herzmuskels begrenzt, verringert die Funktionalität des Herzens, das weniger aktiv Blut und damit Sauerstoff pumpt. Bei einer Fibroelastose der Lunge ist deren Belüftung (Osigenation) beeinträchtigt. Es ist klar, dass weniger Sauerstoff ins Blut gelangt, was selbst bei normaler Herzfunktion zu Sauerstoffmangel (Hypoxie) in Geweben und Organen beiträgt. [ 3 ]
Symptome Fibroelastose
Kardiale und pulmonale Fibroelastose sind zwei Krankheitsarten, die durch eine Störung der Fasersynthese im Bindegewebe gekennzeichnet sind. Sie treten an unterschiedlichen Stellen auf, sind aber beide potenziell lebensbedrohlich, da sie mit fortschreitendem oder schwerem Herz- und Atemversagen einhergehen.
Die Lungenfibroelastose ist eine seltene interstitielle Erkrankung dieses wichtigen Organs der Atemwege. Dazu gehören chronische Erkrankungen des Lungenparenchyms mit Schädigung der Alveolarwände (Entzündung, Störung ihrer Struktur und Struktur), der inneren Auskleidung der Lungenkapillaren usw. Fibroelastose wird oft als eine besondere seltene Form der fortschreitenden Lungenentzündung mit einer Tendenz zu faserigen Veränderungen im Lungen- und Pleuragewebe angesehen.
Es ist fast unmöglich, die Krankheit gleich zu Beginn zu erkennen, da sie sich möglicherweise etwa 10 Jahre lang nicht an sich selbst erinnert. Dieser Zeitraum wird als klares Intervall bezeichnet. Das Auftreten pathologischer Veränderungen, die das Lungenvolumen und den Gasaustausch noch nicht beeinträchtigen, kann zufällig bei einer detaillierten Untersuchung der Lunge im Zusammenhang mit einer anderen Erkrankung der Atemwege oder einer Verletzung festgestellt werden.
Die Krankheit ist durch einen langsamen Verlauf der Symptome gekennzeichnet, sodass die ersten Manifestationen der Krankheit nach ihrem Ausbruch erheblich verzögert auftreten können. Die Symptome verstärken sich allmählich.
Die ersten Anzeichen der Krankheit, auf die man achten sollte, sind Husten und zunehmende Kurzatmigkeit. Solche Symptome sind oft die Folge einer früheren Atemwegserkrankung und können daher lange Zeit mit einer Erkältung und ihren Folgen in Verbindung gebracht werden. Kurzatmigkeit wird oft als Herzerkrankung oder altersbedingte Veränderung wahrgenommen. Schließlich wird die Krankheit bei Menschen diagnostiziert, die sich dem Alter nähern.
Sowohl Patienten als auch untersuchende Ärzte können Fehler machen, was zu einer späten Erkennung einer gefährlichen Krankheit führt. Es lohnt sich, auf den Husten zu achten, der bei Fibroelastose unproduktiv ist, aber nicht durch Mukolytika und Expektorantien stimuliert, sondern durch Antitussiva gestoppt wird. Ein anhaltender Husten dieser Art ist ein charakteristisches Symptom der Lungenfibroelastose.
Dyspnoe wird durch fortschreitendes Atemversagen aufgrund einer Verdickung der Alveolarwände und der Pleura sowie einer Abnahme des Volumens und der Anzahl der Alveolarhöhlen in der Lunge verursacht (das Organparenchym ist auf einer Röntgenaufnahme als Wabe sichtbar). Das Symptom verstärkt sich unter dem Einfluss körperlicher Anstrengung, zunächst signifikant, dann sogar geringfügig. Mit fortschreitender Krankheit verschlimmert sie sich, was zu Behinderung und Tod des Patienten führt.
Mit dem Fortschreiten der Fibroelastose geht eine Verschlechterung des Allgemeinzustandes einher: Hypoxie führt zu Schwäche und Schwindel, das Körpergewicht nimmt ab (es entwickelt sich Anorexie), die Nagelphalangen verändern sich in die Art von Trommelstöcken, die Haut wird blass und sieht kränklich aus.
Die Hälfte der Patienten entwickelt unspezifische Symptome wie Atembeschwerden und Brustschmerzen, die für einen Pneumothorax (Ansammlung von Gasen in der Pleurahöhle) charakteristisch sind. Diese Anomalie kann auch als Folge von Verletzungen, primären und sekundären Lungenerkrankungen oder unsachgemäßer Behandlung auftreten und ist daher nicht diagnostizierbar.
Die kardiale Fibroelastose sowie die Pathologie des Bindegewebswachstums in der Lunge sind gekennzeichnet durch: blasse Haut, Gewichtsverlust, Schwäche, die oft paroxysmal ist, und Kurzatmigkeit. Es kann auch anhaltendes subfebriles Fieber ohne Anzeichen einer Erkältung oder Infektion auftreten.
Bei vielen Patienten kommt es zu Veränderungen der Lebergröße. Die Leber vergrößert sich, ohne dass Funktionsstörungen auftreten. Auch Schwellungen der Beine, des Gesichts, der Arme und der Kreuzbeinregion sind möglich.
Eine charakteristische Manifestation der Krankheit ist eine zunehmende Kreislaufinsuffizienz, die mit einer Störung der Herzfunktion einhergeht. In diesem Fall werden Tachykardie (erhöhte Herzfrequenz, oft kombiniert mit Arrhythmie), Kurzatmigkeit (auch bei fehlender körperlicher Aktivität) und Gewebezyanose (bläuliche Färbung aufgrund der Ansammlung von Carboxyhämoglobin im Blut, d. h. einer Verbindung von Hämoglobin mit Kohlendioxid aufgrund einer Störung des Blutflusses und damit des Gasaustausches) diagnostiziert.
In diesem Fall können die Symptome entweder unmittelbar nach der Geburt eines Kindes mit dieser Pathologie oder über einen bestimmten Zeitraum auftreten. Bei älteren Kindern und Erwachsenen treten Anzeichen einer schweren Herzinsuffizienz meist vor dem Hintergrund einer Atemwegsinfektion auf, die als Auslöser fungiert. [ 4 ]
Fibroelastose bei Kindern
Wenn die Lungenfibroelastose eine Erkrankung von Erwachsenen ist, die oft in der Kindheit entsteht, sich aber lange Zeit nicht bemerkbar macht, dann tritt eine ähnliche Pathologie des Endokards des Herzens oft schon vor der Geburt des Babys auf und beeinflusst sein Leben von den ersten Momenten der Geburt an. Diese seltene, aber schwere Pathologie ist die Ursache für die Entwicklung einer schwer zu korrigierenden Herzinsuffizienz bei Säuglingen, von denen viele innerhalb von 2 Jahren sterben. [ 5 ]
Die Endokardiale Fibroelastose bei Neugeborenen ist in den meisten Fällen die Folge pathologischer Prozesse im Körper des Babys während der Schwangerschaft. Infektionen der Mutter, genetische Mutationen, Anomalien in der Entwicklung des Herz-Kreislauf-Systems, erbliche Stoffwechselerkrankungen – all dies kann laut Wissenschaftlern zu Veränderungen des Bindegewebes in den Herzmembranen führen. Insbesondere wenn ein 4-7 Monate alter Fötus zwei oder mehr Faktoren gleichzeitig ausgesetzt ist.
Beispielsweise führt eine Kombination von Entwicklungsstörungen des Herzens und der Herzkranzgefäße (Stenose, Atresie, Aortenisthmusstenose, abnorme Entwicklung von Myokardzellen, Endokardschwäche usw.), die zu einer Gewebeischämie führen, in Kombination mit einem entzündlichen Prozess aufgrund einer Infektion dazu, dass das Kind praktisch keine Überlebenschance mehr oder weniger hat. Während Organentwicklungsdefekte noch zeitnah korrigiert werden können, kann die fortschreitende Fibroelastose nur verlangsamt, aber nicht geheilt werden.
Normalerweise wird eine Herzfibroelastose beim Fötus bereits während der Schwangerschaft während der Ultraschalldiagnostik im zweiten oder dritten Trimester festgestellt. Ultraschall und Echokardiographie in der 20. bis 38. Woche zeigten eine Hyperechogenität, die auf eine Verdickung und Verdichtung des Endokards (normalerweise diffus, seltener fokal), eine Veränderung der Größe und Form des Herzens (das Organ ist vergrößert und nimmt die Form einer Kugel oder Kugel an, die inneren Strukturen werden allmählich geglättet) hinweist. [ 6 ]
In 30-35 % der Fälle wurde eine Fibroelastose vor der 26. Schwangerschaftswoche festgestellt, in 65-70 % in der Folgezeit. Bei mehr als 80 % der Neugeborenen ist die Fibroelastose mit obstruktiven Herzfehlern verbunden, d. h. sie ist trotz der frühen Stadien ihrer Erkennung sekundär. Bei der Hälfte der betroffenen Kinder wurde eine linksventrikuläre Hyperplasie festgestellt, was die hohe Prävalenz der Fibroelastose dieser speziellen Herzstruktur erklärt. Pathologien der Aorta und ihrer Klappe, die bei einem Drittel der Kinder mit Endokardproliferation festgestellt wurden, führen ebenfalls zu einer Vergrößerung (Dilatation) der linken Ventrikelkammer und einer Störung ihrer Funktionalität.
Bei instrumentell bestätigter Herzfibroelastose empfehlen Ärzte einen Schwangerschaftsabbruch. Bei fast allen Kindern, deren Mütter einen medikamentösen Schwangerschaftsabbruch ablehnten, wurden die Krankheitssymptome bestätigt. Die für die Fibroelastose charakteristischen Symptome einer Herzinsuffizienz treten innerhalb eines Jahres auf (selten im 2.-3. Lebensjahr). Bei Kindern mit einer kombinierten Form der Erkrankung zeigen sich bereits in den ersten Lebenstagen Anzeichen einer Herzinsuffizienz.
Angeborene Formen der primären und kombinierten Fibroelastose bei Kindern verlaufen meist schnell mit der Entwicklung einer schweren Herzinsuffizienz. Geringe Aktivität, Lethargie des Kindes, Stillverweigerung aufgrund schneller Müdigkeit, Appetitlosigkeit und vermehrtes Schwitzen deuten auf eine Krankheit hin. All dies führt dazu, dass das Kind nicht gut zunimmt. Die Haut des Babys ist schmerzhaft blass, bei manchen mit einem bläulichen Farbton, am häufigsten im Nasolabialdreieck.
Es gibt Anzeichen einer schwachen Immunität, sodass solche Kinder häufig und schnell Atemwegsinfektionen bekommen, was die Situation komplizierter macht. Manchmal zeigt das Kind in den ersten Tagen und Monaten seines Lebens keine Durchblutungsstörungen, aber häufige Infektionen und Lungenerkrankungen können zu einer Herzinsuffizienz führen.
Zusätzliche Gesundheitsuntersuchungen bei Neugeborenen und Kleinkindern mit Verdacht auf Fibroelastose oder einer bereits diagnostizierten Fibroelastose zeigten niedrigen Blutdruck (Hypotonie), vergrößerte Herzgröße (Kardiomegalie), gedämpfte Töne beim Abhören des Herzens, manchmal systolisches Herzgeräusch, charakteristisch für eine Mitralklappeninsuffizienz, Tachykardie und Dyspnoe. Beim Abhören der Lunge zeigt sich pfeifendes Atmen, das auf eine Stauung hinweist.
Eine endokardiale Schädigung der linken Herzkammer führt häufig zu einer Schwächung der Herzmuskelschicht (Myokard). Der normale Herzrhythmus besteht aus zwei rhythmisch abwechselnden Tönen. Bei Fibroelastose kann ein dritter (und manchmal vierter) Ton auftreten. Ein solcher pathologischer Rhythmus ist deutlich hörbar und ähnelt in seinem Klang dem Dreitakt eines Pferdes (Galopp), weshalb er als Galopprhythmus bezeichnet wird.
Ein weiteres Symptom der Fibroelastose bei Kleinkindern ist das Auftreten eines Herzbuckels. Tatsache ist, dass die Rippen des Kindes in der frühen postnatalen Phase nicht verknöchert bleiben und durch Knorpelgewebe repräsentiert werden. Die Vergrößerung des Herzens führt dazu, dass es beginnt, auf die „weichen“ Rippen zu drücken, wodurch diese sich verbiegen und eine dauerhaft nach vorne gekrümmte Form (Herzbuckel) annehmen. Bei der Fibroelastose bei Erwachsenen bildet sich aufgrund der Stärke und Steifheit des Knochengewebes der Rippen selbst bei einer Vergrößerung aller Herzstrukturen kein Herzbuckel.
Die Bildung eines Herzhöckers an sich weist lediglich auf einen angeborenen Herzfehler hin, ohne dessen Natur näher zu spezifizieren. In jedem Fall ist es jedoch mit einer Vergrößerung des Herzens und seiner Ventrikel verbunden.
Das Ödemsyndrom bei Fibroelastose wird bei Kindern selten diagnostiziert, bei vielen Kindern kommt es jedoch zu einer Vergrößerung der Leber, die durchschnittlich 3 cm unter dem Rand des Rippenbogens hervorzutreten beginnt.
Wenn eine Fibroelastose erworben wird (z. B. eine Folge entzündlicher Erkrankungen der Herzmembranen), schreitet das Krankheitsbild meist langsam fort. Für einige Zeit können die Symptome vollständig fehlen, dann treten schwache Anzeichen einer Herzfunktionsstörung in Form von Kurzatmigkeit bei körperlicher Anstrengung, erhöhter Herzfrequenz, schneller Ermüdung und geringer körperlicher Ausdauer auf. Wenig später beginnt sich die Leber zu vergrößern, es treten Ödeme und Schwindel auf.
Alle Symptome der erworbenen Fibroelastose sind unspezifisch, was die Diagnose der Krankheit erschwert und an Kardiomyopathie, Leber- und Nierenerkrankungen erinnert. Die Krankheit wird am häufigsten im Stadium einer schweren Herzinsuffizienz diagnostiziert, was sich negativ auf die Behandlungsergebnisse auswirkt.
Komplikationen und Konsequenzen
Es sollte gesagt werden, dass die Fibroelastose des Herzens und der Lunge schwerwiegende Erkrankungen sind, deren Verlauf von verschiedenen Umständen abhängt. Angeborene Herzfehler erschweren die Situation erheblich. Diese können in jungen Jahren operativ behoben werden, gleichzeitig besteht jedoch ein relativ hohes Sterberisiko (ca. 10 %).
Es wird angenommen, dass die Folgen umso schwerwiegender sind, je früher sich die Krankheit entwickelt. Dies wird durch die Tatsache bestätigt, dass die angeborene Fibroelastose in den meisten Fällen einen fulminanten oder akuten Verlauf mit schnell fortschreitender Herzinsuffizienz hat. Die Entwicklung einer akuten Herzinsuffizienz bei einem Kind unter 6 Monaten gilt als schlechtes prognostisches Zeichen.
Die Behandlung garantiert jedoch keine vollständige Wiederherstellung der Herzfunktion, sondern verlangsamt lediglich das Fortschreiten der Symptome der Herzinsuffizienz. Andererseits führt das Fehlen einer solchen unterstützenden Behandlung innerhalb der ersten zwei Lebensjahre des Babys zum Tod.
Wird in den ersten Tagen und Monaten des Lebens eines Babys eine Herzinsuffizienz festgestellt, überlebt das Kind höchstwahrscheinlich nicht einmal eine Woche. Das Ansprechen auf die Behandlung ist bei Kindern unterschiedlich. Ohne therapeutischen Effekt besteht praktisch keine Hoffnung. Mit der bereitgestellten Hilfe ist die Lebenserwartung eines kranken Kindes jedoch kurz (von mehreren Monaten bis zu mehreren Jahren).
Operationen und Korrekturen angeborener Herzfehler, die eine Fibroelastose verursacht haben, verbessern in der Regel den Zustand des Patienten. Bei erfolgreicher chirurgischer Behandlung der linksventrikulären Hyperplasie und Einhaltung der ärztlichen Vorgaben kann die Erkrankung einen gutartigen Verlauf nehmen: Die Herzinsuffizienz verläuft chronisch und ohne Anzeichen einer Progression. Die Hoffnung auf ein solches Ergebnis ist jedoch gering.
Die erworbene Form der Herzfibroelastose wird schnell chronisch und schreitet allmählich fort. Medikamente können den Prozess verlangsamen, aber nicht stoppen.
Die Lungenfibroelastose beginnt, unabhängig vom Zeitpunkt des Auftretens von Veränderungen im Parenchym und den Membranen des Organs nach der Lichtperiode, rasch fortzuschreiten und führt innerhalb weniger Jahre zum Tod eines Menschen, was zu schwerem Atemversagen führt. Das Traurige ist, dass bisher keine wirksamen Behandlungsmethoden für die Krankheit entwickelt wurden. [ 7 ]
Diagnose Fibroelastose
Die Endomyokardfibroelastose, deren Symptome meist schon im frühen Kindesalter erkannt werden, ist eine angeborene Erkrankung. Wenn wir jene seltenen Fälle ausschließen, in denen sich die Krankheit im späten Kindes- und Erwachsenenalter als Komplikation von Verletzungen und somatischen Erkrankungen zu entwickeln begann, ist es möglich, die Pathologie bereits in der pränatalen Phase, also vor der Geburt des Kindes, zu identifizieren.
Ärzte gehen davon aus, dass pathologische Veränderungen des Endokardgewebes, Veränderungen der Form des fetalen Herzens und einige für die Fibroelastose charakteristische Merkmale seiner Funktion bereits in der 14. Schwangerschaftswoche festgestellt werden können. Dies ist jedoch immer noch ein relativ kurzer Zeitraum, und es ist nicht auszuschließen, dass sich die Krankheit etwas später, näher am dritten Schwangerschaftstrimester und manchmal einige Monate vor der Geburt manifestiert. Aus diesem Grund wird bei der Überwachung schwangerer Frauen empfohlen, im Abstand von mehreren Wochen klinische Ultraschalluntersuchungen des fetalen Herzens durchzuführen.
Anhand welcher Anzeichen können Ärzte die Krankheit beim nächsten Ultraschall vermuten? Viel hängt von der Form der Erkrankung ab. Am häufigsten wird eine Fibroelastose im Bereich des linken Ventrikels diagnostiziert, diese Struktur ist jedoch nicht immer vergrößert. Die dilatative Form der Erkrankung mit vergrößertem linken Ventrikel lässt sich bei einer Ultraschalluntersuchung leicht an der Kugelform des Herzens erkennen, dessen Spitze durch den linken Ventrikel repräsentiert wird, an der allgemeinen Vergrößerung des Organs und an der Vorwölbung des interventrikulären Septums in Richtung des rechten Ventrikels. Das Hauptsymptom einer Fibroelastose ist jedoch eine Verdickung des Endokards sowie der Herzsepten mit einer charakteristischen Zunahme der Echogenität dieser Strukturen, die durch eine spezielle Ultraschalluntersuchung festgestellt wird.
Die Studie wird mit speziellen Ultraschallgeräten mit kardiologischen Programmen durchgeführt. Die fetale Echokardiographie schadet weder der Mutter noch dem ungeborenen Kind, ermöglicht aber nicht nur die Erkennung anatomischer Veränderungen des Herzens, sondern auch die Bestimmung des Zustands der Herzkranzgefäße, des Vorhandenseins von Blutgerinnseln in ihnen und Veränderungen der Dicke der Herzmembranen.
Eine fetale Echokardiographie wird nicht nur bei Abweichungen bei der Entschlüsselung der Ultraschallergebnisse verordnet, sondern auch bei einer Infektion der Mutter (insbesondere einer Virusinfektion), der Einnahme starker Medikamente, einer erblichen Veranlagung, dem Vorliegen von Stoffwechselstörungen sowie angeborenen Herzerkrankungen bei älteren Kindern.
Die fetale Echokardiographie kann auch andere angeborene Formen der Fibroelastose erkennen. Zum Beispiel die Fibroelastose des rechten Ventrikels, ein weit verbreiteter Prozess mit gleichzeitiger Schädigung des linken Ventrikels und angrenzender Strukturen: des rechten Ventrikels, der Herzklappen, der Vorhöfe, kombinierte Formen der Fibroelastose, die endomyokardiale Fibroelastose mit Verdickung der inneren Auskleidung der Ventrikel und Beteiligung eines Teils des Myokards am pathologischen Prozess (normalerweise kombiniert mit einer Thrombose der Wand).
Eine im pränatalen Alter festgestellte Endokardiale Fibroelastose hat eine sehr schlechte Prognose, daher empfehlen Ärzte in diesem Fall einen Schwangerschaftsabbruch. Die Möglichkeit einer Fehldiagnose wird durch eine erneute Ultraschalluntersuchung des fetalen Herzens ausgeschlossen, die 4 Wochen nach der ersten Untersuchung, die die Pathologie aufgedeckt hat, durchgeführt wird. Es ist klar, dass die endgültige Entscheidung über Abbruch oder Aufrechterhaltung der Schwangerschaft bei den Eltern liegt, aber sie müssen sich bewusst sein, zu welchem Leben sie das Kind verurteilen.
Eine Endokardiale Fibroelastose wird während der Schwangerschaft nicht immer erkannt, insbesondere angesichts der Tatsache, dass sich nicht alle werdenden Mütter in einer Frauenklinik anmelden und sich einer vorbeugenden Ultraschalldiagnostik unterziehen. Die Erkrankung des Kindes im Mutterleib hat praktisch keinen Einfluss auf den Zustand der Schwangeren, sodass die Geburt eines kranken Babys oft zu einer unangenehmen Überraschung wird.
In manchen Fällen erfahren Eltern und Ärzte erst Monate nach der Geburt von der Erkrankung des Babys. In diesem Fall zeigen Laborblutuntersuchungen möglicherweise nichts außer einem Anstieg der Natriumkonzentration (Hypernatriämie). Ihre Ergebnisse sind jedoch hilfreich für die Differentialdiagnostik zum Ausschluss entzündlicher Erkrankungen.
Es besteht noch Hoffnung auf instrumentelle Diagnostik. Eine Standarduntersuchung des Herzens (EKG) ist bei Fibroelastose nicht besonders aussagekräftig. Sie hilft, Störungen des Herzens und der elektrischen Leitfähigkeit des Herzmuskels zu identifizieren, nennt aber nicht die Ursachen solcher Störungen. So deutet eine Veränderung der EKG-Spannung (in jüngeren Jahren ist sie meist unterbewertet, in höherem Alter hingegen übermäßig hoch) auf eine Kardiomyopathie hin, die nicht nur mit Herzerkrankungen, sondern auch mit Stoffwechselstörungen einhergehen kann. Tachykardie ist ein Symptom von Herzerkrankungen. Und wenn beide Herzkammern betroffen sind, kann das Kardiogramm im Allgemeinen normal erscheinen. [ 8 ]
Die Computertomographie (CT) ist ein hervorragendes nichtinvasives Instrument zum Erkennen kardiovaskulärer Verkalkung und zum Ausschluss einer Perikarditis.[ 9 ]
Die Magnetresonanztomographie (MRT) kann zum Nachweis einer Fibroelastose hilfreich sein, da die Biopsie invasiv ist. Ein hypointenser Randsaum in einer Myokardperfusionssequenz und ein hyperintenser Randsaum in einer verzögerten Kontrastmittelanreicherungssequenz deuten auf eine Fibroelastose hin.[ 10 ]
Dies bedeutet jedoch nicht, dass die Studie abgebrochen werden sollte, da sie hilft, die Art der Herzarbeit und das Ausmaß der Entwicklung einer Herzinsuffizienz zu bestimmen.
Wenn Symptome einer Herzinsuffizienz auftreten und der Patient diesbezüglich einen Arzt konsultiert, wird ihm zusätzlich Folgendes verschrieben: Röntgenaufnahme des Brustkorbs, Computertomographie oder Magnetresonanztomographie des Herzens, Echokardiographie (EchoCG). In Zweifelsfällen ist eine Biopsie des Herzgewebes mit anschließender histologischer Untersuchung erforderlich. Die Diagnose ist sehr schwerwiegend und erfordert daher den gleichen Diagnoseansatz, obwohl sich die Behandlung kaum von der symptomatischen Therapie bei koronarer Herzkrankheit und Herzinsuffizienz unterscheidet.
Aber selbst eine solch sorgfältige Untersuchung ist nicht sinnvoll, wenn ihre Ergebnisse nicht in der Differentialdiagnostik verwendet werden. EKG-Ergebnisse können verwendet werden, um eine akute Fibroelastose von einer idiopathischen Myokarditis, einer exsudativen Perikarditis und einer Aortenstenose zu unterscheiden. Gleichzeitig zeigen Labortests keine Anzeichen einer Entzündung (Leukozytose, erhöhte BSG usw.) und Temperaturmessungen zeigen keine Hyperthermie.
Durch die Analyse der Herztöne und Herzgeräusche, der Größenveränderungen der Vorhöfe und die Erhebung der Anamnese lässt sich eine Endokardfibroelastose von einer isolierten Mitralklappeninsuffizienz bzw. einem Mitralklappendefekt unterscheiden.
Die Analyse anamnestischer Daten ist hilfreich, um zwischen Fibroelastose und Herz- und Aortenstenose zu unterscheiden. Bei einer Aortenstenose ist zudem auf den Erhalt des Sinusrhythmus und das Fehlen einer Thromboembolie zu achten. Auch bei einer exsudativen Perikarditis werden Herzrhythmusstörungen und Thrombusablagerungen nicht beobachtet, die Erkrankung äußert sich jedoch in Temperaturanstieg und Fieber.
Die größte Schwierigkeit besteht in der Differenzierung zwischen der endokardialen Fibroelastose und der kongestiven Kardiomyopathie. Dabei weist die Fibroelastose, obwohl sie in den meisten Fällen nicht mit ausgeprägten Reizleitungsstörungen einhergeht, eine ungünstigere Behandlungsprognose auf.
Bei kombinierten Pathologien ist auf Abweichungen bei Tomographie oder Ultraschall des Herzens zu achten, da angeborene Defekte den Verlauf der Fibroelastose erheblich erschweren. Wird in der intrauterinen Phase eine kombinierte endokardiale Fibroelastose festgestellt, ist eine Fortführung der Schwangerschaft nicht sinnvoll. Ein Schwangerschaftsabbruch ist wesentlich humaner.
Diagnose der Lungenfibroelastose
Die Diagnose einer Lungenfibroelastose erfordert ebenfalls bestimmte Kenntnisse und Fähigkeiten des Arztes. Die Krankheitssymptome sind sehr heterogen. Einerseits deuten sie auf eine kongestive Lungenerkrankung hin (unproduktiver Husten, Kurzatmigkeit), andererseits können sie auch Ausdruck einer Herzerkrankung sein. Daher kann die Diagnose der Krankheit nicht allein auf die Feststellung von Symptomen und Auskultation beschränkt werden.
Blutuntersuchungen des Patienten helfen, entzündliche Lungenerkrankungen auszuschließen, geben jedoch keine Auskunft über quantitative und qualitative Veränderungen im Gewebe. Das Vorhandensein von Anzeichen einer Eosinophilie hilft, die Krankheit von einer Lungenfibrose zu unterscheiden, die in ihren Manifestationen ähnlich ist, weist jedoch die Tatsache einer Fibroelastose nicht zurück oder bestätigt sie.
Als aussagekräftiger gelten instrumentelle Untersuchungen: Röntgenaufnahmen des Brustkorbs und tomographische Untersuchungen der Atmungsorgane sowie Funktionsanalysen, die aus der Bestimmung des Atemvolumens, der Vitalkapazität der Lunge und des Drucks im Organ bestehen.
Bei einer Lungenfibroelastose ist auf die Abnahme der äußeren Atmungsfunktion zu achten, die während der Spirometrie gemessen wird. Die Abnahme der aktiven Alveolarhöhlen beeinträchtigt die Vitalkapazität der Lunge (VCL) erheblich, und die Verdickung der Wände innerer Strukturen beeinträchtigt die Diffusionskapazität des Organs (DCL), die die Ventilations- und Gasaustauschfunktionen gewährleistet (vereinfacht ausgedrückt: Aufnahme von Kohlendioxid aus dem Blut und Abgabe von Sauerstoff).
Charakteristische Anzeichen einer pleuroparenchymalen Fibroelastose sind eine Kombination aus eingeschränktem Luftstrom in die Lunge (Obstruktion) und beeinträchtigter Lungenausdehnung beim Einatmen (Restriktion), Verschlechterung der äußeren Atemfunktion und mittelschwerer pulmonaler Hypertonie (erhöhter Druck in der Lunge), die bei der Hälfte der Patienten diagnostiziert wird.
Eine Lungengewebebiopsie zeigt charakteristische Veränderungen in der inneren Struktur des Organs. Dazu gehören: Fibrose der Pleura und des Parenchyms in Kombination mit Elastose der Alveolarwände, Ansammlung von Lymphozyten im Bereich der verdichteten Alveolarsepten, Transformation von Fibroblasten in für sie untypisches Muskelgewebe und das Vorhandensein von ödematöser Flüssigkeit.
Das Tomogramm zeigt Lungenschäden in den oberen Abschnitten in Form von Pleuraverdichtungsherden und strukturellen Veränderungen im Parenchym. Das vergrößerte Bindegewebe der Lunge ähnelt in Farbe und Eigenschaften dem Muskelgewebe, das Lungenvolumen nimmt jedoch ab. Im Parenchym finden sich recht große lufthaltige Hohlräume (Zysten). Charakteristisch sind eine irreversible fokale (oder diffuse) Erweiterung der Bronchien und Bronchiolen (Traktionsbronchiektasien) und eine niedrige Position der Zwerchfellkuppel.
Röntgenologische Untersuchungen zeigen bei vielen Patienten Milchglas- und Wabenlungen, was auf eine ungleichmäßige Belüftung der Lunge aufgrund von Gewebeverdichtungen hindeutet. Etwa die Hälfte der Patienten weist vergrößerte Lymphknoten und eine vergrößerte Leber auf.
Die Lungenfibroelastose muss von einer Fibrosenerkrankung durch parasitäre Infektion und damit verbundener Eosinophilie, einer Endokardfibroelastose, Lungenerkrankungen mit eingeschränkter Ventilation und einem „Wabenlungen“-Bild, der Autoimmunerkrankung Histicotitis X (eine Form dieser Pathologie mit Lungenschädigung wird als Hand-Schüller-Christian-Krankheit bezeichnet), Manifestationen einer Sarkoidose und einer Lungentuberkulose unterschieden werden.
Behandlung Fibroelastose
Fibroelastose gilt, unabhängig von ihrem Standort, als gefährliche und praktisch unheilbare Krankheit. Pathologische Veränderungen der Pleura und des Lungenparenchyms lassen sich mit Medikamenten nicht beheben. Und selbst die Anwendung hormoneller Antirheumatika (Kortikosteroide) in Kombination mit Bronchodilatatoren führt nicht zum gewünschten Ergebnis. Bronchodilatatoren lindern den Zustand des Patienten ein wenig und lindern das obstruktive Syndrom. Sie beeinflussen jedoch nicht die in der Lunge ablaufenden Prozesse und können daher nur als unterstützende Therapie eingesetzt werden.
Auch die chirurgische Behandlung der Lungenfibroelastose ist wirkungslos. Die einzige Operation, die die Situation ändern könnte, ist eine Organtransplantation. Doch eine Lungentransplantation hat leider die gleiche ungünstige Prognose. [ 11 ]
Laut ausländischen Wissenschaftlern kann Fibroelastose auch als eine der häufigen Komplikationen einer Lungen- oder Knochenmarkstammzelltransplantation angesehen werden. In beiden Fällen kommt es zu Veränderungen der Bindegewebsfasern der Lunge, die die Funktion der äußeren Atmung beeinträchtigen.
Die Krankheit schreitet ohne Behandlung fort (und eine wirksame Behandlung fehlt derzeit), und etwa 40 % der Patienten sterben innerhalb von 1,5 bis 2 Jahren an Atemversagen. Die Lebenserwartung der Verbliebenen ist ebenfalls stark eingeschränkt (bis zu 10 bis 20 Jahre), ebenso wie ihre Arbeitsfähigkeit. Die Person wird behindert.
Auch die Herzfibroelastose gilt als medizinisch unheilbare Erkrankung, insbesondere wenn es sich um eine angeborene Pathologie handelt. Kinder werden in der Regel nicht älter als zwei Jahre. Sie können nur durch eine Herztransplantation gerettet werden, die an sich schon eine schwierige Operation mit hohem Risiko und unvorhersehbaren Folgen ist, insbesondere in so jungen Jahren.
Bei manchen Babys ist es möglich, angeborene Herzfehler chirurgisch zu korrigieren, sodass sie den Zustand des kranken Kindes nicht verschlechtern. Bei einer Stenose der Arterie wird ein Gefäßdilatator installiert – ein Shunt (aortokoronarer Bypass). Bei einer Erweiterung der linken Herzkammer wird deren Form schnell wiederhergestellt. Aber selbst eine solche Operation garantiert nicht, dass das Kind auf eine Transplantation verzichten kann. Etwa 20–25 % der Babys überleben und leiden ihr Leben lang an Herzinsuffizienz, d. h. sie gelten als nicht gesund.
Wenn die Krankheit erworben wird, lohnt es sich, mit Hilfe von Medikamenten um das Leben des Kindes zu kämpfen. Es ist jedoch wichtig zu verstehen, dass es umso schwieriger ist, sie zu bekämpfen, je früher sich die Krankheit manifestiert.
Die medikamentöse Behandlung zielt darauf ab, Exazerbationen der Herzinsuffizienz zu bekämpfen und zu verhindern. Den Patienten werden folgende Herzmedikamente verschrieben:
- Angiotensin-Converting-Enzym (ACE)-Hemmer, die den Blutdruck beeinflussen und ihn im Normbereich halten (Captopril, Enalapril, Benazepril usw.),
- Betablocker zur Behandlung von Herzrhythmusstörungen, arterieller Hypertonie und zur Vorbeugung von Herzinfarkten (Anaprilin, Bisoprolol, Metoprolol),
- Herzglykoside, die bei längerer Anwendung nicht nur die Herzfunktion unterstützen (den Kaliumgehalt in Kardiomyozyten erhöhen und die Myokardleitfähigkeit verbessern), sondern auch den Grad der Endokardverdickung etwas verringern können (Digoxin, Gitoxin, Strophanthin),
- kaliumsparende Diuretika (Spironolacton, Veroshpiron, Decriz), die Gewebeödeme verhindern,
- antithrombotische Therapie mit Antikoagulanzien (Cardiomagnyl, Magnicor), die der Bildung von Blutgerinnseln und Durchblutungsstörungen in den Herzkranzgefäßen vorbeugt.
Bei der angeborenen Form der Endokardfibroelastose fördert eine unterstützende Behandlung zwar nicht die Genesung, reduziert aber das Sterberisiko durch Herzversagen oder Thromboembolie um 70-75 %. [ 12 ]
Medikamente
Wie wir sehen, unterscheidet sich die Behandlung der Endokardfibroelastose praktisch nicht von der einer Herzinsuffizienz. In beiden Fällen berücksichtigen Kardiologen den Schweregrad der Kardiopathie. Die Verschreibung von Medikamenten erfolgt streng individuell und berücksichtigt das Alter des Patienten, Begleiterkrankungen, Form und Grad der Herzinsuffizienz.
Bei der Behandlung der erworbenen Endokardfibroelastose werden Medikamente aus fünf Gruppen eingesetzt. Betrachten wir ein Medikament aus jeder Gruppe.
"Enalapril" ist ein Medikament aus der Gruppe der ACE-Hemmer, das in Tablettenform in verschiedenen Dosierungen erhältlich ist. Das Medikament erhöht den koronaren Blutfluss, erweitert die Arterien, senkt den Blutdruck, ohne die Hirndurchblutung zu beeinträchtigen, verlangsamt und reduziert die Expansion des linken Ventrikels des Herzens. Das Medikament verbessert die Durchblutung des Myokards, reduziert die Auswirkungen von Ischämie, reduziert leicht die Blutgerinnung, verhindert die Bildung von Blutgerinnseln und hat eine leicht harntreibende Wirkung.
Bei Herzinsuffizienz wird das Arzneimittel für einen Zeitraum von mehr als sechs Monaten oder dauerhaft verschrieben. Die Behandlung beginnt mit einer Mindestdosis (2,5 mg) und wird alle 3-4 Tage schrittweise um 2,5–5 mg erhöht. Die Dauerdosis ist diejenige, die vom Patienten gut vertragen wird und den Blutdruck im Normbereich hält.
Die maximale Tagesdosis beträgt 40 mg. Sie kann einmal eingenommen oder auf zwei Dosen aufgeteilt werden.
Bei einem unterdurchschnittlichen Blutdruck wird die Dosis schrittweise reduziert. Die Behandlung mit Enalapril sollte nicht abrupt beendet werden. Es wird empfohlen, eine Erhaltungsdosis von 5 mg pro Tag einzunehmen.
Das Medikament ist zur Behandlung erwachsener Patienten bestimmt, kann aber auch einem Kind verschrieben werden (die Sicherheit ist nicht offiziell erwiesen, aber im Falle einer Fibroelastose steht das Leben eines kleinen Patienten auf dem Spiel, daher wird das Risikoverhältnis berücksichtigt). Der ACE-Hemmer wird Patienten mit Unverträglichkeit der Bestandteile des Arzneimittels, mit Porphyrie, Schwangerschaft und Stillzeit nicht verschrieben. Wenn der Patient zuvor während der Einnahme von Arzneimitteln dieser Gruppe ein Quincke-Ödem hatte, ist Enalapril verboten.
Vorsicht ist geboten, wenn das Arzneimittel Patienten mit Begleiterkrankungen verschrieben wird: schwere Nieren- und Lebererkrankungen, Hyperkaliämie, Hyperaldosteronismus, Aorten- oder Mitralklappenstenose, systemische Bindegewebserkrankungen, Herzischämie, Hirnerkrankungen, Diabetes mellitus.
Nehmen Sie während der Behandlung mit dem Medikament keine herkömmlichen Diuretika ein, um Dehydration und eine starke blutdrucksenkende Wirkung zu vermeiden. Die gleichzeitige Verabreichung mit kaliumsparenden Diuretika erfordert eine Dosisanpassung, da ein hohes Risiko für Hyperkaliämie besteht, die wiederum Herzrhythmusstörungen, Krampfanfälle, verminderten Muskeltonus, erhöhte Schwäche usw. hervorruft.
Das Medikament "Enalapril" wird im Allgemeinen gut vertragen, bei einigen Patienten können jedoch Nebenwirkungen auftreten. Die häufigsten sind: starker Blutdruckabfall bis hin zum Kollaps, Kopfschmerzen und Schwindel, Schlafstörungen, erhöhte Müdigkeit, reversibler Verlust des Gleichgewichts, des Hör- und Sehvermögens, Auftreten von Tinnitus, Kurzatmigkeit, Husten ohne Auswurf, Veränderungen der Blut- und Urinzusammensetzung, die üblicherweise auf eine Funktionsstörung von Leber und Nieren hinweisen. Möglich sind: Haarausfall, vermindertes sexuelles Verlangen, Symptome von Hitzewallungen (Hitzegefühl und Herzklopfen, Hyperämie der Gesichtshaut usw.).
"Bisoprolol" ist ein Betablocker mit selektiver Wirkung, der blutdrucksenkende und antiischämische Wirkungen hat und hilft, die Manifestationen von Tachykardie und Arrhythmie zu bekämpfen. Ein preisgünstiges Medikament in Tablettenform, das das Fortschreiten der Herzinsuffizienz bei endokardialer Fibroelastose verhindert. [ 13 ]
Wie viele andere Medikamente, die gegen koronare Herzkrankheit und Herzinsuffizienz verschrieben werden, wird Bisoprolol über einen langen Zeitraum verschrieben. Es ist ratsam, es morgens vor oder während der Mahlzeiten einzunehmen.
Die empfohlenen Dosierungen werden individuell in Abhängigkeit von den Blutdruckwerten und den parallel dazu verschriebenen Medikamenten ausgewählt. Im Durchschnitt beträgt eine Einzeldosis (auch Tagesdosis) 5–10 mg, kann aber bei leichtem Druckanstieg auf 2,5 mg reduziert werden. Die maximale Dosis, die einem Patienten mit normal funktionierenden Nieren verschrieben werden kann, beträgt 20 mg, jedoch nur bei konstant hohem Blutdruck.
Eine Erhöhung der angegebenen Dosierungen ist nur mit Zustimmung eines Arztes möglich. Bei schweren Leber- und Nierenerkrankungen gelten jedoch 10 mg als maximal zulässige Dosis.
Bei der komplexen Behandlung von Herzinsuffizienz vor dem Hintergrund einer linksventrikulären Dysfunktion, die am häufigsten bei Fibroelastose auftritt, wird eine wirksame Dosis durch schrittweise Erhöhung der Dosierung um 1,25 mg ausgewählt. In diesem Fall beginnen sie mit der minimal möglichen Dosis (1,25 mg). Die Dosierung wird in Abständen von 1 Woche erhöht.
Wenn die Dosis 5 mg erreicht, wird das Intervall auf 28 Tage verlängert. Nach 4 Wochen wird die Dosis um 2,5 mg erhöht. Unter Einhaltung dieses Intervalls und dieser Norm erreichen sie 10 mg, die der Patient über einen längeren Zeitraum oder dauerhaft einnehmen muss.
Wenn eine solche Dosierung schlecht vertragen wird, wird sie schrittweise auf ein angenehmes Niveau reduziert. Das Absetzen der Behandlung mit einem Betablocker sollte auch nicht abrupt erfolgen.
Das Arzneimittel sollte nicht verschrieben werden bei Überempfindlichkeit gegen die Wirk- und Hilfsstoffe des Arzneimittels, akuter und dekompensierter Herzinsuffizienz, kardiogenem Schock, AV-Block Grad 2-3, Bradykardie, anhaltend niedrigem Blutdruck und einigen anderen Herzerkrankungen, schwerem Asthma bronchiale, Bronchoobstruktion, schweren peripheren Durchblutungsstörungen, metabolischer Azidose.
Bei der Verschreibung komplexer Behandlungen ist Vorsicht geboten. Daher wird die Kombination von Bisoprolol mit einigen Antiarrhythmika (Chinidin, Lidocain, Phenytoin usw.), Calciumantagonisten und zentral blutdrucksenkenden Medikamenten nicht empfohlen.
Unangenehme Symptome und Störungen, die während der Behandlung mit Bisoprolol möglich sind: erhöhte Müdigkeit, Kopfschmerzen, Hitzewallungen, Schlafstörungen, Blutdruckabfall und Schwindel beim Aufstehen, Hörverlust, Magen-Darm-Symptome, Leber- und Nierenerkrankungen, verminderte Potenz, Muskelschwäche und Krämpfe. Manchmal klagen Patienten über periphere Durchblutungsstörungen, die sich in Form von Fieber oder Taubheitsgefühl in den Extremitäten, insbesondere in den Fingern und Zehen, äußern.
Bei Begleiterkrankungen des Bronchopulmonalsystems, der Nieren, der Leber sowie Diabetes mellitus ist das Risiko von Nebenwirkungen höher, was auf eine Verschlimmerung der Erkrankung hindeutet.
"Digoxin" ist ein beliebtes, preisgünstiges Herzglykosid auf Basis der Fingerhutpflanze, das streng verschreibungspflichtig (in Tablettenform) abgegeben wird und unter seiner Aufsicht angewendet werden sollte. Die Injektionsbehandlung wird im Krankenhaus während der Verschlimmerung einer koronaren Herzkrankheit und einer Herzinsuffizienz durchgeführt. Tabletten werden kontinuierlich in minimal wirksamen Dosen verschrieben, da das Medikament eine toxische und narkotische Wirkung hat.
Die therapeutische Wirkung besteht in der Veränderung der Stärke und Amplitude der Myokardkontraktionen (gibt dem Herzen Energie und unterstützt es bei ischämischen Zuständen). Das Medikament hat außerdem eine gefäßerweiternde (reduziert Stauungen) und eine gewisse harntreibende Wirkung, die Schwellungen lindert und die Schwere des Atemversagens, das sich in Kurzatmigkeit äußert, verringert.
Die Gefahr von Digoxin und anderen Herzglykosiden besteht darin, dass sie bei Überdosierung Herzrhythmusstörungen hervorrufen können, die durch eine erhöhte Erregbarkeit des Herzmuskels verursacht werden.
Im Falle einer Verschlimmerung der Herzinsuffizienz wird das Medikament in Form von Injektionen verschrieben, wobei die individuelle Dosierung unter Berücksichtigung der Schwere der Erkrankung und des Alters des Patienten ausgewählt wird. Wenn sich der Zustand stabilisiert, wird auf Tabletten umgestellt.
Normalerweise beträgt die Standardeinzeldosis des Arzneimittels 0,25 mg. Die Häufigkeit der Verabreichung kann 1- bis 5-mal täglich in gleichen Abständen variieren. Im akuten Stadium der CHF kann die Tagesdosis 1,25 mg erreichen. Wenn sich der Zustand dauerhaft stabilisiert, ist eine Erhaltungsdosis von 0,25 (seltener 0,5) mg pro Tag erforderlich.
Bei der Verschreibung des Arzneimittels an Kinder wird das Gewicht des Patienten berücksichtigt. Eine wirksame und sichere Dosis wird mit 0,05–0,08 mg pro kg Körpergewicht berechnet. Das Medikament wird jedoch nicht dauerhaft, sondern für 1–7 Tage verschrieben.
Die Dosierung von Herzglykosiden sollte von einem Arzt unter Berücksichtigung des Zustands und des Alters des Patienten verordnet werden. Gleichzeitig ist es sehr gefährlich, die Dosierung unabhängig voneinander anzupassen oder zwei Medikamente mit ähnlicher Wirkung gleichzeitig einzunehmen.
"Digoxin" wird nicht verschrieben bei instabiler Angina pectoris, schweren Herzrhythmusstörungen, AV-Block Grad 2-3, Herzbeuteltamponade, Adams-Stokes-Morgagni-Syndrom, isolierter Bikuspidalklappenstenose und Aortenstenose, angeborener Herzanomalie namens Wolff-Parkinson-White-Syndrom, hypertropher obstruktiver Kardiomyopathie, Endo-, Peri- und Myokarditis, thorakalem Aortenaneurysma, Hyperkalzämie, Hypokaliämie und einigen anderen Pathologien. Die Liste der Kontraindikationen ist recht umfangreich und umfasst Syndrome mit mehreren Manifestationen, sodass die Entscheidung über die Möglichkeit der Anwendung dieses Arzneimittels nur von einem Spezialisten getroffen werden kann.
Digoxin hat auch Nebenwirkungen. Dazu gehören Herzrhythmusstörungen (infolge einer falsch gewählten Dosis und Überdosierung), Appetitlosigkeit, Übelkeit (oft mit Erbrechen), Darmstörungen, starke Schwäche und hohe Müdigkeit, Kopfschmerzen, das Auftreten von "Fliegen" vor den Augen, eine Abnahme des Thrombozytenspiegels und Blutgerinnungsstörungen, allergische Reaktionen. Am häufigsten ist das Auftreten dieser und anderer Symptome mit der Einnahme hoher Dosen des Arzneimittels verbunden, seltener mit einer Langzeittherapie.
Spironolacton ist ein Mineralokortikoid-Antagonist. Es wirkt harntreibend und fördert die Ausscheidung von Natrium, Chlor und Wasser. Kalium bleibt jedoch erhalten, das für die normale Herzfunktion wichtig ist, da dessen Leitfähigkeit hauptsächlich auf diesem Element beruht. Es hilft bei der Linderung von Ödemen. Es wird als Adjuvans bei Herzinsuffizienz eingesetzt.
Bei CHF wird das Medikament je nach Krankheitsphase verschrieben. Im Falle einer Exazerbation kann das Medikament sowohl in Form von Injektionen als auch in Tablettenform in einer Dosierung von 50-100 mg pro Tag verschrieben werden. Wenn sich der Zustand stabilisiert, wird über einen langen Zeitraum eine Erhaltungsdosis von 25-50 mg verschrieben. Wenn das Gleichgewicht von Kalium und Natrium in Richtung einer Abnahme des Kaliums gestört ist, kann die Dosis erhöht werden, bis sich eine normale Konzentration der Spurenelemente einstellt.
In der Pädiatrie wird die wirksame Dosierung auf der Grundlage eines Verhältnisses von 1–3 mg Spironolacton pro Kilogramm Körpergewicht des Patienten berechnet.
Wie wir sehen, ist auch hier die Auswahl der empfohlenen Dosis individuell, wie dies bei der Verordnung vieler anderer in der Kardiologie verwendeter Medikamente der Fall ist.
Kontraindikationen für die Anwendung eines Diuretikums können sein: übermäßiger Kalium- oder niedriger Natriumspiegel im Körper, eine Pathologie im Zusammenhang mit fehlendem Wasserlassen (Anurie), eine schwere Nierenerkrankung mit eingeschränkter Leistungsfähigkeit. Das Medikament wird schwangeren Frauen und stillenden Müttern sowie Personen mit einer Unverträglichkeit gegenüber den Bestandteilen des Medikaments nicht verschrieben.
Vorsicht ist geboten bei der Anwendung des Arzneimittels bei Patienten mit AV-Herzblock (kann sich verschlimmern), Kalziumüberschuss (Hyperkalzämie), metabolischer Azidose, Diabetes mellitus, Menstruationsstörungen und Lebererkrankungen.
Die Einnahme des Arzneimittels kann Kopfschmerzen, Schläfrigkeit, Gleichgewichtsverlust und Bewegungskoordinationsverlust (Ataxie), Vergrößerung der Brustdrüsen bei Männern (Gynäkomastie) und Impotenz, Veränderungen der Menstruation, Verhärtung der Stimme und übermäßigen Haarwuchs bei Frauen (Hirsutismus), Schmerzen im Oberbauch und Magen-Darm-Störungen, Darmkoliken, Nierenfunktionsstörungen und Mineralstoffstörungen verursachen. Haut- und allergische Reaktionen sind möglich.
Nebenwirkungen treten in der Regel bei Überschreitung der erforderlichen Dosis auf. Bei unzureichender Dosierung können Ödeme auftreten.
"Magnicor" ist ein Medikament, das die Bildung von Blutgerinnseln verhindert und auf Acetylsalicylsäure und Magnesiumhydroxid basiert. Es ist eines der wirksamsten Mittel der antithrombotischen Therapie bei Herzinsuffizienz. Es hat eine analgetische, entzündungshemmende, thrombozytenaggregationshemmende Wirkung und beeinflusst die Atemfunktion. Magnesiumhydroxid reduziert die negativen Auswirkungen von Acetylsalicylsäure auf die Magen-Darm-Schleimhaut.
Bei einer Endomyokardfibroelastose wird das Medikament zu prophylaktischen Zwecken verschrieben, daher wird die minimale wirksame Dosis von 75 mg eingehalten, was 1 Tablette entspricht. Bei einer Herzischämie aufgrund von Thrombusbildung und anschließender Verengung des Lumens der Herzkranzgefäße beträgt die Anfangsdosis 2 Tabletten und die Erhaltungsdosis entspricht der prophylaktischen Dosis.
Eine Überschreitung der empfohlenen Dosierung erhöht das Risiko schwer stillbarer Blutungen erheblich.
Die Dosierungen sind für erwachsene Patienten angegeben, da das Arzneimittel Acetylsalicylsäure enthält, deren Einnahme im Alter unter 15 Jahren schwerwiegende Folgen haben kann.
Das Medikament wird nicht Patienten im Kindesalter und in der frühen Adoleszenz verschrieben, bei Unverträglichkeit gegenüber Acetylsalicylsäure und anderen Bestandteilen des Medikaments, bei Asthma bronchiale (in der Anamnese), akuter erosiver Gastritis, Magengeschwüren, hämorrhagischer Diathese, schweren Leber- und Nierenerkrankungen, bei schwerer dekompensierter Herzinsuffizienz.
Während der Schwangerschaft wird Magnicor nur in äußersten Notfällen und nur im 1.-2. Trimester verschrieben, unter Berücksichtigung der möglichen negativen Auswirkungen auf den Fötus und den Schwangerschaftsverlauf. Im 3. Trimester der Schwangerschaft ist eine solche Behandlung unerwünscht, da sie zu einer Verringerung der Kontraktilität der Gebärmutter (verlängerte Wehen) beiträgt und starke Blutungen verursachen kann. Der Fötus kann pulmonale Hypertonie und Nierenfunktionsstörungen entwickeln.
Zu den Nebenwirkungen des Arzneimittels zählen Symptome des Magen-Darm-Trakts (Dyspepsie, Magen- und Bauchschmerzen, ein gewisses Risiko für Magenblutungen mit der Entwicklung einer Eisenmangelanämie). Vor dem Hintergrund der Einnahme des Arzneimittels sind Nasenbluten, Zahnfleischbluten und Blutungen der Harnorgane möglich.
Eine Überdosierung kann Schwindel, Ohnmacht und Ohrensausen verursachen. Allergische Reaktionen sind nicht selten, insbesondere im Zusammenhang mit einer Überempfindlichkeit gegen Salicylate. Anaphylaxie und Atemstillstand sind jedoch seltene Nebenwirkungen.
Die Auswahl der Medikamente in der komplexen Therapie und die empfohlenen Dosierungen sollten streng individuell erfolgen. Besondere Vorsicht ist bei der Behandlung von Schwangeren, stillenden Müttern, Kindern und älteren Patienten geboten.
Traditionelle Medizin und Homöopathie
Die Herzfibroelastose ist eine ernste und schwere Erkrankung mit einem charakteristischen progressiven Verlauf und praktisch keiner Heilungschance. Es ist klar, dass eine wirksame Behandlung einer solchen Krankheit mit Volksheilmitteln unmöglich ist. Traditionelle medizinische Rezepte, die hauptsächlich auf Kräuterbehandlungen beruhen, dürfen nur ergänzend und nur mit Zustimmung eines Arztes angewendet werden, um die ohnehin schlechte Prognose nicht zu verschlechtern.
Homöopathische Mittel sind nicht verboten und können Teil einer umfassenden Behandlung von Herzinsuffizienz sein. In diesem Fall geht es jedoch weniger um die Behandlung als vielmehr um die Verhinderung des Fortschreitens der Herzinsuffizienz.
Die Medikamente sollten von einem erfahrenen Homöopathen verschrieben werden, und die Frage ihrer Einbeziehung in eine komplexe Therapie liegt in der Kompetenz des behandelnden Arztes.
Welche homöopathischen Arzneimittel helfen, das Fortschreiten der Herzinsuffizienz bei Fibroelastose zu verzögern? Bei akuter Herzinsuffizienz greifen Homöopathen auf folgende Arzneimittel zurück: Arsenicum album, Antimonium tartaricum, Carbo vegetabilis, Acidum oxalicum. Trotz ähnlicher Indikationen verlassen sich Ärzte bei der Wahl eines wirksamen Arzneimittels auf die äußeren Manifestationen der Ischämie in Form einer Zyanose (deren Grad und Prävalenz) und die Art des Schmerzsyndroms.
Im Falle einer Herzinsuffizienz können folgende Mittel in die Erhaltungstherapie einbezogen werden: Lachesis und Nayu, Lycopus (im Anfangsstadium einer Herzvergrößerung), Laurocerasus (bei Kurzatmigkeit in Ruhe), Latrodectus mactans (bei Herzklappenerkrankungen), Weißdornpräparate (besonders nützlich bei Endomyokardläsionen).
Bei starkem Herzschlag können zur symptomatischen Behandlung folgende Mittel verschrieben werden: Spigelia, Glonoinum (bei Tachykardie), Aurum metallicum (bei Bluthochdruck).
Um die Schwere der Atemnot zu reduzieren, helfen: Grindelia, Spongia und Lahegis. Zur Linderung von Herzschmerzen kann Folgendes verschrieben werden: Cactus, Cereus, Naya, Cuprum, zur Linderung von Angstzuständen vor diesem Hintergrund - Aconitum. Bei der Entwicklung von Herzasthma sind folgende Mittel angezeigt: Digitalis, Laurocerasus, Lycopus.
Verhütung
Die Prävention der erworbenen Fibroelastose des Herzens und der Lunge besteht in der Vorbeugung und rechtzeitigen Behandlung von Infektions- und Entzündungskrankheiten, insbesondere bei Schäden an lebenswichtigen Organen. Eine wirksame Behandlung der Grunderkrankung hilft, gefährliche Folgen, einschließlich Fibroelastose, zu vermeiden. Dies ist ein guter Grund, sich gut um Ihre Gesundheit und die Gesundheit zukünftiger Generationen zu kümmern – die sogenannte Arbeit für eine gesunde Zukunft und ein langes Leben.
Prognose
Die mit der kardialen und pulmonalen Fibroelastose verbundenen Bindegewebsveränderungen gelten als irreversibel. Obwohl einige Medikamente die Dicke des Endokards bei Langzeittherapie etwas reduzieren können, garantieren sie keine Heilung. Obwohl die Erkrankung nicht immer tödlich verläuft, ist die Prognose dennoch relativ schlecht. Die 4-Jahres-Überlebensrate beträgt 77 %. [ 14 ]
Die schlechteste Prognose besteht, wie bereits erwähnt, bei der angeborenen Form der Herzfibroelastose, deren Manifestationen der Herzinsuffizienz bereits in den ersten Lebenswochen und -monaten des Kindes sichtbar werden. Nur eine Herztransplantation kann das Baby retten, was in einem so frühen Stadium eine riskante Operation darstellt und vor dem zweiten Lebensjahr durchgeführt werden muss. Solche Kinder leben in der Regel nicht länger.
Andere Operationen verhindern lediglich den frühen Tod des Kindes (und nicht immer), können es jedoch nicht vollständig von Herzversagen heilen. Der Tod tritt mit Dekompensation und Entwicklung eines Atemversagens ein.
Die Prognose der Lungenfibroelastose hängt von den Krankheitsverläufen ab. Bei raschen Symptomen ist das Risiko äußerst gering. Bei schleichendem Krankheitsverlauf kann der Patient etwa 10 bis 20 Jahre leben, bis aufgrund von Veränderungen in den Lungenbläschen ein Atemversagen auftritt.
Viele schwer behandelbare Erkrankungen lassen sich durch vorbeugende Maßnahmen vermeiden. Bei der Herzfibroelastose geht es in erster Linie um die Vorbeugung von Faktoren, die die Entwicklung des Herzens und des Kreislaufsystems des Fötus beeinflussen können (mit Ausnahme erblicher Veranlagungen und Mutationen, gegen die Ärzte machtlos sind). Lassen sie sich nicht vermeiden, hilft eine frühzeitige Diagnostik, die Pathologie in einem Stadium zu erkennen, in dem ein Schwangerschaftsabbruch möglich ist, der in dieser Situation als human gilt.

