Facharzt des Artikels
Neue Veröffentlichungen
Die Rolle von Veränderungen des subchondralen Knochens bei der Entstehung von Arthrose
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
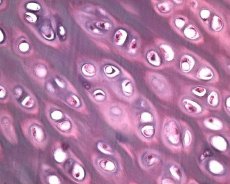
Neben der Degeneration des Gelenkknorpels ist auch das darunterliegende Knochengewebe am pathologischen Prozess der Osteoarthrose beteiligt. Es wird angenommen, dass eine Verdickung der subchondralen Platte zum Fortschreiten der Osteoarthrose beiträgt. Mit fortschreitender Osteoarthrose erodiert der Gelenkknorpel, der mechanischen und chemischen Belastungen ausgesetzt ist, aufgrund eines Ungleichgewichts im Knorpelabbau und der Knorpelreparation langsam. Insbesondere die mechanische Belastung der Gelenke, die das Körpergewicht „tragen“, trägt zur Bildung einer Vielzahl von Mikrofrakturen in der subchondralen Platte und im Knorpel bei. Mit fortschreitender Erosion des Gelenkknorpels sklerotisiert der subchondrale Knochen, die Steifheit des Knochengewebes nimmt zu, was wiederum zu einer weiteren Zerstörung der Gelenkknorpelstruktur beiträgt. Die Frage, ob die subchondralen Knochenveränderungen bei Osteoarthrose primär oder sekundär sind, bleibt jedoch ungeklärt.
Bis vor kurzem wurden radiologisch nachweisbare Veränderungen der schwammartigen Substanz des subchondralen Knochens, wie Sklerose oder Zystenbildung, bei Patienten mit Osteoarthrose als sekundär angesehen. Ergebnisse klinischer und experimenteller Studien weisen jedoch auf eine mögliche auslösende Rolle des subchondralen Knochens bei der Pathogenese der Osteoarthrose hin. Einer der möglichen Mechanismen ist ein starker Anstieg des Steifigkeitsgradienten des subchondralen Knochens, da die Integrität des darunter liegenden Knorpelgewebes von den mechanischen Eigenschaften seines Knochenbetts abhängt. Studien an Primaten haben gezeigt, dass Veränderungen des subchondralen Knochens Veränderungen des Gelenkknorpels vorausgehen können. Die Beweise für und gegen diese Hypothese, die sich aus Studien an Tiermodellen zur Osteoarthrose und klinischen Studien ergeben haben, haben die Debatte nur noch intensiviert. Eine Verdickung der Trabekel im subchondralen Knochen geht nicht immer mit einer verstärkten Knochenmineralisierung oder besser gesagt einer Zunahme des Osteoidvolumens einher. Dieses Zeichen einer abnormalen Mineralisierung weist darauf hin, dass die Störung der Regulation des Knochenumbaus ein integraler Bestandteil der Arthrose ist und unterstützt auch das Konzept eines Knochenzelldefekts bei Arthrose. Die Gruppe um J. Dequeker (1989) betrachtet Letzteres als eine „generalisierte metabolische Knochenerkrankung“.
Knochengewebe erneuert sich ständig. Dieser dynamische Prozess, Knochenumbau genannt, ist eine komplexe Abfolge von Resorption und Mineralisierung. Osteoklasten resorbieren Knochengewebe, und Osteoblasten sezernieren Proteine, die die wichtigste organische Komponente für die Mineralisierung bilden. Knochenbildung und -resorption erfolgen nicht zufällig im gesamten Skelett; es handelt sich um einen programmierten Prozess, der in verschiedenen Bereichen des Skeletts, den sogenannten Knochenumbaueinheiten, abläuft. Zu Beginn des Zyklus erscheinen Osteoklasten auf der inaktiven Oberfläche; innerhalb von zwei Wochen bilden sie einen Tunnel in der Kortikalis oder eine Lakune auf der Oberfläche des trabekulären Knochens. Die Häufigkeit der Aktivierung neuer Knochenumbaueinheiten bestimmt den Grad der Knochenerneuerung. Bei einem gesunden jungen Menschen sind Knochenbildung und -resorption im Gleichgewicht, und die normale Knochenmasse bleibt erhalten. An der hormonellen Regulierung der Knochengeweberesorption, zumindest von Parathormon und PGE2 , sind nicht nur Osteoklasten, sondern auch Osteoblasten beteiligt, da unter dem Einfluss dieser Hormone Faktoren freigesetzt werden, die die Knochenresorption durch Osteoklasten stimulieren. Derzeit sind mehr als 12 lokale und systemische Regulatoren des Knochengewebewachstums bekannt, die dessen Umbau beeinflussen, insbesondere PTH, 1,25(OH) 2D3 ,Calcitonin, Wachstumshormon, Glukokortikoide, Schilddrüsenhormone, Insulin, IGF (1 und 2), Östrogene, PGE2 , Androgene.
Knochenzellen setzen eine Reihe von Proteinen und Zytokinen frei, die für die endokrine Regulation und Signaltransduktion verantwortlich sind. Zu den von Osteoblasten produzierten Proteinen gehören Knochenmatrixproteine wie Kollagen, Osteopontin, Osteocalcin und Knochensialoproteine. Darüber hinaus setzen diese Zellen Proteasen in aktiver und latenter Form frei, die am Umbau des Knochengewebes beteiligt sind – MMPs, Komponenten des Plasminogenaktivator-(PA)/Plasmin-Systems. Von Osteoblasten freigesetzte Zytokine können sowohl über autokrine Mechanismen als auch über parakrine Wege auf lokale Zellen (andere Osteoblasten, Osteoklasten) wirken.
Es ist noch unklar, ob diese Signale durch mechanischen Stress oder andere durch mechanischen Stress induzierte chemische Signale reguliert werden. Bekannt ist jedoch, dass wiederholter mechanischer Stress die lokale Proliferation von Knochenzellen und/oder -proteinen verursacht. In vivo kann mechanische Belastung Osteoblasten aktivieren, den zyklischen Nukleotidspiegel erhöhen, die Prostaglandinproduktion steigern und morphologische Veränderungen im Zusammenhang mit dem Knochenumbau auslösen. In vitro führt mechanischer Stress zur Proliferation von Osteoblastenkulturen, zur Expression von mRNA von Knochenproteinen, die an der Osteoidbildung und -mineralisierung beteiligt sind, zur Freisetzung lokaler Wachstumsfaktoren wie IGF-1 und IGF-2 sowie von Adhäsionsmolekülen. Die Übertragung des mechanischen Stresssignals kann über mechanosensitive Ionenkanäle erfolgen.
Es gibt indirekte Hinweise auf eine Osteoblastenfunktionsstörung bei Osteoarthrose. G. Gevers und J. Dequeker (1987) zeigten einen Anstieg des Serum-Osteocalcinspiegels bei Frauen mit Handarthrose sowie in kortikalen Knochenexplantaten, was darauf hindeutet, dass eine Knochenpathologie Teil der Osteoarthrose sein kann. Die Autopsie ergab nicht nur eine Verdickung des subchondralen Knochens, sondern auch eine abnorm niedrige Mineralisierung des Femurkopfes. Bei Meerschweinchen mit chirurgisch induzierter Osteoarthrose zeigte die Computertomographie eine signifikante Verdickung der Knochenfraktion in der subchondralen Zone. Ein Ungleichgewicht zwischen kollagenen und nicht-kollagenen Proteinen (Osteocalcin etc.) kann zu einer Zunahme des Knochenvolumens führen, beeinflusst aber nicht die Mineraldichte. Laut M. Shimizu et al. (1993) ist das Fortschreiten degenerativer Veränderungen des Gelenkknorpels mit einem intensiveren Umbau des subchondralen Knochens und einer Zunahme seiner Steifigkeit verbunden, was ebenfalls auf einen Defekt der Knochengewebezellen bei Osteoarthrose hinweist. Nach der Hypothese von B. Lee und M. Aspden (1997) kann die Proliferation defekter Knochenzellen zu einer Zunahme der Knochengewebesteifigkeit führen, verursacht jedoch keine Zunahme der Mineraldichte.
CI Westacott et al. (1997) stellten die Hypothese auf, dass abnorme Osteoblasten den Knorpelstoffwechsel direkt beeinflussen. Durch Kultivierung von Osteoblasten von Patienten mit Osteoarthritis mit Chondrozyten von Personen ohne Gelenkerkrankungen beobachteten die Autoren in vitro eine signifikante Veränderung der Glykosaminoglykan-Freisetzung durch normales Knorpelgewebe, während die Zytokinfreisetzung unverändert blieb. G. Hilal et al. (1998) zeigten, dass die Kultur von Osteoblasten aus subchondralem Knochen von Patienten mit Osteoarthritis in vitro einen veränderten Stoffwechsel aufweist – die Aktivität des AP/Plasmin-Systems und der IGF-1-Spiegel in diesen Zellen sind erhöht. Die Beobachtung von CI Westacott et al. (1997) lässt sich durch eine erhöhte Aktivität von Proteasen in subchondralen Knochenzellen erklären.
Es ist weiterhin unbekannt, ob Veränderungen des subchondralen Knochens Osteoarthritis auslösen oder zu ihrer Progression beitragen. DK Dedrick et al. (1993) zeigten, dass bei Hunden mit chirurgisch induzierter Osteoarthritis eine Verdickung des subchondralen Knochens keine notwendige Voraussetzung für die Entwicklung osteoarthroseähnlicher Veränderungen des Gelenkknorpels ist, aber zur Progression degenerativer Prozesse im Knorpel beiträgt. Die Ergebnisse der Studie von A. Sa'ied et al. (1997) widersprechen den Daten der vorhergehenden Studie. Mithilfe von 50 MHz-Echographie beurteilten die Autoren die anfänglichen morphologischen Veränderungen und deren Progression in Gelenkknorpel und Knochen bei experimenteller Osteoarthritis, die durch Injektionen von Monoiodessigsäure in das Kniegelenk von Ratten induziert wurde, und wiesen einen gleichzeitigen Prozess von Veränderungen in Knochen und Knorpel während der ersten drei Tage nach der Injektion nach.
Osteoblasten sezernieren Wachstumsfaktoren und Zytokine, die am lokalen Knochenumbau beteiligt sind. Diese können den Umbau des eigentlichen Knorpels in „gewichttragenden“ Gelenken fördern, nachdem sie durch Mikrorisse in der verkalkten Schicht des Gelenkknorpels eingedrungen sind. Außerdem finden sich in der Synovialflüssigkeit Knochenzellsekretionsprodukte. Die wahrscheinlichsten von abnormalen Osteoblasten sezernierten Produkte, die den Prozess des lokalen Knorpelumbaus initiieren können, sind TGF-β und knochenmorphometrische Proteine (BMPs). Beide Mitglieder der TGF-Familie werden sowohl von Chondrozyten als auch von Osteoblasten sezerniert und beide können sowohl den Knochen- als auch den Knorpelumbau beeinflussen. J. Martel Pelletier et al. (1997) beobachteten einen erhöhten TGF-β-Spiegel in subchondralen Knochenexplantaten von Patienten mit Osteoarthrose im Vergleich zu gesunden Personen, was auf eine wahrscheinliche Rolle dieses Wachstumsfaktors in der Pathogenese der Osteoarthrose hindeutet. IGFs werden ebenfalls von Osteoblasten produziert. In einer Kultur osteoblastenähnlicher Zellen von Patienten mit Osteoarthrose wurde ein Anstieg des IGF-Spiegels festgestellt, der den Knorpelstoffwechsel verändert.
TGF-β, IGF, BMP und Zytokine, die von Osteoblasten im subchondralen Knochen produziert werden, können die Produktion von Kollagenase und anderen proteolytischen Enzymen im Knorpel beeinflussen, was wiederum den Umbau/Abbau der Knorpelmatrix fördern kann. Es ist unklar, ob Osteoblasten bei Arthrose weniger Makrophagen-Kolonie-stimulierenden Faktor (M-CSF – ein Stimulator der Knochenresorption) produzieren als normale Zellen. Studien von AG Uitterlinden et al. (1997) zeigten, dass Vitamin-D-Rezeptoren, die von Osteoblasten exprimiert werden und die Expression einer Reihe von von diesen Zellen synthetisierten Faktoren regulieren, eine gewisse Rolle bei der Bildung von Osteophyten spielen könnten, was die Rolle von Osteoblasten in der Pathogenese dieser Erkrankung teilweise erklärt.
Unter Berücksichtigung der Ergebnisse der oben genannten Studien haben G. Hilal et al. (1998) und J. Martel-Pelletier et al. (1997) die folgende Arbeitshypothese zur Beziehung zwischen dem subchondralen Knochenumbau und dem eigentlichen Gelenkknorpel bei Osteoarthrose vorgeschlagen. In einem frühen oder fortgeschrittenen Stadium der OA-Pathogenese intensiviert sich der Prozess des Knochengewebeumbaus im subchondralen Knochen. Gleichzeitig führt wiederholte Belastung zu lokalen Mikrofrakturen und/oder dem Auftreten eines Ungleichgewichts im IGF/IGF-bindenden Protein (IGFBP)-System aufgrund einer anormalen Reaktion der subchondralen Knochenosteoblasten, was zu seiner Sklerose beiträgt. Letzteres kann wiederum zum Auftreten von Mikrofrakturen des eigentlichen Knorpels und zu Schäden an seiner Matrix beitragen.
Unter normalen Bedingungen werden diese Schäden durch die lokale Synthese und Freisetzung von IGF-1 und IGF-bindendem Protein repariert, die die Bildung der extrazellulären Matrix des Gelenkknorpels stimulieren. Gleichzeitig fördert das GF-System das Wachstum subchondraler Knochenzellen und die Bildung der Knochenmatrix. Die anabole Aktivität des IGF-Systems ist im subchondralen Knochen von Patienten mit Osteoarthrose erhöht, während die lokale Aktivierung des AP/Plasmin-Systems (eines lokalen Regulators des IGF-Systems) im Gelenkknorpel dessen lokale Veränderungen verursacht. In Osteoblasten bei Osteoarthrose stört IGF-1 die Regulierung von AP durch Plasmin durch positive Rückkopplung und kann so den Umbau im Knochengewebe hemmen, was letztendlich zu subchondraler Sklerose führt. So führt die lokale Induktion von IGF-1 und Proteasen im Knochen- und Knorpelgewebe einerseits zu Knorpelschäden und andererseits zu einer subchondralen Knochenverdickung, die wiederum zu weiteren Knorpelschäden beiträgt. Das Ungleichgewicht zwischen den mit der subchondralen Sklerose verbundenen Knorpelschäden und ihren reparativen Fähigkeiten führt zu fortschreitenden Veränderungen der Knorpel-ECM und zur Entstehung einer Osteoarthrose. Diese Hypothese erklärt laut den Autoren auch den langsamen Krankheitsverlauf.

