Facharzt des Artikels
Neue Veröffentlichungen
Gewohnheitsmäßige Fehlgeburten - Ursachen
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
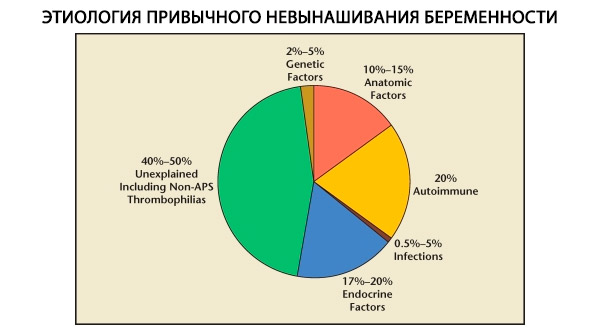
Bei habituellen Fehlgeburten werden genetische, anatomische, endokrine, immunologische und infektiöse Faktoren unterschieden. Werden alle genannten Ursachen ausgeschlossen, verbleibt eine Gruppe von Patientinnen, bei denen die Ursache der habituellen Fehlgeburt unklar ist (idiopathische Fehlgeburten). Laut C. Coulam et al. (1996) beruhen 80 % der idiopathischen Fehlgeburten auf unerkannten Immunerkrankungen.
Es gibt keine überzeugenden Beweise dafür, dass Endometriose wiederholte Fehlgeburten verursacht oder dass eine medizinische oder chirurgische Behandlung der Endometriose die Häufigkeit wiederholter Fehlgeburten verringert.
Nach aktuellen Konzepten besteht neben genetischen und teilweise infektiösen Ursachen, die zur Bildung eines abnormalen Embryos führen, die Umsetzung der schädigenden Wirkung anderer Faktoren (anatomischer, endokriner, immunologischer) darin, einen ungünstigen Hintergrund für die Entwicklung einer genetisch vollständig befruchteten Eizelle zu schaffen, was zur Erschöpfung der Reservekapazität des Chorions und zum Stillstand der Entwicklung (Embryogenese) führt. Als kritische Phasen im ersten Schwangerschaftstrimester gelten 6-8 Wochen (Tod des Embryos) und 10-12 Wochen (Ausstoß der befruchteten Eizelle).
 [ 1 ]
[ 1 ]
Genetische Ursachen für habituelle Fehlgeburten
Genetische Faktoren machen 3–6 % der Ursachen für habituelle Fehlgeburten aus. Bei sporadischen Schwangerschaftsabbrüchen im ersten Trimester weisen etwa 50 % der Abtreibungen Chromosomenanomalien auf. Die meisten davon (95 %) sind Veränderungen der Chromosomenzahl – Monosomie (Verlust eines Chromosoms), Trisomie (das Vorhandensein eines zusätzlichen Chromosoms), die das Ergebnis von Fehlern in der Meiose sind, sowie Polyploidie (eine Zunahme der Chromosomenzusammensetzung durch einen vollständigen haploiden Satz), die auftritt, wenn eine Eizelle von zwei oder mehr Spermien befruchtet wird. Bei sporadischen Fehlgeburten tritt am häufigsten eine Trisomie auf – 60 % aller Mutationen (am häufigsten auf Chromosom 16 sowie 13, 18, 21, 22), an zweiter Stelle der Häufigkeit steht das Shereshevsky-Turner-Syndrom (Chromosom 45 X0) – 20 %, die restlichen 15 % entfallen auf Polyploidie (insbesondere Triploidie).
Im Falle einer Veränderung der Chromosomenzahl bei einem Schwangerschaftsabbruch zeigt die Untersuchung des Karyotyps der Eltern meist keine Pathologie und die Wahrscheinlichkeit einer Chromosomenerkrankung des Fötus während einer nachfolgenden Schwangerschaft beträgt 1 %. Im Gegensatz dazu werden bei der Untersuchung von Schwangerschaftsabbrüchen bei Paaren mit habitueller Fehlgeburt in 3-6 % der Fälle strukturelle Veränderungen der Chromosomen (intra- und interchromosomal) beobachtet. Bei der Untersuchung des Karyotyps der Eltern werden in 7 % der Fälle balancierte Chromosomenumlagerungen festgestellt. Am häufigsten handelt es sich dabei um reziproke Translokationen, bei denen sich ein Abschnitt eines Chromosoms anstelle eines anderen Abschnitts eines nicht homologen Chromosoms befindet, sowie um Mosaike der Geschlechtschromosomen, Inversionen und die Erkennung von Chromosomen in Form eines Rings. Liegen solche Chromosomenveränderungen bei einem der Ehepartner vor, werden die Prozesse der Chromosomenpaarung und -trennung während der Meiose behindert, was zum Verlust (Deletion) oder zur Verdoppelung (Duplikation) von Chromosomenabschnitten in den Gameten führt. Dies führt zu sogenannten unbalancierten Chromosomenveränderungen, bei denen der Embryo entweder nicht lebensfähig ist oder als Träger einer schweren Chromosomenerkrankung dient. Die Wahrscheinlichkeit, ein Kind mit unbalancierten Chromosomenanomalien zu bekommen, wenn im Karyotyp eines Elternteils balancierte Chromosomenveränderungen vorliegen, beträgt 1–15 %. Unterschiede in den Daten hängen mit der Art der Veränderungen, der Größe der betroffenen Abschnitte, dem Geschlecht des Trägers und der Familienanamnese zusammen.
Diagnose
Anamnese
- Erbkrankheiten bei Familienmitgliedern.
- Vorhandensein angeborener Anomalien in der Familie.
- Geburt von Kindern mit geistiger Behinderung.
- Das Vorliegen von Unfruchtbarkeit und/oder Fehlgeburten unbekannter Ursache bei einem Ehepaar oder bei Verwandten.
- Vorhandensein unklarer Fälle perinataler Mortalität.
Spezielle Forschungsmethoden
- Eine Untersuchung des Karyotyps der Eltern ist insbesondere für verheiratete Paare bei der Geburt eines Neugeborenen mit Entwicklungsstörungen und Fehlgeburten in der Vorgeschichte sowie bei habituellen Fehlgeburten in der Frühschwangerschaft angezeigt.
- Zytogenetische Analyse von Abtreibungen bei Totgeburten oder Neugeborenensterblichkeit.
Indikationen für die Konsultation anderer Spezialisten
Wenn bei den Eltern Veränderungen des Karyotyps festgestellt werden, ist eine Konsultation mit einem Genetiker erforderlich, um das Risiko für die Geburt eines Kindes mit einer Erkrankung einzuschätzen oder gegebenenfalls über die Frage einer Ei- oder Samenspende zu entscheiden.
Weitere Betreuung des Patienten
Liegt bei einem Ehepaar ein pathologischer Karyotyp vor, auch bei einem der Elternteile, empfiehlt sich aufgrund des hohen Risikos von Entwicklungsstörungen beim Fötus eine pränatale Diagnostik während der Schwangerschaft – Chorionbiopsie oder Amniozentese.
Anatomische Ursachen einer habituellen Fehlgeburt
Zu den anatomischen Ursachen einer habituellen Fehlgeburt gehören:
- angeborene Anomalien in der Entwicklung der Gebärmutter (vollständige Verdoppelung der Gebärmutter; zweihörniger, sattelförmiger, einhörniger Uterus; teilweises oder vollständiges intrauterines Septum);
- erworbene anatomische Defekte;
- intrauterine Verwachsungen (Asherman-Syndrom);
- submuköse Uterusmyome;
- isthmisch-zervikale Insuffizienz.
Die Häufigkeit anatomischer Anomalien bei Patientinnen mit habitueller Fehlgeburt liegt zwischen 10 und 16 %. Die Häufigkeit von Gebärmutterfehlbildungen, die zu einer Fehlgeburt (aber nicht zu Unfruchtbarkeit) führen können, im Verhältnis zu allen Gebärmutterfehlbildungen ist wie folgt: Uterus bicornis – 37 %, Uterus sattelförmig – 15 %, intrauterines Septum – 22 %, vollständige Verdoppelung der Gebärmutter – 11 %, Uterus unicornis – 4,4 %.
Diagnose einer habituellen Fehlgeburt
Anamnese
Bei anatomischen Pathologien der Gebärmutter werden häufiger späte Schwangerschaftsabbrüche und Frühgeburten beobachtet, bei einer Implantation am intrauterinen Septum oder in der Nähe des myomatösen Knotens sind jedoch auch vorzeitige Schwangerschaftsabbrüche möglich.
Pathognomonisches Zeichen einer Isthmus-Zervikalinsuffizienz ist ein spontaner Schwangerschaftsabbruch im zweiten Trimenon oder eine frühe Frühgeburt, die relativ schnell und schmerzarm erfolgt.
Bei Fehlbildungen der Gebärmutter muss auf anamnestische Hinweise auf Erkrankungen der Harnwege (häufig begleitend zu angeborenen Gebärmutteranomalien) und die Art der Entwicklung der Menstruationsfunktion (Hinweise auf Hämatometra bei funktionierendem rudimentären Gebärmutterhorn) geachtet werden.
Spezielle Untersuchungsmethoden
- Derzeit wird zur Diagnosestellung eine Hysterosalpingographie durchgeführt, die es ermöglicht, die Form der Gebärmutterhöhle zu untersuchen, das Vorhandensein von submukösen Myomen, Verwachsungen und Septen festzustellen und die Durchgängigkeit der Eileiter zu bestimmen. Um eine Gebärmutterpathologie zu diagnostizieren, ist es sinnvoll, eine Hysterosalpingographie in der Zeit zwischen Menstruation und Eisprung durchzuführen, d. h. in der ersten Phase des Menstruationszyklus nach dem Ende des blutigen Ausflusses (7.-9. Tag des Zyklus). Um eine isthmisch-zervikale Insuffizienz zu diagnostizieren, wird die Untersuchung in der zweiten Phase des Menstruationszyklus (18.-20. Tag) durchgeführt, um den Zustand des inneren Gebärmutterhalses zu bestimmen. Vor der Durchführung einer Hysterosalpingographie müssen entzündliche Erkrankungen der Beckenorgane ausgeschlossen oder behandelt werden.
- Die Hysteroskopie hat sich in den letzten Jahren weit verbreitet und gilt als Goldstandard in der Diagnostik intrauteriner Pathologien. Aufgrund der höheren Kosten im Vergleich zur Hysterosalpingographie wird diese Methode jedoch bei Frauen angewendet, bei denen aufgrund vorläufiger Ultraschalldaten eine Indikation für intrauterine Pathologie vorliegt. Mithilfe der Hysteroskopie können die Gebärmutterhöhle untersucht, die Art der intrauterinen Pathologie bestimmt und, sofern die erforderliche Ausrüstung (Resektoskop) vorhanden ist, minimalinvasive chirurgische Eingriffe durchgeführt werden – die Entfernung von Verwachsungen, submukösen Myomknoten und Endometriumpolypen. Bei der Entfernung eines intrauterinen Septums wird der laparoskopischen Hysteroresektoskopie der Vorzug gegeben, da sie eine Perforation der Gebärmutterwand verhindert.
- Ultraschall wird in der ersten Phase des Menstruationszyklus durchgeführt, um eine mutmaßliche Diagnose von submukösen Uterusmyomen und intrauterinen Verwachsungen zu ermöglichen. In der zweiten Zyklusphase dient er der Erkennung eines intrauterinen Septums und eines Uterus bicornis. Diese Methode ist besonders in der Frühschwangerschaft von Bedeutung, da sie eine Sensitivität von 100 % und eine Spezifität von 80 % aufweist. Außerhalb der Schwangerschaft bedarf die Diagnose einer zusätzlichen Bestätigung durch andere Methoden.
- Ausländische Autoren weisen auf den Vorteil der Sonohysterographie (Ultraschall mittels transvaginalem Sensor mit vorheriger Einführung einer 0,9%igen Natriumchloridlösung in die Gebärmutterhöhle) gegenüber der Hysterosalpingographie hin, da sie eine Differentialdiagnose zwischen dem intrauterinen Septum und dem Uterus bicornis ermöglicht. Mit der Sonohysterographie ist es möglich, nicht nur die Form der Gebärmutterhöhle zu untersuchen, sondern auch die Konfiguration des Fundus des Gebärmutterkörpers zu bestimmen. In unserem Land ist diese Methode nicht weit verbreitet.
- In einigen komplexen Fällen wird zur Bestätigung der Diagnose eine MRT der Beckenorgane durchgeführt. Mit dieser Methode lassen sich wertvolle Informationen bei Entwicklungsanomalien der Gebärmutter gewinnen, die mit einer atypischen Anordnung der Organe im Becken einhergehen. Bei einem rudimentären Gebärmutterhorn ist die MRT wichtig, um zu entscheiden, ob dessen Entfernung ratsam ist. Das rudimentäre Gebärmutterhorn muss entfernt werden, wenn es mit dem Eileiter und dem Eierstock verbunden ist, um die Bildung und Entwicklung der befruchteten Eizelle darin zu verhindern. Ein Schwangerschaftsabbruch bei anatomischen Anomalien der Gebärmutter kann mit einer erfolglosen Einnistung der befruchteten Eizelle (an der intrauterinen Scheidewand, in der Nähe des submukösen Myomknotens), einer unzureichend entwickelten Gefäßversorgung und Aufnahme des Endometriums, engen räumlichen Beziehungen in der Gebärmutterhöhle (z. B. bei einer Höhlendeformation durch ein Myomknoten), die oft mit einer ICI einhergeht, und hormonellen Störungen verbunden sein.
Behandlung einer habituellen Fehlgeburt
Chirurgische Behandlung
Bei Vorliegen eines intrauterinen Septums, submuköser Myome und Verwachsungen ist die Hysteroresektoskopie die wirksamste chirurgische Behandlung. Die Häufigkeit nachfolgender Fehlgeburten in dieser Frauengruppe beträgt nach der Behandlung 10 % gegenüber 90 % vor der Operation. Beim Vergleich der Ergebnisse einer Metroplastik mittels Laparotomie und einer transzervikalen Hysteroresektoskopie gelangte P. Heinonen (1997) zu Ergebnissen, die auf ein geringeres Trauma und eine höhere Wirksamkeit der Hysteroresektoskopie hindeuten; der Anteil der Schwangerschaften mit lebensfähigen Kindern lag bei 68 bzw. 86 %.
Die chirurgische Entfernung des intrauterinen Septums, der Verwachsungen und der submukösen Myomknoten verhindert in 70–80 % der Fälle eine Fehlgeburt. Bei Frauen mit Gebärmutterfehlbildungen, die nach einer normalen Geburt wiederholt Fehlgeburten erlitten haben, ist sie jedoch wirkungslos. In solchen Fällen ist der anatomische Faktor wahrscheinlich nicht die Hauptursache, und es müssen andere Ursachen für die Fehlgeburt gesucht werden.
Es ist erwiesen, dass eine abdominale Metroplastik mit einem erheblichen Risiko postoperativer Unfruchtbarkeit verbunden ist und die Prognose einer nachfolgenden Schwangerschaft nicht verbessert. Daher ist es besser, Hysteroskopien und laparoskopischen Operationen den Vorzug zu geben.
Medikamentöse Behandlung
Die Wirksamkeit der Einführung des IUP, hoher Dosen östrogener Medikamente, der Einführung eines Foley-Katheters in die Gebärmutterhöhle nach Operationen zur Entfernung von Verwachsungen und des intrauterinen Septums wurde nicht nachgewiesen. Es wird empfohlen, eine Schwangerschaft frühestens 3 Monate nach der Operation zu planen. Um das Wachstum des Endometriums zu verbessern, wird über 3 Menstruationszyklen eine zyklische Hormontherapie durchgeführt [14]. 3 Monate lang, in den ersten 14 Tagen des Zyklus, ist es ratsam, ein Medikament mit 2 mg 17-beta-Östradiol einzunehmen, in den nächsten 14 Tagen - 2 mg 17-beta-Östradiol und 20 mg Dydrogesteron (10 mg Dydrogesteron als Teil eines Kombinationspräparats plus 10 mg Dydrogesteron in einer separaten Tablettenform).
Weitere Betreuung des Patienten
Merkmale des Schwangerschaftsverlaufs bei Uterus bicornis oder Uterusverdoppelung (bei 2 Gebärmutterhöhlen):
- in den frühen Stadien der Schwangerschaft kommt es aufgrund einer ausgeprägten Dezidualreaktion häufig zu Blutungen aus dem "leeren" Horn oder der Gebärmutterhöhle. Die Taktik sollte in diesem Fall konservativ sein und in der Verwendung von krampflösenden und blutstillenden Mitteln bestehen.
- Androhung eines Schwangerschaftsabbruchs in verschiedenen Stadien;
- Entwicklung einer isthmisch-zervikalen Insuffizienz;
- intrauterine Wachstumsverzögerung aufgrund einer Plazentainsuffizienz.
In der Frühschwangerschaft sind bei Blutungen Bettruhe und Halbbettruhe sowie die Gabe von blutstillenden, krampflösenden und sedierenden Medikamenten und eine Therapie mit Gestagenen (Dydrogesteron in einer Tagesdosis von 20 bis 40 mg) bis zur 16.–18. Schwangerschaftswoche ratsam.
Endokrine Ursachen für habituelle Fehlgeburten
Nach Angaben verschiedener Autoren sind endokrine Ursachen für Fehlgeburten für 8 bis 20 % verantwortlich. Die wichtigsten davon sind Lutealphasenmangel (LPD), Hypersekretion von LH, Schilddrüsenfunktionsstörungen und Diabetes mellitus.
Schwere Schilddrüsenerkrankungen oder Diabetes mellitus können zu wiederholten Fehlgeburten führen. Bei kompensiertem Diabetes mellitus unterscheidet sich das Risiko für habituelle Fehlgeburten jedoch nicht von dem der Allgemeinbevölkerung.
Gleichzeitig erfordert die hohe Inzidenz von Hypothyreose in der Bevölkerung ein Screening mit Messung des TSH-Spiegels. Bei Patientinnen mit habitueller Fehlgeburt wird in 20–60 % der Fälle eine Lutealphaseninsuffizienz und in 44–56 % der Fälle Ultraschallzeichen polyzystischer Ovarien beobachtet. Laut Literatur bleibt der Einfluss einzelner hormoneller Störungen auf die Entstehung des Symptomkomplexes habitueller Fehlgeburten umstritten. Die Studien von M. Ogasawara et al. (1997) zeigten keine verlässlichen Unterschiede in der Häufigkeit von Schwangerschaftsabbrüchen mit und ohne LPI bei Patientinnen mit zwei oder mehr früheren Fehlgeburten in der Anamnese, ausgenommen autoimmune, anatomische und infektiöse Ursachen.
Eine unzureichende Funktion des Gelbkörpers kann die Folge einer Reihe ungünstiger Faktoren sein:
- Störungen der FSH- und LH-Sekretion in der ersten Phase des Menstruationszyklus;
- früher oder umgekehrt zu später Höhepunkt der LH-Freisetzung;
- Hypoöstrogenismus als Folge einer unzureichenden Follikulogenese. Alle diese Zustände können durch eine Ersatztherapie mit Gestagenen in der postovulatorischen Phase nicht korrigiert werden. Prospektive Studien von L. Regan et al. zeigten eine signifikant erhöhte Fehlgeburtenrate bei Patientinnen mit LH-Hypersekretion am 8. Tag des Menstruationszyklus im Vergleich zu Frauen mit normalen LH-Spiegeln im Blut (65 % bzw. 12 % der Fehlgeburten). Die schädliche Wirkung eines vorzeitigen LH-Anstiegs ist mit einer vorzeitigen Wiederaufnahme der zweiten meiotischen Teilung und dem Eisprung einer unreifen Eizelle verbunden sowie mit der Induktion der Androgenproduktion durch Thekazellen, zusammen mit einer beeinträchtigten Endometriumaufnahme unter dem Einfluss eines Gestagenmangels. Eine vorläufige Senkung des präovulatorischen LH-Spiegels mit Gonadotropin-Releasing-Hormon-Agonisten ohne zusätzliche Maßnahmen zur Verlängerung einer nachfolgenden Schwangerschaft führt jedoch nicht zur erwarteten Verringerung der Fehlgeburtenrate.
Der Goldstandard zur Diagnose von NLF ist die histologische Untersuchung von Material, das aus einer Endometriumbiopsie in der zweiten Zyklusphase über zwei Menstruationszyklen hinweg gewonnen wird.
Die Diagnose anderer Ursachen für eine Ovulationsstörung, wie etwa Hyperprolaktinämie, Hypothyreose oder ein funktioneller Überschuss an Androgenen (Eierstöcke oder Nebennieren), muss mit der Verschreibung einer geeigneten Behandlung einhergehen.
Diagnose
Anamnese und körperliche Untersuchung
- Anamnese. Zu berücksichtigende Faktoren: späte Menarche, unregelmäßiger Menstruationszyklus (Oligomenorrhoe, Amenorrhoe, plötzliche Gewichtszunahme, Gewichtsverlust, Unfruchtbarkeit, gewohnheitsmäßige frühe Fehlgeburten).
- Untersuchung: Körperbau, Größe, Körpergewicht, Hirsutismus, Ausprägung der sekundären Geschlechtsmerkmale, Vorhandensein von Dehnungsstreifen, Untersuchung der Brustdrüsen auf Galaktorrhoe.
- Funktionelle Diagnostik: Messung der Rektaltemperatur während 3 Menstruationszyklen.
Spezielle Forschungsmethoden
- Hormonelle Studie:
- in der 1. Phase des Menstruationszyklus (7.–8. Tag) – Bestimmung des Gehalts an FSH, LH, Prolaktin, TSH, Testosteron, 17-Hydroxyprogesteron (17-OP), DHEAS;
- in der 2. Phase des Menstruationszyklus (21–22 Tage) – Bestimmung des Progesterongehalts (normative Indikatoren für den Progesteronspiegel sind sehr variabel, die Methode kann nicht ohne Berücksichtigung anderer Faktoren verwendet werden).
- Ultraschall:
- in der 1. Phase des Menstruationszyklus (5.–7. Tag) – Diagnose einer Endometriumpathologie, polyzystischer Eierstöcke;
- in der 2. Phase des Menstruationszyklus (20–21 Tage) – Messung der Dicke des Endometriums (normal 10–11 mm, korreliert mit dem Progesterongehalt).
- Eine Endometriumbiopsie zur Überprüfung der NLF wird zwei Tage vor der erwarteten Menstruation (am 26. Tag bei einem 28-Tage-Zyklus) durchgeführt. Diese Methode wird bei unklarer Diagnose angewendet. Um Veränderungen des Endometriums im sogenannten „Implantationsfenster“ zu untersuchen, wird am sechsten Tag nach dem Eisprung eine Biopsie durchgeführt.
Behandlung
Bei der Diagnose von NLF (laut rektalen Temperaturdiagrammen beträgt die Dauer der 2. Phase weniger als 11 Tage, es wird ein schrittweiser Temperaturanstieg beobachtet, laut Endometriumbiopsiedaten kommt es zu einer unzureichenden sekretorischen Transformation des Endometriums, niedrige Progesteronspiegel im Blutserum) ist es notwendig, die Ursache solcher Störungen zu ermitteln.
Wenn die NLF mit einer Hyperprolaktinämie einhergeht, wird eine MRT des Gehirns durchgeführt. Alternativ kann eine Röntgenaufnahme des Schädels (Sella-Turcica-Region) durchgeführt werden.
Das erste Stadium einer Hyperprolaktinämie ist der Ausschluss eines Hypophysenadenoms, das chirurgisch behandelt werden muss. Liegen keine signifikanten Veränderungen vor, gilt die Hyperprolaktinämie als funktionell, und zur Normalisierung des Prolaktinspiegels wird eine Bromocriptin-Behandlung verordnet. Die Anfangsdosis von Bromocriptin beträgt 1,25 mg/Tag für 2 Wochen. Nach Überwachung des Prolaktinspiegels wird die Dosis auf 2,5 mg/Tag erhöht, falls sich die Werte nicht normalisieren. Bei einem signifikanten Anstieg des Prolaktinspiegels beträgt die Anfangsdosis 2,5 mg/Tag. Tritt eine Schwangerschaft ein, sollte Bromocriptin abgesetzt werden.
Bei einer Hypothyreose wird die Art der Schilddrüsenerkrankung gemeinsam mit einem Endokrinologen bestimmt. In jedem Fall ist eine tägliche Levothyroxin-Natrium-Therapie angezeigt, die Dosis wird individuell gewählt, bis sich der TSH-Spiegel normalisiert hat. Tritt eine Schwangerschaft ein, sollte die Levothyroxin-Natrium-Therapie fortgesetzt werden. Die Frage, ob eine Dosiserhöhung im ersten Schwangerschaftstrimester sinnvoll ist, wird gemeinsam mit einem Endokrinologen nach Vorliegen der Ergebnisse einer Hormonuntersuchung (TSH-Spiegel, freies Thyroxin) entschieden.
Die Korrektur des NLF erfolgt auf eine von zwei Arten. Die erste Möglichkeit ist die Stimulation des Eisprungs, die zweite ist die Ersatztherapie mit Progesteronpräparaten.
Die erste Behandlungsoption ist die Eisprungstimulation mit Clomifencitrat. Diese Behandlungsmethode basiert auf der Tatsache, dass die meisten Störungen der Lutealphase in der Follikelphase des Zyklus entstehen. Ständig reduzierte Progesteronspiegel in der 2. Phase sind eine Folge einer gestörten Follikulogenese in der 1. Zyklusphase. Diese Störung lässt sich durch niedrige Dosen von Clomifencitrat in der frühen Follikelphase erfolgreicher korrigieren als durch die Gabe von Progesteron in der 2. Zyklusphase.
Im 1. Zyklus beträgt die Clomifencitrat-Dosis 50 mg/Tag vom 5. bis zum 9. Tag des Menstruationszyklus. Die Wirksamkeit wird mithilfe von rektalen Temperaturkurven, Messungen des Progesteronspiegels in der 2. Zyklusphase oder dynamischem Ultraschall überwacht. Tritt im 2. Zyklus der Ovulationsstimulation keine ausreichende Wirkung auf, sollte die Clomifencitrat-Dosis vom 5. bis zum 9. Zyklustag auf 100 mg/Tag erhöht werden. Die maximal mögliche Dosis im 3. Zyklus der Ovulationsstimulation beträgt 150 mg/Tag. Eine solche Dosiserhöhung ist nur bei guter Verträglichkeit des Arzneimittels möglich (keine starken Schmerzen im Unterleib und unteren Rücken und keine anderen Anzeichen einer ovariellen Überstimulation).
Die zweite Behandlungsoption: Ersatztherapie mit Progesteronpräparaten, die die vollständige sekretorische Transformation des Endometriums fördern und bei Patientinnen mit habitueller Fehlgeburt mit erhaltenem Eisprung die gewünschte Wirkung erzielen. Darüber hinaus wurde in den letzten Jahren festgestellt, dass die Gabe von Progesteronpräparaten nicht nur eine hormonelle, sondern auch eine immunmodulatorische Wirkung hat und Abstoßungsreaktionen von immunkompetenten Zellen im Endometrium unterdrückt. Insbesondere wurde eine ähnliche Wirkung für Dihydrogesteron in einer Dosis von 20 mg/Tag beschrieben. Zur Ersatztherapie wird Dydrogesteron in einer Dosis von 20 mg/Tag oral oder mikronisiertes Progesteron vaginal in einer Dosis von 200 mg/Tag angewendet. Die Behandlung beginnt am 2. Tag nach dem Eisprung (am Tag nach dem Anstieg der Rektaltemperatur) und dauert 10 Tage. Falls eine Schwangerschaft eintritt, sollte die Behandlung mit Progesteronpräparaten fortgesetzt werden.
Moderne Forschungen haben die Wirksamkeit von humanem Choriongonadotropin bei der Behandlung wiederholter Fehlgeburten nicht bestätigt.
Bei Hyperandrogenismus (Ovarial- oder Nebennierengenese) bei Patientinnen mit habitueller Fehlgeburt ist eine medikamentöse Behandlung aufgrund der Wirkung von Androgenen auf die Vollständigkeit des Eisprungs und den Zustand des Endometriums angezeigt. Im Falle einer Verletzung der Biosynthese von Nebennierenandrogenen ist deren virilisierende Wirkung auf den weiblichen Fötus möglich, daher wird im Interesse des Fötus eine Steroidtherapie durchgeführt.
Hyperandrogenismus der Ovarialen Genese (polyzystische Ovarien)
Anamnese, körperliche Untersuchung und Ergebnisse spezieller Untersuchungen
- Anamnese: Späte Menarche, Zyklusstörungen wie Oligomenorrhoe (meist primär, seltener sekundär). Schwangerschaften sind selten, meist spontan im ersten Trimenon abgebrochen, mit langen Phasen der Unfruchtbarkeit zwischen den Schwangerschaften.
- Untersuchung: Hirsutismus, Akne, Dehnungsstreifen, hoher Body-Mass-Index (optional).
- Rektale Temperaturdiagramme: anovulatorische Zyklen wechseln sich mit Zyklen mit Eisprung und NLF ab.
- Hormonuntersuchung: Hoher Testosteronspiegel, FSH- und LH-Spiegel können erhöht sein, LH/FSH-Verhältnis ist größer als 3. Ultraschall: polyzystische Eierstöcke.
Behandlung
Nichtmedikamentöse Behandlung
Gewichtsverlust – Diättherapie, körperliche Aktivität.
Medikamentöse Behandlung
- Orlistat in einer Dosis von 120 mg zu jeder Hauptmahlzeit. Die Dauer des Kurses wird unter Berücksichtigung der Wirkung und Verträglichkeit bestimmt.
- Vorläufige Testosteronsenkung mit Präparaten, die Cyproteronacetat (2 mg) und EE (35 mcg) enthalten, für 3 Menstruationszyklen.
- Absetzen der Kontrazeptiva, hormonelle Unterstützung der zweiten Zyklusphase (Gestagentherapie) – Dydrogesteron in einer Dosis von 20 mg/Tag vom 16. bis 25. Tag des Menstruationszyklus. Wenn kein spontaner Eisprung auftritt, fahren Sie mit der nächsten Phase fort.
- Stimulation des Eisprungs mit Clomifencitrat in einer Anfangsdosis von 50 mg/Tag vom 5. bis 9. Tag des Menstruationszyklus bei gleichzeitiger Therapie mit Gestagenen (Dydrogesteron in einer Dosis von 20 mg/Tag vom 16. bis 25. Tag des Zyklus) und Dexamethason (0,5 mg).
- Liegt keine Schwangerschaft vor, wird die Clomifencitrat-Dosis auf 100–150 mg/Tag erhöht. In der zweiten Zyklusphase werden Gestagene und 0,5 mg Dexamethason verabreicht. Obwohl Dexamethason lediglich den Androgenspiegel in den Nebennieren senkt, wurde festgestellt, dass Eisprung und Empfängnis bei der Behandlung mit Clomifencitrat und Dexamethason signifikant häufiger auftreten als bei alleiniger Anwendung von Clomifencitrat [12].
- Es werden drei Zyklen der Ovulationsstimulation durchgeführt, danach wird eine Pause von drei Menstruationszyklen mit gestagener Unterstützung und eine Entscheidung über eine chirurgische Behandlung mittels laparoskopischem Zugang (Keilresektion der Eierstöcke, Laservaporisation) empfohlen.
Weitere Betreuung des Patienten
Das Schwangerschaftsmanagement sollte bis zur 16. Schwangerschaftswoche von einer gestagenen Unterstützung begleitet werden (Dydrogesteron in einer Dosis von 20 mg/Tag oder mikronisiertes Progesteron in einer Dosis von 200 mg/Tag). Dexamethason wird nur im ersten Schwangerschaftstrimester verschrieben. Die Überwachung ist obligatorisch, um eine isthmisch-zervikale Insuffizienz rechtzeitig zu diagnostizieren und gegebenenfalls chirurgisch zu korrigieren.
Adrenaler Hyperandrogenismus (pubertäres und postpubertäres Adrenogenitales Syndrom)
Das Adrenogenitale Syndrom (AGS) ist eine Erbkrankheit, die mit einer Störung der Hormonsynthese der Nebennierenrinde aufgrund einer Schädigung von Genen einhergeht, die für die Synthese verschiedener Enzymsysteme verantwortlich sind. Die Krankheit wird autosomal-rezessiv vererbt, wobei mutierte Gene von beiden gesunden Eltern weitergegeben werden.
In 90 % der Fälle wird das Adrenogenitale Syndrom durch Mutationen im CYP21B-Gen verursacht, die zu einer Störung der Synthese der 21-Hydroxylase führen.
Anamnese, körperliche Untersuchung und Ergebnisse spezieller Untersuchungen
- Anamnese: späte Menarche, leicht verlängerter Menstruationszyklus, mögliche Oligomenorrhoe, spontane Fehlgeburten im ersten Trimenon, mögliche Unfruchtbarkeit.
- Untersuchung: Akne, Hirsutismus, androider Körpertyp (breite Schultern, schmales Becken), Klitorishypertrophie.
- Rektale Temperaturdiagramme: anovulatorische Zyklen wechseln sich mit Zyklen mit Eisprung und NLF ab.
- Hormontest: hohe Werte von 17-OP, DHEAS.
- Ultraschall: Eierstöcke unverändert.
Ein pathognomonisches Zeichen außerhalb der Schwangerschaft ist eine Erhöhung der Konzentration von 17-OP im Blutplasma.
Derzeit wird ein Test mit ACTH verwendet, um die latente, nicht-klassische Form des adrenalen Hyperandrogenismus zu diagnostizieren. Für diesen Test wird Synacthen verwendet - ein synthetisches Polypeptid, das die Eigenschaften von endogenem ACTH besitzt, d. h. es stimuliert die Anfangsphasen der Synthese von Steroidhormonen aus Cholesterin in den Nebennieren.
Synacthen-Test (ein ACTH-Analogon): 1 ml (0,5 mg) Synacthen wird subkutan in die Schulter injiziert. Zunächst wird der Ausgangsgehalt an 17-OP und Cortisol in der morgendlichen 9-Stunden-Blutplasmaprobe bestimmt. 9 Stunden nach der Injektion wird eine Kontrollblutprobe entnommen, um den 17-OP- und Cortisolspiegel zu bestimmen. Der Determinationsindex (D) wird anschließend nach folgender Formel berechnet:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP – 0,018 × Cortisol/17-OP
Wenn der D-Koeffizient kleiner oder gleich 0,069 ist, deutet dies darauf hin, dass kein adrenaler Hyperandrogenismus vorliegt. Wenn der D-Koeffizient größer als 0,069 ist, sollte davon ausgegangen werden, dass der Hyperandrogenismus durch eine Funktionsstörung der Nebennieren verursacht wird.
Medikamentöse Behandlung
Die wichtigste Säule der Behandlung von Hyperandrogenismus aufgrund eines 21-Hydroxylase-Mangels sind Glukokortikoide, die zur Unterdrückung einer übermäßigen Androgensekretion eingesetzt werden.
Weitere Betreuung des Patienten
Aufgrund der virilisierenden Wirkung mütterlicher Androgene auf den Fötus wird bei gesicherter Diagnose eines Nebennierenhyperandrogenismus eine Behandlung mit Dexamethason in einer Anfangsdosis von 0,25 mg vor der Schwangerschaft verordnet und in einer individuell gewählten Dosis (von 0,5 bis 1 mg) während der gesamten Schwangerschaft fortgesetzt. Bei einer Frau mit habitueller Fehlgeburt und Nebennierenhyperandrogenismus ist ein Abbruch der Behandlung nicht ratsam, da die Häufigkeit von Fehlgeburten ohne Behandlung 14 % und bei Fortsetzung 9 % erreicht.
Da Patientinnen mit adrenogenitalem Syndrom dieses Gen an den Fötus weitergeben können, ist eine pränatale Diagnostik notwendig: In der 17.–18. Schwangerschaftswoche wird ein Bluttest zur Bestimmung des 17-OP-Gehalts der Mutter verordnet. Bei erhöhtem 17-OP-Gehalt im Fruchtwasser wird dessen Konzentration bestimmt. Ist der 17-OP-Gehalt im Fruchtwasser erhöht, spricht man vom adrenogenitalem Syndrom beim Fötus. Leider lässt sich der 17-OP-Gehalt im Fruchtwasser nicht auf den Schweregrad des adrenogenitalen Syndroms (leichte oder schwere Form mit Salzverlust) zurückführen. Über die Fortführung der Schwangerschaft entscheiden in dieser Situation die Eltern.
Wenn der Vater des Kindes Träger des Gens für das Adrenogenitalsyndrom ist und es in der Familie Fälle von Kindern mit diesem Syndrom gab, erhält die Patientin, auch ohne adrenalen Hyperandrogenismus, zum Wohle des Fötus (um eine Virilisierung des weiblichen Fötus zu verhindern) Dexamethason in einer Dosis von 20 µg/kg Körpergewicht, maximal 1,5 mg/Tag in 2–3 Dosen nach den Mahlzeiten. In der 17.–18. Woche, nach der Bestimmung des Geschlechts des Fötus und der Expression des Gens für das Adrenogenitalsyndrom (basierend auf den Ergebnissen der Amniozentese), wird die Behandlung bis zum Ende der Schwangerschaft fortgesetzt, wenn der Fötus ein Mädchen mit Adrenogenitalsyndrom ist. Wenn der Fötus ein Junge oder ein Mädchen ist, das kein Träger des Gens für das Adrenogenitalsyndrom ist, kann die Dexamethasonbehandlung abgebrochen werden.
Wenn eine Frau mit habitueller Fehlgeburt an adrenalem Hyperandrogenismus leidet, wird die Dexamethason-Behandlung während der gesamten Schwangerschaft durchgeführt und erst nach der Entbindung abgesetzt. Am dritten Tag nach der Entbindung wird die Dexamethason-Dosis schrittweise reduziert (um 0,125 mg alle 3 Tage), bis sie in der postpartalen Phase vollständig abgesetzt wird.
Hyperandrogenismus gemischter Genese (Eierstock- und Nebennierenrinden-)
Anamnese, körperliche Untersuchung und Ergebnisse spezieller Untersuchungen
- Anamnese: Späte Menarche, Zyklusstörungen wie Oligomenorrhoe (meist primär, seltener sekundär), Amenorrhoe, mögliche Verletzungen, Gehirnerschütterungen. Schwangerschaften sind selten, meist spontan im ersten Trimenon abgebrochen, lange Phasen der Unfruchtbarkeit zwischen den Schwangerschaften.
- Körperliche Untersuchung: Hirsutismus, Akne, Striae, Acanthosis nigricans, hoher Body-Mass-Index, Bluthochdruck.
- Rektale Temperaturdiagramme: anovulatorische Zyklen wechseln sich mit Zyklen mit Eisprung und NLF ab.
- Hormonuntersuchung: Hoher Testosteronspiegel, FSH- und LH-Spiegel können erhöht sein, LH/FSH-Verhältnis größer als 3, hohe DHEAS-, 17-OP-Spiegel, Hyperprolaktinämie kann vorliegen.
- Ultraschall: polyzystische Eierstöcke.
- Elektroenzephalographie: Veränderungen der bioelektrischen Aktivität des Gehirns.
- Hyperinsulinämie, Fettstoffwechselstörung (hoher Cholesterinspiegel, Lipoproteine niedriger Dichte und Lipoproteine sehr niedriger Dichte), verminderte Glukosetoleranz oder erhöhter Blutzuckerspiegel.
Behandlung
Nichtmedikamentöse Behandlung
Gewichtsverlust (kalorienarme Ernährung, körperliche Aktivität).
Medikamentöse Behandlung
Die erste Phase – bei Vorliegen einer Insulinresistenz wird empfohlen, Metformin in einer Tagesdosis von 1000–1500 mg zu verschreiben, um die Insulinsensitivität zu erhöhen.
Die zweite Phase – bei schweren Menstruationszyklusstörungen und hohem Testosteronspiegel wird empfohlen, 3 Monate lang Medikamente mit antiandrogener Wirkung zu verschreiben, die Cyproteronacetat (2 mg) und Ethinylestradiol (35 µg) enthalten.
Die dritte Phase besteht in der Stimulation des Eisprungs, gefolgt von einer gestagenen Unterstützung (das Schema ist oben beschrieben) und der Einnahme von Dexamethason in einer Tagesdosis von 0,25–0,5 mg.
Bei Hyperprolaktinämie und Hypothyreose sollte in den Zyklen der Ovulationsstimulation eine entsprechende Medikamentenkorrektur vorgenommen werden. Tritt eine Schwangerschaft ein, sollte Bromocriptin abgesetzt und die Levothyroxin-Behandlung fortgesetzt werden.
Wenn die Stimulation des Eisprungs wirkungslos ist, muss über die Verschreibung direkter Eisprungauslöser, die Zweckmäßigkeit einer chirurgischen Behandlung polyzystischer Eierstöcke oder einer In-vitro-Fertilisation entschieden werden.
Weitere Betreuung des Patienten
Bei Patienten mit metabolischem Syndrom wird die Schwangerschaft häufig durch arterielle Hypertonie, Nephropathie und Hyperkoagulation erschwert. Daher ist es erforderlich, den Blutdruck und Hämostasiogramme bereits in den frühen Stadien der Schwangerschaft zu überwachen und die auftretenden Störungen (falls erforderlich) mit blutdrucksenkenden Medikamenten, Thrombozytenaggregationshemmern und Antikoagulanzien zu korrigieren. Bis zur 16. Schwangerschaftswoche werden gestagene Medikamente verschrieben - Didrogesteron in einer Dosis von 20 mg / Tag oder mikronisiertes Progesteron in einer Dosis von 200 mg / Tag in 2 Dosen.
Alle Frauen mit Hyperandrogenismus stellen eine Risikogruppe für die Entwicklung einer isthmisch-zervikalen Insuffizienz dar. Die Überwachung des Gebärmutterhalszustandes sollte ab der 16. Schwangerschaftswoche durchgeführt werden, gegebenenfalls - chirurgische Korrektur der isthmisch-zervikalen Insuffizienz.
Immunologische Ursachen einer habituellen Fehlgeburt
Derzeit ist bekannt, dass etwa 80 % aller bisher ungeklärten Fälle wiederholter Fehlgeburten (nach Ausschluss genetischer, anatomischer und hormoneller Ursachen) mit Immunerkrankungen in Zusammenhang stehen. Man unterscheidet Autoimmun- und Alloimmunerkrankungen, die zu habituellen Fehlgeburten führen.
Bei Autoimmunprozessen wird das eigene Gewebe des Immunsystems zum Ziel der Aggression, d. h. die Immunantwort richtet sich gegen die eigenen Antigene. In dieser Situation leidet der Fötus sekundär unter der Schädigung des Gewebes der Mutter.
Bei Alloimmunerkrankungen richtet sich die Immunreaktion einer Frau gegen embryonale/fetale Antigene, die sie vom Vater erhalten hat und die für den Körper der Mutter möglicherweise fremd sind.
Zu den häufigsten Autoimmunerkrankungen bei Patientinnen mit habitueller Fehlgeburt zählen Antiphospholipid-, Thyreoidea- und antinukleäre Autoantikörper im Serum. So wurde festgestellt, dass 31 % der Frauen mit habitueller Fehlgeburt außerhalb der Schwangerschaft Autoantikörper gegen Thyreoglobulin und Schilddrüsenperoxidase (mikrosomale Schilddrüsenperoxidase-Autoantikörper) aufweisen; in diesen Fällen steigt das Risiko einer spontanen Fehlgeburt im ersten Schwangerschaftstrimester auf 20 %. Bei habitueller Fehlgeburt weist das Vorhandensein von antinukleären und Thyreoidea-Antikörpern auf die Notwendigkeit weiterer Untersuchungen hin, um den Autoimmunprozess zu identifizieren und die Diagnose zu bestätigen.
Das Antiphospholipid-Syndrom (APS) ist nach wie vor eine allgemein anerkannte Autoimmunerkrankung, die zum Tod des Embryos/Fötus führt.
Alloimmunerkrankungen
Zu den alloimmunen Prozessen, die derzeit zur Abstoßung des Fötus führen, gehören das Vorhandensein einer erhöhten (mehr als 3) Anzahl gemeinsamer Antigene des Haupthistokompatibilitätskomplexsystems bei Ehepartnern (häufig bei blutsverwandten Ehen beobachtet); niedrige Konzentrationen von Blockierungsfaktoren im Serum der Mutter; erhöhte Konzentrationen natürlicher Killerzellen (NK-Zellen CD56, CD16) im Endometrium und im peripheren Blut der Mutter sowohl außerhalb als auch während der Schwangerschaft; hohe Konzentrationen einer Reihe von Zytokinen im Endometrium und Blutserum, insbesondere γ-Interferon, Tumornekrosefaktor a, Interleukine-1 und 2.
Derzeit werden alloimmune Faktoren, die zu frühen Schwangerschaftsverlusten führen, sowie Möglichkeiten zur Korrektur dieser Erkrankungen untersucht. Über die Therapiemethoden besteht kein Konsens. Einigen Forschern zufolge hat eine aktive Immunisierung mit Spenderlymphozyten keinen signifikanten Effekt, während andere Autoren einen signifikanten positiven Effekt bei einer solchen Immunisierung und Behandlung mit Immunglobulinen beschreiben.
Derzeit ist Progesteron einer der immunmodulatorischen Wirkstoffe in der Frühschwangerschaft. Studien haben insbesondere die Rolle von Dydrogesteron in einer Tagesdosis von 20 mg bei Frauen mit habitueller Fehlgeburt im ersten Schwangerschaftstrimester mit erhöhtem CD56-Zellspiegel im Endometrium nachgewiesen.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Genetisch bedingte Thrombophilien
Zu den thrombophilen Zuständen während der Schwangerschaft, die zu habituellen Fehlgeburten führen, zählen die folgenden Formen genetisch bedingter Thrombophilien.
- Antithrombin-III-Mangel.
- Faktor-V-Mutation (Leiden-Mutation).
- Protein-C-Mangel.
- Protein-S-Mangel.
- Prothrombin-Genmutation G20210A.
- Hyperhomocysteinämie.
Eine Untersuchung zur Erkennung seltener Ursachen einer Thrombophilie ist in folgenden Fällen erforderlich:
- Familienanamnese – Thromboembolie vor dem 40. Lebensjahr bei Verwandten;
- zuverlässige Episoden von venösen und/oder arteriellen Thrombosen vor dem 40. Lebensjahr;
- wiederkehrende Thrombosen beim Patienten und seinen unmittelbaren Angehörigen;
- thromboembolische Komplikationen während der Schwangerschaft und nach der Geburt bei Anwendung hormoneller Verhütungsmittel;
- wiederholte Schwangerschaftsverluste, Totgeburten, intrauterine Wachstumsverzögerung, Plazentaablösung;
- Früh einsetzende Präeklampsie, HELLP-Syndrom.
Infektiöse Ursachen für habituelle Fehlgeburten
Die Rolle des infektiösen Faktors als Ursache für habituelle Fehlgeburten wird derzeit breit diskutiert. Es ist bekannt, dass eine Primärinfektion in der Frühschwangerschaft lebensunfähige Embryoschäden verursachen kann, die zu sporadischen spontanen Fehlgeburten führen. Die Wahrscheinlichkeit einer Reaktivierung der Infektion mit der Folge wiederholter Fehlgeburten ist jedoch vernachlässigbar. Zudem wurden bisher keine Mikroorganismen gefunden, die habituelle Fehlgeburten auslösen. Studien der letzten Jahre haben gezeigt, dass die meisten Frauen mit habituellen Fehlgeburten und chronischer Endometritis zwei bis drei oder mehr Arten obligat anaerober Mikroorganismen und Viren im Endometrium aufweisen.
Laut VM Sidelnikova et al. wurde bei Frauen mit habituellen Fehlgeburten die Diagnose einer chronischen Endometritis außerhalb der Schwangerschaft in 73,1 % der Fälle histologisch bestätigt und in 86,7 % der Fälle das Fortbestehen opportunistischer Mikroorganismen im Endometrium beobachtet, was sicherlich die Ursache für die Aktivierung immunpathologischer Prozesse sein kann. Gemischte persistente Virusinfektionen (Herpes-simplex-Virus, Coxsackie A, Coxsackie B, Enteroviren 68–71, Cytomegalovirus) kommen bei Patientinnen mit habituellen Fehlgeburten deutlich häufiger vor als bei Frauen mit normaler Geburtsanamnese. K. Kohut et al. (1997) zeigten, dass der Prozentsatz entzündlicher Veränderungen im Endometrium und Dezidualgewebe bei Patientinnen mit primären wiederkehrenden Fehlgeburten deutlich höher ist als bei Frauen nach Fehlgeburten mit mindestens einer Geburt zum errechneten Termin.
Die bakterielle und virale Besiedlung des Endometriums resultiert in der Regel aus der Unfähigkeit des Immunsystems und der unspezifischen Abwehrkräfte des Körpers (Komplementsystem, Phagozytose), den Infektionserreger vollständig zu eliminieren. Gleichzeitig wird seine Ausbreitung durch die Aktivierung von T-Lymphozyten (T-Helferzellen, natürliche Killerzellen) und Makrophagen begrenzt. In allen oben genannten Fällen kommt es zur Persistenz von Mikroorganismen, gekennzeichnet durch die Anziehung mononukleärer Phagozyten, natürlicher Killerzellen und T-Helferzellen, die verschiedene Zytokine synthetisieren, an den Ort der chronischen Entzündung. Offensichtlich verhindert dieser Zustand des Endometriums die Entstehung einer lokalen Immunsuppression in der Präimplantationsphase, die notwendig ist, um eine Schutzbarriere zu bilden und die Abstoßung eines halbfremden Fötus zu verhindern.
In diesem Zusammenhang sollte bei Frauen mit habitueller Fehlgeburt vor der Schwangerschaft eine chronische Endometritis diagnostiziert werden. Um diese Diagnose zu stellen oder auszuschließen, wird am 7.-8. Tag des Menstruationszyklus eine Endometriumbiopsie mit histologischer Untersuchung, PCR und bakteriologischer Untersuchung des Materials aus der Gebärmutterhöhle durchgeführt. Bei der Überprüfung der Diagnose wird die chronische Endometritis gemäß den Standards für die Behandlung entzündlicher Erkrankungen der Beckenorgane behandelt.

