Facharzt des Artikels
Neue Veröffentlichungen
Atemwegsbronchus
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Mit abnehmendem Kaliber der Bronchien werden ihre Wände dünner, Höhe und Anzahl der Epithelzellreihen nehmen ab. Nichtknorpelige (oder membranöse) Bronchiolen haben einen Durchmesser von 1-3 mm, das Epithel enthält keine Becherzellen, ihre Rolle übernehmen Clara-Zellen und die submuköse Schicht geht ohne klare Grenze in die Adventitia über. Membranöse Bronchiolen gehen in terminale Bronchiolen mit einem Durchmesser von etwa 0,7 mm über, ihr Epithel ist einreihig. Von den terminalen Bronchiolen zweigen respiratorische Bronchiolen mit einem Durchmesser von 0,6 mm ab. Respiratorische Bronchiolen sind durch Poren mit den Alveolen verbunden. Terminale Bronchiolen sind luftleitend, respiratorische Bronchiolen sind an der Luftleitung und dem Gasaustausch beteiligt.
Der gesamte Querschnitt der terminalen Atemwege ist um ein Vielfaches größer als der Querschnitt der Luftröhre und der großen Bronchien (53–186 cm² gegenüber 7–14 cm² ), doch die Bronchiolen tragen nur zu 20 % zum Luftstromwiderstand bei. Aufgrund des geringen Widerstands der terminalen Atemwege können frühe Bronchiolenschäden asymptomatisch sein, ohne Veränderungen bei Funktionstests auftreten und ein Zufallsbefund bei hochauflösenden Computertomografien sein.
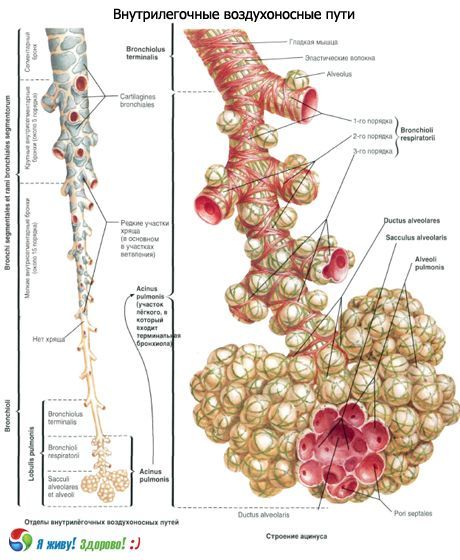
Gemäß der Internationalen Histologischen Klassifikation werden die Äste der terminalen Bronchiole als primärer Lungenläppchen oder Acini bezeichnet. Dies ist die zahlreichste Struktur der Lunge, in der der Gasaustausch stattfindet. Jede Lunge besitzt 150.000 Acini. Der Acini eines Erwachsenen hat einen Durchmesser von 7–8 mm und besitzt eine oder mehrere respiratorische Bronchiolen. Das sekundäre Lungenläppchen ist die kleinste Einheit der Lunge und wird durch Septen aus Bindegewebe begrenzt. Sekundäre Lungenläppchen bestehen aus 3 bis 24 Acini. Der zentrale Teil enthält eine Lungenbronchiole und eine Arterie. Sie werden als Nucleus lobularis oder „zentrilobuläre Struktur“ bezeichnet. Sekundäre Lungenläppchen sind durch interlobuläre Septen getrennt, die Venen und Lymphgefäße sowie Arterien- und Bronchiolenäste im Nucleus lobularis enthalten. Der sekundäre Lungenläppchen hat normalerweise eine polygonale Form, wobei die Länge jeder der ihn bildenden Seiten 1–2,5 cm beträgt.
Das Bindegewebsgerüst des Läppchens besteht aus interlobulären Septen, intralobulärem, zentrilobulärem, peribronchovaskulärem und subpleuralem Interstitium.
Die terminale Bronchiole ist in 14–16 respiratorische Bronchiolen erster Ordnung unterteilt, die wiederum dichotom in respiratorische Bronchiolen zweiter Ordnung unterteilt sind, die wiederum dichotom in respiratorische Bronchiolen dritter Ordnung unterteilt sind. Jede respiratorische Bronchiole dritter Ordnung ist in Alveolargänge (100 μm Durchmesser) unterteilt. Jeder Alveolargang endet in zwei Alveolarsäckchen.
Die Alveolargänge und -säcke weisen Ausstülpungen (Bläschen) in ihren Wänden auf – die Alveolen. Jeder Alveolargang enthält etwa 20 Alveolen. Die Gesamtzahl der Alveolen beträgt 600–700 Millionen mit einer Gesamtfläche von etwa 40 m² beim Ausatmen und 120 m² beim Einatmen.
Im Epithel der Bronchiolen respiratorischer Atemwege nimmt die Zahl der Flimmerzellen progressiv ab und die Zahl der nicht-flimmernden kubischen Zellen und Clara-Zellen nimmt zu. Die Alveolargänge sind mit Plattenepithel ausgekleidet.
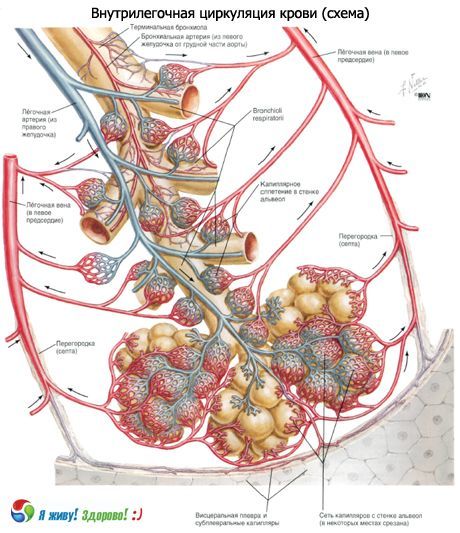
Elektronenmikroskopische Untersuchungen haben wesentlich zum modernen Verständnis der Alveolenstruktur beigetragen. Die Wände sind zwei benachbarten Alveolen großflächig gemeinsam. Das Alveolarepithel bedeckt die Wand beidseitig. Zwischen den beiden Schichten der Epithelauskleidung befindet sich ein Interstitium, in dem sich der Septumraum und ein Netzwerk von Blutkapillaren abgrenzen. Der Septumraum enthält Bündel dünner Kollagenfasern, Retikulin und elastische Fasern, einige Fibroblasten und freie Zellen (Histiozyten, Lymphozyten, neutrophile Leukozyten). Sowohl das Epithel als auch das Endothel der Kapillaren liegen auf einer 0,05–0,1 µm dicken Basalmembran. An einigen Stellen sind die subepithelialen und subendothelialen Membranen durch den Septumraum getrennt, an anderen Stellen berühren sie sich und bilden eine einzige Alveolarkapillarmembran. Somit sind das Alveolarepithel, die Alveolarkapillarmembran und die Endothelzellschicht Bestandteile der Luft-Blut-Schranke, durch die der Gasaustausch stattfindet.
Das Alveolarepithel ist heterogen; darin werden drei Zelltypen unterschieden. Alveolozyten (Pneumozyten) vom Typ I bedecken den größten Teil der Oberfläche der Alveolen. Durch sie findet der Gasaustausch statt.
Alveolozyten (Pneumozyten) Typ II, auch große Alveolozyten genannt, sind rund und ragen in das Lumen der Alveolen hinein. Auf ihrer Oberfläche befinden sich Mikrovilli. Das Zytoplasma enthält zahlreiche Mitochondrien, ein gut entwickeltes granuläres endoplasmatisches Retikulum und weitere Organellen, von denen die charakteristischsten membrangebundenen osmiophilen Lamellenkörper sind. Sie bestehen aus einer elektronendichten, geschichteten Substanz, die Phospholipide sowie Protein- und Kohlenhydratkomponenten enthält. Wie sekretorische Granula werden Lamellenkörper aus der Zelle freigesetzt und bilden einen dünnen (ca. 0,05 µm) Tensidfilm, der die Oberflächenspannung reduziert und so den Kollaps der Alveolen verhindert.
Alveolozyten des Typs III, auch Bürstenzellen genannt, zeichnen sich durch kurze Mikrovilli an der apikalen Oberfläche, zahlreiche Vesikel im Zytoplasma und Mikrofibrillenbündel aus. Sie dienen vermutlich der Flüssigkeitsabsorption und der Tensidkonzentration bzw. der Chemorezeption. Romanova LK (1984) schlug ihre neurosekretorische Funktion vor.
Im Lumen der Alveolen befinden sich normalerweise einige Makrophagen, die Staub und andere Partikel aufnehmen. Der Ursprung der Alveolarmakrophagen aus Blutmonozyten und Gewebehistiozyten gilt derzeit als gesichert.
Die Kontraktion der glatten Muskulatur führt zu einer Verkleinerung der Alveolenbasis und einer Veränderung der Blasenkonfiguration – sie verlängern sich. Es sind diese Veränderungen und nicht die Ruptur der Trennwände, die Schwellungen und Emphysemen zugrunde liegen.
Die Konfiguration der Alveolen wird durch die Elastizität ihrer Wände, die durch die Vergrößerung des Brustkorbvolumens gedehnt werden, und durch die aktive Kontraktion der glatten Muskulatur der Bronchiolen bestimmt. Daher ist bei gleichem Atemvolumen eine unterschiedliche Dehnung der Alveolen in verschiedenen Segmenten möglich. Der dritte Faktor, der die Konfiguration und Stabilität der Alveolen bestimmt, ist die Oberflächenspannung, die an der Grenze zweier Umgebungen entsteht: der Luft, die die Alveole füllt, und dem Flüssigkeitsfilm, der ihre Innenfläche auskleidet und das Epithel vor dem Austrocknen schützt.
Um der Oberflächenspannungskraft (T), die die Alveolen zusammenzudrücken versucht, entgegenzuwirken, ist ein bestimmter Druck (P) erforderlich. Der Wert von P ist umgekehrt proportional zum Krümmungsradius der Oberfläche, was sich aus der Laplace-Gleichung ergibt: P = T / R. Daraus folgt, dass der Druck, der zur Aufrechterhaltung eines bestimmten Alveolenvolumens (bei konstantem T) erforderlich ist, umso höher ist, je kleiner der Krümmungsradius der Oberfläche ist. Berechnungen haben jedoch gezeigt, dass dieser Druck um ein Vielfaches höher sein sollte als der tatsächlich vorhandene intraalveoläre Druck. Beim Ausatmen beispielsweise sollten die Alveolen kollabieren, was jedoch nicht geschieht, da die Stabilität der Alveolen bei geringen Volumina durch eine oberflächenaktive Substanz - ein Tensid - gewährleistet wird, das die Oberflächenspannung des Films verringert, wenn die Fläche der Alveolen abnimmt. Dies ist der sogenannte antiatelektatische Faktor, der 1955 von Pattle entdeckt wurde und aus einem Komplex von Substanzen mit Protein-Kohlenhydrat-Lipid-Charakter besteht, der viel Lecithin und andere Phospholipide enthält. Surfactant wird im Atmungsabschnitt von Alveolarzellen produziert, die zusammen mit den Zellen des Oberflächenepithels die Alveolen von innen auskleiden. Alveolarzellen sind reich an Organellen, ihr Protoplasma enthält große Mitochondrien, daher zeichnen sie sich durch eine hohe Aktivität oxidativer Enzyme aus, sie enthalten auch unspezifische Esterasen, alkalische Phosphatase und Lipasen. Von größtem Interesse sind die in diesen Zellen ständig gefundenen Einschlüsse, die durch Elektronenmikroskopie bestimmt wurden. Dies sind osmiophile Körper von ovaler Form, 2-10 µm Durchmesser, einer geschichteten Struktur, die durch eine einzelne Membran begrenzt wird.
Surfactant-System der Lunge
Das Surfactant-System der Lunge erfüllt mehrere wichtige Funktionen. Oberflächenaktive Substanzen der Lunge reduzieren die Oberflächenspannung und den Belüftungsaufwand, stabilisieren die Alveolen und verhindern deren Atelektase. Dabei steigt die Oberflächenspannung beim Einatmen an und sinkt beim Ausatmen, bis sie am Ende der Ausatmung einen Wert nahe Null erreicht. Surfactant stabilisiert die Alveolen, indem es die Oberflächenspannung sofort senkt, wenn das Volumen der Alveolen abnimmt, und erhöht, wenn das Volumen der Alveolen beim Einatmen zunimmt.
Tenside schaffen zudem die Voraussetzungen für die Bildung von Alveolen unterschiedlicher Größe. Ohne Tensid würden kleine Alveolen kollabieren und Luft an größere weitergeben. Auch die Oberfläche der kleinsten Atemwege ist mit Tensid bedeckt, was ihre Durchgängigkeit gewährleistet.
Für die Funktion des distalen Lungenabschnitts ist die Durchgängigkeit des bronchoalveolären Übergangs von größter Bedeutung. Dort befinden sich die Lymphgefäße und Lymphknoten sowie die respiratorischen Bronchiolen. Das Tensid, das die Oberfläche der respiratorischen Bronchiolen bedeckt, stammt aus den Alveolen oder wird lokal gebildet. Der Ersatz des Tensids in den Bronchiolen durch die Sekretion von Becherzellen führt zu einer Verengung der kleinen Atemwege, einer Erhöhung ihres Widerstands und sogar zu einem vollständigen Verschluss.
Die Clearance des Inhalts der kleinsten Atemwege, deren Transport nicht mit dem Flimmerapparat verbunden ist, wird größtenteils durch Surfactant gewährleistet. Im Funktionsbereich des Flimmerepithels bilden sich aufgrund der Anwesenheit von Surfactant dichte (Gel-) und flüssige (Sol-)Schichten des Bronchialsekrets.
Das Surfactant-System der Lunge ist an der Aufnahme von Sauerstoff und der Regulierung seines Transports durch die Luft-Blut-Schranke sowie an der Aufrechterhaltung des optimalen Filtrationsdrucks im pulmonalen Mikrozirkulationssystem beteiligt.
Die Zerstörung des Tensidfilms durch Tween führt zu Atelektasen. Die Inhalation von Aerosolen von Lecithinverbindungen hingegen zeigt eine gute therapeutische Wirkung, beispielsweise bei Atemversagen bei Neugeborenen, bei denen der Film beim Einatmen von Fruchtwasser durch Gallensäuren zerstört werden kann.
Eine Hypoventilation der Lunge führt zum Verschwinden des Surfactant-Films, und die Wiederherstellung der Ventilation in der kollabierten Lunge geht nicht mit einer vollständigen Wiederherstellung des Surfactant-Films in allen Alveolen einher.
Auch die oberflächenaktiven Eigenschaften von Tensiden verändern sich bei chronischer Hypoxie. Bei pulmonaler Hypertonie kommt es zu einer Abnahme der Tensidmenge. Wie experimentelle Studien gezeigt haben, tragen eine beeinträchtigte Durchgängigkeit der Bronchien, eine venöse Stauung im Lungenkreislauf und eine Abnahme der Atemoberfläche der Lunge zu einer Abnahme der Aktivität des Tensidsystems der Lunge bei.
Eine erhöhte Sauerstoffkonzentration in der eingeatmeten Luft führt zum Auftreten einer großen Anzahl von Membranformationen aus reifen Tensiden und osmiophilen Körpern in den Alveolarlumen, was auf die Zerstörung des Tensids an der Oberfläche der Alveolen hindeutet. Tabakrauch wirkt sich negativ auf das Tensidsystem der Lunge aus. Eine Abnahme der Oberflächenaktivität des Tensids wird durch Quarz, Asbeststaub und andere schädliche Verunreinigungen in der eingeatmeten Luft verursacht.
Laut mehreren Autoren verhindert Surfactant außerdem Transsudation und Ödeme und hat eine bakterizide Wirkung.
Der Entzündungsprozess in der Lunge führt zu Veränderungen der oberflächenaktiven Eigenschaften des Surfactants, wobei das Ausmaß dieser Veränderungen von der Aktivität der Entzündung abhängt. Bösartige Neubildungen wirken sich noch stärker negativ auf das Surfactant-System der Lunge aus. Bei ihnen nehmen die oberflächenaktiven Eigenschaften des Surfactants deutlich häufiger ab, insbesondere in der Atelektasezone.
Es liegen zuverlässige Daten zur Störung der Oberflächenaktivität von Surfactant während einer längeren (4–6 Stunden) Fluorthananästhesie vor. Operationen mit künstlichen Blutkreislaufgeräten gehen häufig mit erheblichen Störungen des Surfactant-Systems der Lunge einher. Auch angeborene Defekte des Surfactant-Systems der Lunge sind bekannt.
Tensid ist morphologisch mittels Fluoreszenzmikroskopie aufgrund der Primärfluoreszenz in Form einer sehr dünnen Schicht (0,1 bis 1 µm) in den Alveolen nachweisbar. Es ist im Lichtmikroskop nicht sichtbar und wird auch bei der Behandlung von Präparaten mit Alkohol zerstört.
Es besteht die Meinung, dass alle chronischen Atemwegserkrankungen mit einem qualitativen oder quantitativen Mangel des Surfactant-Systems der Atmungsorgane einhergehen.


 [
[