Facharzt des Artikels
Neue Veröffentlichungen
Diagnose der Stadien des Prostatakrebsverlaufs
Zuletzt überprüft: 04.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Klinisch unterscheidet man zwischen lokalisiertem (T 1-2, N 0, M 0 ), lokal fortgeschrittenem (T 3-4, N 0-1, M 0 ) und generalisiertem Krebs (T 1-4, N 0-1, M 1 ).
Patienten mit klinisch lokalisierten und lokal fortgeschrittenen Stadien werden nach dem Grad des Risikos klassifiziert (D'Amico A V. et al., 2003):
- niedrig: Stadium T 1a-c; PSA-Wert unter 10 µg/ml: Gleason-Graduierung – 2-5; in der Biopsie – einseitige Läsion unter 50 %:
- mittelschwer: Stadium T 2a; PSA-Wert unter 10 ng/ml; Gleason-Score – 3 + 4 = 7; in der Biopsie – bilaterale Läsion unter 50 %;
- hohes Stadium T2b , T3a -b; PSA-Wert: 10–20 ng/ml; Gleason-Grad: über 4 + 3 – 7; in der Biopsie: Schädigung über 50 %, perineurale Invasion;
- sehr hoch: Stadium T 4; PSA-Wert über 20 ng/ml; Gleason-Score über 8; Biopsie zeigt lymphovaskuläre Invasion.
Nachdem die Diagnose geklärt und das Ausmaß des Prozesses (lokal, lokal fortgeschritten oder generalisiert) festgestellt wurde, stehen Arzt und Patient vor der Wahl der Behandlungsmethode. In der modernen Gesellschaft wird der Lebensqualität der Patienten nach Behandlungsbeginn große Bedeutung beigemessen. Die Lebensqualität ohne Behandlung entspricht dem Verlauf der Grunderkrankung und hängt vom Fortschreiten des onkologischen Prozesses ab. Veränderungen der Lebensqualität treten vor allem nach Behandlungsbeginn und Anwendung einer der therapeutischen oder chirurgischen Methoden auf. Die klare Bestimmung des Prozessstadiums ermöglicht nicht nur die Wahl der optimalen Behandlungsmethode, sondern auch die Vorhersage des weiteren Krankheitsverlaufs.
Die Bestimmung des PSA-Wertes in Kombination mit dem klinischen Bild des Prostatakrebses und der Graduierung des Tumors nach der Gleason-Skala erhöht den Informationsgehalt jedes der aufgeführten Indikatoren bei der Feststellung des pathologischen Krebsstadiums erheblich. AV Partin et al. (1997) schlugen Prognosetabellen vor, die es ermöglichen, die weitere Ausbreitung des Tumors, die Wahl der Behandlungsmethode, den Grad der Radikalität und die Prognose der Wirksamkeit der Behandlung vorherzusagen
Zur Beurteilung der Tumorausbreitung werden am häufigsten DRE, TRUS, PSA-Bestimmung und Knochenszintigraphie eingesetzt. Bei Bedarf werden Computertomographie (CT) oder Magnetresonanztomographie (MRT) sowie eine Röntgenaufnahme des Brustkorbs verordnet.
Jedes bildgebende Verfahren dient der Bestimmung des Stadiums und der Beurteilung der Behandlungswirksamkeit. Nach der Diagnose muss der Urologe das Volumen des Primärtumors, seine Grenzen sowie sein invasives oder metastasierendes Potenzial abklären. All diese Indikatoren sind für die Prognose der Erkrankung und die Wahl der Behandlungsmethode von großer Bedeutung.
Primärtumor (T)
Zunächst muss festgestellt werden, ob der Tumor auf die Prostata beschränkt ist (T1-2 ) oder über die Kapsel hinausreicht (T3-4 ). Die digitale Untersuchung erlaubt oft keine Beurteilung der Tumorausbreitung. Einigen Daten zufolge entsprechen die Ergebnisse der DRE bei weniger als 50 % der Patienten denen der histologischen Untersuchung. Eine detailliertere Untersuchung ist jedoch nur bei der Entscheidung über eine radikale Behandlung angezeigt.
Der PSA-Wert kann zwar das Ausmaß des Tumors widerspiegeln, erlaubt aber keine genaue Bestimmung des morphologischen Stadiums. Die Kombination aus PSA-Wert, Gleason-Index und Palpationsdaten ermöglicht eine bessere Vorhersage des morphologischen Stadiums als jeder dieser Parameter einzeln. Der Wert des freien PSA ist umstritten: In einer Studie half die Bestimmung des freien PSA-Gehalts, das Stadium bei lokalisierten Tumoren zu bestimmen, andere Studien bestätigten dies jedoch nicht. Nur eingehende Studien werden zur Lösung dieser Frage beitragen.
Transrektaler Ultraschall wird am häufigsten verwendet, um den Zustand der Prostata zu untersuchen. Mit dieser Methode können nur 60 % der Tumoren erkannt werden, und eine Kapselinvasion ist nicht immer erkennbar. Bei fast 60 % der Patienten im Stadium T3 tritt eine Kapselinvasion auf . Ultraschall weist auf einen weniger häufigen Prozess hin. Ultraschallzeichen einer Kapselinvasion sind Ausbuchtung, Unebenheit und Ruptur der Drüsenkontur. Eine Invasion der Samenbläschen durch Tumorzellen ist ein schlechtes prognostisches Zeichen, aber Informationen darüber sind für die Wahl einer Behandlungsmethode äußerst wichtig. Bei der Durchführung von TRUS sollte auf die Echostruktur der Bläschen (Hyperechogenität), ihre Asymmetrie, Deformation und Ausdehnung geachtet werden. Außerdem weisen ein Verlust der Rundheit und eine Verdichtung an der Drüsenbasis auf eine Schädigung der Samenbläschen hin. Diese Anzeichen sind sehr subjektiv, deshalb ist es nicht angebracht, sich ausschließlich auf Ultraschalldaten zu verlassen. Eine Invasion der Samenbläschen weist auf ein hohes Risiko für lokale Rückfälle und Metastasen hin, und ihre Biopsie ist zur Abklärung (vor einer Operation) angezeigt. Die Untersuchung sollte nicht mit diesem Verfahren begonnen werden, aber wenn das Invasionsrisiko hoch ist und die Wahl der Behandlung vom Biopsieergebnis abhängt, ist ihre Durchführung gerechtfertigt. Ein negatives Ergebnis schließt eine mikroskopische Invasion nicht aus. In der Regel wird eine Biopsie der Samenbläschen im klinischen Stadium T 2b und höher durchgeführt und der PSA-Gehalt beträgt mehr als 10 ng/ml. Das Ergebnis gilt als positiv, wenn mindestens eine Biopsie von der Basis der Prostata Tumorzellen enthält. Nicht nur zusätzliche Untersuchungen, sondern auch eine gründliche Analyse der Ergebnisse der primären Biopsie ermöglichen es, die Genauigkeit der klinischen Bestimmung des Stadiums zu erhöhen (Anzahl und Ausmaß der Tumorherde, Kapselinvasion spielen eine Rolle). Auch der Differenzierungsgrad ist wichtig: Bei einem Gleason-Index von weniger als 6 ist der Tumor in 70 % der Fälle lokalisiert.
Der Blutfluss in der Prostata ist bei Krebs höher als in einer normalen Drüse oder bei Hyperplasie. Nach der Kastration nimmt die Intensität des Blutflusses in der Drüse ab. Die Entwicklung von Echo-Doppler-Karten zur Diagnose und Überwachung von Prostatakrebs ist vielversprechend, derzeit gibt es jedoch keine zuverlässigen Daten zum Einsatz der Echo-Doppler-Bildgebung zur Bestimmung des Stadiums des lokalen Prozesses. Mit dieser Methode kann bei gezielter Biopsie aus Herden pathologischer Vaskularisation zusätzliches Material gewonnen werden.
Die Ergebnisse der Prostatakrebsvisualisierung hängen direkt von der technischen Ausstattung der Klinik und der Erfahrung des Spezialisten ab. Deshalb spielen alle modernen Visualisierungsmethoden keine entscheidende, sondern eine klärende Rolle, und die Wahl der Behandlungsmethode basiert auf einer Kombination aus klinischen Untersuchungsdaten und instrumentellen Studien.
Die MRT bietet die besten Möglichkeiten, die Struktur der Prostata darzustellen. Der moderne Standard zur Untersuchung der Beckenorgane mittels MRT ist die Verwendung eines endorektalen Sensors, der Bilder mit der höchstmöglichen räumlichen Auflösung von 0,5–1 mm liefert. Durch Einblasen von Luft in den endorektalen Sensor werden die Prostatakapsel, die rektoprostatischen Winkel und die Denonvilliers-Faszie klar visualisiert. Die Verwendung eines endorektalen Sensors im MRT schränkt die Visualisierung regionaler Lymphknoten (bis zur Bifurkation der Bauchaorta) nicht ein. Prostatakrebs ist durch eine geringe Signalintensität auf T-gewichteten Bildern vor dem Hintergrund eines hochintensiven Signals aus einem unveränderten peripheren Bereich der Drüse gekennzeichnet. Unregelmäßige Form, diffuse Ausbreitung mit Masseneffekt sowie unscharfe und ungleichmäßige Konturen sind morphologische Merkmale von Herden geringer Signalintensität im peripheren Bereich der Prostata und weisen auf eine neoplastische Natur der Läsion hin. Bei der dynamischen Kontrastierung reichern Krebsherde das Kontrastmittel in der arteriellen Phase schnell an und entfernen es schnell, was den Grad der Angiogenese und dementsprechend den Grad der Tumormalignität widerspiegelt. Eine geringe Signalintensität ist auch charakteristisch für Herde von postbioptischen Blutungen, Prostatitis, stromaler benigner Hyperplasie der neutralen Zone der Drüse, fibronarbigen Veränderungen, fibromuskulärer Hyperplasie sowie den Folgen einer Hormon- oder Strahlentherapie. Die MRT ohne dynamische Kontrastierung ermöglicht keine zuverlässige Differenzierung der meisten der aufgeführten Veränderungen und Erkrankungen.
Wie oben erwähnt, besteht eine der Hauptaufgaben jeder bildgebenden Methode zur Untersuchung von Prostatakrebs darin, das Volumen der Drüsenläsion und die Ausbreitung des Tumors über die Kapsel hinaus zu bestimmen. Die Bestimmung des Tumorvolumens ist wichtig für die Prognose. Ein Tumorvolumen von weniger als 4 cm 3 weist auf Fernmetastasen hin, und 12 cm 3 weisen auf eine extrem hohe Wahrscheinlichkeit von Metastasen hin. Untersuchungen zufolge liegt die Genauigkeit der MRT bei der Erkennung von Herden neoplastischer Läsionen der Prostata zwischen 50 und 90 %. Die Sensitivität der MRT bei der Bestimmung der Lokalisation von Prostatakrebs beträgt etwa 70-80 %, während mikroskopische Krebsherde (Foci) mittels MRT nicht erkannt werden können.
Der wichtigste Vorteil der endorektalen MRT ist die Möglichkeit, neoplastische Läsionen in Bereichen zu lokalisieren, die für andere diagnostische Methoden unzugänglich sind, und die Art und Richtung des Tumorwachstums zu klären. Beispielsweise ermöglicht die MRT die Erkennung neoplastischer Läsionen in den vorderen Teilen der peripheren Zone der Prostata, die mit einer transrektalen Biopsie nicht zugänglich sind. Generell ergänzt die MRT die Daten von DRE und TRUS zur Tumorlokalisierung erheblich.
Die endorektale MRT ermöglicht die Visualisierung der Drüsenkapsel, der Gefäß-Nerven-Bündel, der Samenbläschen, der Drüsenspitze und des periprostatischen Venenplexus sowie die Bestimmung der lokalen Prävalenz von Drüsentumoren. Es ist hervorzuheben, dass eine Kapselpenetration als mikroskopisches Zeichen gilt und selbst moderne MRT-Geräte (endorektale Spule) solche Informationen nicht liefern können. Es können lediglich Daten zum Wachstum über die Drüsenkapsel hinaus gewonnen werden.
Diagnostische Kriterien für eine extrakapsuläre Ausdehnung mittels MRT:
- das Vorhandensein eines extrakapsulären Tumors;
- ungleichmäßige Kontur der Drüse (Verformung, Winkligkeit);
- Asymmetrie der neurovaskulären Bündel;
- Obliteration der Rektoprostatawinkel;
- breiter Kontakt des Tumors mit der Kapsel.
Die höchste Spezifität (bis zu 95–98 %) und Genauigkeit der MRT-Ergebnisse werden bei der Untersuchung von Patienten mit mittlerem oder hohem Risiko einer extrakapsulären Invasion erreicht. Man geht davon aus, dass eine extrakapsuläre Invasion (laut MRT-Daten) auf die Unangemessenheit einer chirurgischen Behandlung und eine ungünstige Prognose der Erkrankung hinweist. Hormon- oder Strahlentherapie beeinträchtigen die Genauigkeit der Erkennung einer extrakapsulären Ausbreitung eines Prostatatumors nicht. Die Hauptschwierigkeit bei der Erkennung von Krebsherden und einer extrakapsulären Tumorausbreitung ist die hohe Variabilität der Tomogramminterpretation durch verschiedene Spezialisten. Die Hauptaufgabe eines Spezialisten für Strahlendiagnostik besteht darin, eine hohe diagnostische Spezifität (auch auf Kosten der Sensitivität) zu erreichen, um operablen Patienten die Chance auf eine radikale Behandlung nicht zu nehmen.
Aufgrund der ähnlichen Dichte von krebsartigem, hyperplastischem und normalem Prostatagewebe in der CT ist diese Methode zur Beurteilung der lokalen Tumorausbreitung wenig geeignet. Die Invasion in die Samenbläschen ist wichtiger als die Invasion in die Kapseln, aber selbst in diesem Fall liefert die CT nur in fortgeschrittenen Fällen Informationen. Diese Methode wird jedoch häufig eingesetzt, um den betroffenen Bereich vor der Strahlentherapie zu markieren.
Die langsame Entwicklung der Strahlendiagnostik in unserem Land hat zu einer späten Diagnose von Prostatakrebs und folglich zu einer unzureichenden Verbreitung radikaler Behandlungsmethoden (z. B. Prostatektomie), einer geringen Verfügbarkeit moderner Tomographen und dem Fehlen geeigneter Ausbildungsprogramme für Strahlendiagnostiker und Urologen geführt. Trotz der mittlerweile weit verbreiteten CT- und MRT-Techniken reichen die Ausstattung der Praxen und die Ausbildung der Strahlendiagnostiker nicht aus, um die gewonnenen Informationen für die Wahl der Behandlungsmethode für Patienten mit Prostatakrebs ausschlaggebend zu machen.
Regionale Lymphknoten (N)
Regionale Lymphknoten sollten nur dann untersucht werden, wenn dies die Behandlungsstrategie direkt beeinflusst (in der Regel bei der Planung einer radikalen Therapie). Hohe PSA-Werte, T2c -T3a- Tumoren, schlechte Differenzierung und perineurale Invasion bergen ein hohes Risiko für Lymphknotenmetastasen. Die Beurteilung des Lymphknotenstatus anhand des PSA-Wertes gilt als unzureichend.
Nur eine Lymphadenektomie (offen oder laparoskopisch) liefert die notwendigen Informationen. Jüngste Studien zur erweiterten Lymphadenektomie haben gezeigt, dass Prostatakrebs nicht immer die obturatorischen Lymphknoten befällt. Bei asymptomatischen Tumoren und einem PSA-Wert von weniger als 20 kg/ml bestätigt die CT vergrößerte Lymphknoten nur in 1 % der Fälle. Der Einsatz von MRT oder CT ist bei hohem Metastasierungsrisiko gerechtfertigt, da die Spezifität dieser Methoden 93-96 % erreicht. Allerdings kann selbst ein positives Ergebnis bei dieser Anwendung falsch sein, und nur die Punktion eines verdächtigen Lymphknotens erlaubt es, von einer Lymphadenektomie abzuraten. Retrospektiven Analysen zufolge weist die Größe des Lymphknotens nicht immer auf das Vorhandensein von Metastasen hin; eine Asymmetrie der betroffenen Lymphknoten gilt als aussagekräftigeres Zeichen. Derzeit werden nur bei 2-3 % der Patienten, die sich einer radikalen Prostatektomie wegen lokalisiertem Prostatakrebs unterzogen haben, anhand der postoperativen histologischen Untersuchung Metastasen in den Lymphknoten diagnostiziert.
Als Methoden zum Nachweis von Lymphknotenmetastasen werden die Positronen-Emissions-Tomographie (PET) und die Szintigraphie mit markierten Antikörpern empfohlen, ihr Einsatz ist jedoch aufgrund unzureichender Sensitivität noch begrenzt.
Mit den Nomogrammen von Partin (2001) lässt sich das Risiko eines regionalen Lymphknotenbefalls beurteilen. Nomogramme sind mathematische Algorithmen, die für einen bestimmten Patienten oder eine Patientengruppe verwendet werden. Anhand dieser Tabellen lässt sich die Wahrscheinlichkeit einer lokalen Tumorausbreitung (auf die Kapsel, Samenbläschen) und eines Lymphknotenbefalls anhand des klinischen Stadiums, des PSA-Werts und des Gleason-Index bestimmen. Insbesondere ermöglichen sie die Identifizierung einer Patientengruppe mit einer geringen (weniger als 10 %) Wahrscheinlichkeit einer Lymphknotenmetastasierung (mit einem PSA-Wert über 20 ng/md, Stadium T 1-2a und einem Gleason-Index von 2-6); in dieser Gruppe kann der Zustand der Lymphknoten vor einer radikalen Behandlung möglicherweise nicht spezifiziert werden. Das Risiko einer Lymphknotenmetastasierung kann auch durch den Nachweis von Tumorbereichen mit ausgeprägter Anaplasie (4-5 Punkte) beurteilt werden: Werden solche Bereiche in vier oder mehr Biopsien gefunden oder überwiegen sie in mindestens einer Biopsie, beträgt das Risiko 20-45 %. Bei anderen Patienten liegt der Wert bei nicht mehr als 2,5 %. In diesen Fällen ist keine zusätzliche Untersuchung erforderlich.
Fernmetastasen (M)
Bei 85 % der Patienten, die an Prostatakrebs sterben, werden Läsionen des Achsenskeletts festgestellt. Knochenmetastasen entstehen durch das Eindringen von Krebszellen in das Knochenmark mit dem Blutkreislauf, was zu Tumorwachstum und Lyse von Knochenstrukturen führt. Das Vorkommen von Knochenmetastasen beeinflusst die Prognose, und ihre Früherkennung warnt den Arzt vor möglichen Komplikationen. In 70 % der Fälle geht die Metastasierung mit einer erhöhten Aktivität des Knochenisoenzyms der alkalischen Phosphatase (ALP) einher. Die Bestimmung der ALP-Aktivität und des PSA-Wertes ermöglicht in den meisten Fällen den Nachweis von Knochenmetastasen. Laut multivarianter Analyse werden diese Indikatoren nur durch die Anzahl der Knochenmetastasen beeinflusst. Es ist wichtig, dass die Aktivität des Knochenisoenzyms ALP den Grad der Knochenschädigung genauer widerspiegelt als der PSA-Wert.
Die Szintigraphie gilt als die empfindlichste Methode zum Nachweis von Knochenmetastasen (sie ist der Röntgenaufnahme und der Bestimmung der alkalischen und sauren Phosphataseaktivität überlegen). Technetiumdiphosphonate eignen sich besser als Radiopharmaka, da sie sich in Knochen deutlich aktiver anreichern als in Weichteilen. Es wurde ein Zusammenhang zwischen der semiquantitativen Beurteilung von Knochenschäden und dem Überleben nachgewiesen. Fernmetastasen können in jedem Organ nachgewiesen werden. Am häufigsten treten sie in nichtregionalen Lymphknoten, Lunge, Leber, Gehirn und Haut auf. Bei entsprechenden Beschwerden und Symptomen werden Röntgenaufnahmen des Brustkorbs, Ultraschall, CT und MRT zum Nachweis eingesetzt. Die Vorgehensweise bei Verdacht auf Knochenmetastasen ist im Diagramm dargestellt.
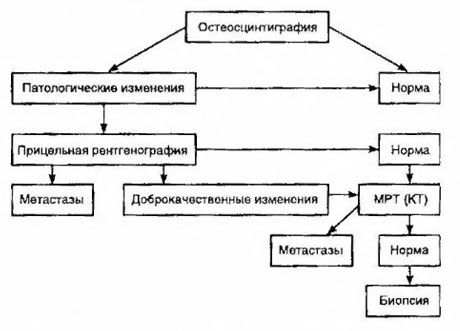
Der zuverlässigste Laborindikator zur Bestimmung des Metastasierungsgrades ist der PSA-Wert. Es hat sich gezeigt, dass ein Anstieg über 100 ng/ml der einzige Parameter ist, der zuverlässig Fernmetastasen anzeigt. Die Bestimmung des PSA-Wertes reduziert die Anzahl der Patienten, die eine Knochenszintigraphie benötigen. Die Wahrscheinlichkeit, Knochenmetastasen bei einem Abfall des PSA-Wertes zu entdecken, ist sehr gering. Bei fehlenden Beschwerden und einem initialen PSA-Wert von weniger als 20 ng/ml sowie der Erkennung hoch- und mitteldifferenzierter Tumoren kann auf eine Szintigraphie verzichtet werden. Gleichzeitig ist bei schlecht differenzierten Tumoren und Kapselinvasion eine Szintigraphie indiziert (unabhängig vom PSA-Wert).


 [
[