Neue Veröffentlichungen
Die Funktion des Knochenmarks ist abhängig vom Herz-Kreislauf-System
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
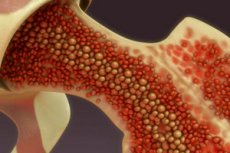
Bei Menschen mit Bluthochdruck, Arteriosklerose und auch in der Zeit nach einem Infarkt wird die Produktion von Immunzellen im Knochenmark aktiviert.
Immunozyten werden von Stammblutzellen gebildet, die im Knochenmark leben. Knochenmarkstrukturen reagieren auf absolut alle Impulse, die von verschiedenen Geweben und Organen an das Immunsystem gesendet werden. In diesem Fall besetzen hämatopoetische Zellen spezielle Orte (Zellen), die über eine eigene Mikroumgebung verfügen. Die Strukturen, die sie unterstützen, beeinflussen auch die Prozesse der Stammzellteilung, aber die Aktivität dieser Strukturen selbst wird durch molekulare Impulse reguliert, die ins Knochenmark gelangen. Auch das Nervensystem, der Zustand der Darmflora und die Funktionalität der Bauchspeicheldrüse spielen eine Rolle – insbesondere bei Diabetes mellitus verändern normale Immunozyten die Geschwindigkeit des Austritts aus ihren Knochenmarkzellen und die Intensität des Eintritts in den Blutkreislauf.
Wissenschaftler des Massachusetts General Hospital haben herausgefunden, dass bei Patienten mit Bluthochdruck, Arteriosklerose undHerzinfarktüberlebenden eine beschleunigte Hämatopoese – die Bildung neuer Blutzellen, insbesondere myeloider Immunzellen – auftritt. Die höchsten Konzentrationen finden sich bei Leukozyten und Neutrophilen: Sie treffen als erste auf einen Infektionserreger und lösen eine Entzündungsreaktion aus.
Wissenschaftler führten Experimente mit Nagetieren durch, die anfällig für die oben genannten Erkrankungen waren: Das Knochenmark dieser Tiere begann tatsächlich, mehr myeloide Immunozyten zu produzieren. Darüber hinaus wurden Veränderungen in den Blutgefäßen beobachtet, die das Knochenmark versorgen. Die Anzahl der Gefäße nahm zu, die Gefäßwände verdickten sich und ihre Durchlässigkeit nahm zu. Aufgrund der erhöhten Durchlässigkeit gelangten mehr Immunzellen, die sich zuvor in den Knochenmarkszellen befanden, ins Blut. Infolgedessen wurde die Teilung der Stammzellen aktiviert und neue reife Immunozyten entstanden.
Experten haben den gesamten Mechanismus des Prozesses entschlüsselt. Nach einem Infarkt ist das Blut mit dem vaskulären endothelialen Wachstumsfaktor A gesättigt, einer Proteinsubstanz, die das Gefäßwachstum stimuliert und über einen spezifischen Rezeptor verfügt, der Zellen beeinflusst. Die Blockade dieses Rezeptors führt nach einem Infarkt zu einer Hemmung der Blutgefäße im Knochenmark. Darüber hinaus steigt vor dem Hintergrund atherosklerotischer und postinfarktbedingter Veränderungen im Blutkreislauf der Gehalt des signalisierenden Immunproteins Interleukin-6 und von Versican, einem Proteoglykan, das die Hämatopoese stimuliert. Wissenschaftler erforschen heute die Ursprünge dieser molekularen Faktoren, die die Knochenmarkstrukturen bei Herz-Kreislauf-Erkrankungen beeinflussen.
Die Zeit wird zeigen, wie nützlich diese Beobachtungen und Entdeckungen sein werden. Vielleicht werden Medikamente entwickelt, die den Zusammenhang zwischen Herz-Kreislauf-Erkrankungen und der Knochenmarkfunktion blockieren.
Informationen finden Sie auf den Seiten der NCR-Publikation
