Neue Veröffentlichungen
Neuer biologischer Mechanismus zur Behandlung von Brustkrebsmetastasen im Gehirn entdeckt
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
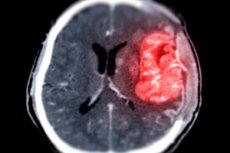
Forscher am University of Arizona Health Sciences Cancer Center haben einen biologischen Mechanismus entdeckt, der zu wirksameren Behandlungen von Brustkrebs führen könnte, der ins Gehirn metastasiert ist.
Durch die Untersuchung metabolischer Unterschiede zwischen primären Brustkrebszellen und Zellen, die ins Gehirn metastasieren, stellten die Wissenschaftler fest, dass die Autophagie bei Hirnmetastasen signifikant aktiviert war. Autophagie ist ein zellulärer Recyclingprozess, den Krebszellen nutzen, um Stressbedingungen, wie sie beispielsweise durch Krebsmedikamente verursacht werden, zu überleben.
„Die Prognose für Patienten mit Hirnmetastasen aufgrund von Brustkrebs ist äußerst schlecht und die Behandlung dieser Metastasen bleibt eine Herausforderung. Wir konnten die Fähigkeit der Krebszellen, Hirnmetastasen zu bilden, durch die Unterbrechung des Autophagie-Signalwegs unterbrechen“, sagte Dr. Jennifer Carew, Hauptautorin der Studie.
In einer in der Fachzeitschrift Clinical and Translational Medicine veröffentlichten Studie zeigten die Forscher, dass die gezielte Aktivierung eines wichtigen Autophagie-regulierenden Gens, ATG7, die Fähigkeit von Brustkrebszellen, Hirnmetastasen zu bilden, in Mausmodellen signifikant reduzierte.
Die Forscher untersuchten, ob das von der FDA zugelassene Medikament Hydroxychloroquin zur Behandlung von Hirnmetastasen bei Brustkrebs eingesetzt werden kann. Hydroxychloroquin hemmt die Autophagie in einem späteren Stadium und überwindet, was besonders wichtig ist, problemlos die Blut-Hirn-Schranke.
Das Team kombinierte Hydroxychloroquin mit Lapatinib, das ebenfalls von der FDA für Brustkrebs zugelassen ist. Die Kombination reduzierte nachweislich die Anzahl und Größe von Brustkrebs-Hirnmetastasen in Mausmodellen erfolgreich. Dies ist das erste Mal, dass Forscher die Wirksamkeit von Hydroxychloroquin in Kombination mit Lapatinib in der Brustkrebstherapie untersuchten.
„Unser Team war erstaunt, wie deutlich wir die Fähigkeit von Krebszellen, Hirnmetastasen zu bilden, reduzieren konnten, indem wir nur einen einzigen Signalweg anvisierten“, sagte Dr. Carew. „Krebszellen haben leider viele Wege entwickelt, die es schwierig machen, ihr Wachstum zu stoppen oder sie abzutöten. Es ist immer wieder überraschend zu sehen, wie sehr die Veränderung nur eines einzigen Aspekts einen Unterschied machen kann.“
Dr. Steffan Nawrocki, Erstautor der Studie, sagte: „Da Hydroxychloroquin und Lapatinib bereits von der FDA zugelassen sind, können wir schnell mit klinischen Studien dieser Kombination bei Patienten mit Hirnmetastasen aufgrund von Brustkrebs fortfahren.“
Hirnmetastasen sind die häufigsten Tumoren des zentralen Nervensystems bei Erwachsenen. 20–30 % der Fälle treten bei Patientinnen mit Brustkrebs auf, insbesondere bei Patientinnen mit dreifach negativem Brustkrebs oder HER2-Amplifikation. Die Behandlung von Hirnmetastasen bei Brustkrebs ist eine Herausforderung: Nur 20 % der Patientinnen mit Hirnmetastasen überleben länger als fünf Jahre.
Diese Studie eröffnet neue Horizonte in der Behandlung von metastasiertem Brustkrebs und könnte die Prognose für Patienten mit dieser schweren Krankheit erheblich verbessern.
