Neue Veröffentlichungen
Wissenschaftler haben einen "Chamäleon"-Wirkstoff zur Behandlung von arzneimittelresistenten Hirntumoren entwickelt
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Eine neue Studie von Wissenschaftlern der Yale University beschreibt, wie eine neue chemische Verbindung medikamentenresistente Hirntumore angreift, ohne das gesunde umliegende Gewebe zu schädigen.
Die im Journal of the American Chemical Society veröffentlichte Studie ist ein wichtiger Schritt in der Entwicklung sogenannter „Chamäleonverbindungen“, die zur Bekämpfung einer Reihe gefährlicher Krebsarten eingesetzt werden könnten.
Etwa 6,6 von 100.000 Menschen erkranken jährlich an Gliomen, bis zum Alter von 14 Jahren sind es 2,94 von 100.000. Abgesehen von Metastasen anderer Krebsarten, die das zentrale Nervensystem erreichen, machen Gliome 26 % aller Hirntumore (primäre Hirntumore) und 81 % aller bösartigen Hirntumore aus.
Patienten mit Glioblastom werden seit Jahrzehnten mit dem Medikament Temozolomid behandelt. Die meisten Patienten entwickeln jedoch innerhalb eines Jahres eine Resistenz gegen Temozolomid. Die Fünfjahresüberlebensrate bei Patienten mit Glioblastom liegt unter 5 %.
Im Jahr 2022 entwickelten der Yale-Chemiker Seth Herzon und der Strahlenonkologe Dr. Ranjit Bindra eine neue Strategie zur effektiveren Behandlung von Glioblastomen. Sie schufen eine Klasse von Anti-Krebs-Molekülen, sogenannte Chamäleon-Verbindungen, die einen Defekt im DNA-Reparaturprotein O6-Methylguanin-DNA-Methyltransferase (MGMT) ausnutzen.
Vielen Krebszellen, darunter auch Glioblastomen, fehlt das MGMT-Protein. Neue Chamäleon-Verbindungen sollen die DNA in Tumorzellen ohne MGMT schädigen.
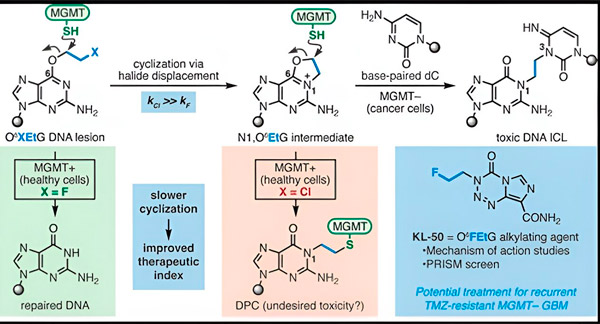
Chamäleonverbindungen verursachen DNA-Schäden, indem sie primäre Läsionen auf der DNA hinterlassen, die sich im Laufe der Zeit zu hochgiftigen sekundären Läsionen, sogenannten Interstrang-Quervernetzungen, entwickeln. MGMT schützt die DNA gesunden Gewebes, indem es primäre Läsionen repariert, bevor sie sich zu tödlichen Interstrang-Quervernetzungen entwickeln können.
Für ihre neue Studie konzentrierten sich die Co-Autoren Herzon und Bindra auf ihr Leitchamäleon, KL-50.
„Wir haben synthetische Chemie und molekularbiologische Studien kombiniert, um die molekularen Grundlagen unserer bisherigen Beobachtungen sowie die chemische Kinetik zu untersuchen, die die einzigartige Selektivität dieser Verbindungen ermöglicht“, sagte Herzon, Milton Harris Professor für Chemie in Yale. „Wir zeigen, dass KL-50 einzigartig ist, da es DNA-Quervernetzungen nur in Tumoren mit defekter DNA-Reparatur bildet. Gesundes Gewebe wird dadurch verschont.“
Quelle: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Das sei ein signifikanter Unterschied, betonen die Forscher. Eine Reihe anderer Krebsmedikamente wurde entwickelt, um Quervernetzungen zwischen den Strängen auszulösen. Sie sind jedoch nicht selektiv für Tumorzellen, was ihre Nützlichkeit einschränkt.
Das Erfolgsgeheimnis von KL-50 liege im Timing, stellten die Forscher fest. KL-50 bildet Interstrang-Quervernetzungen langsamer als andere Vernetzer. Diese Verzögerung gibt gesunden Zellen genügend Zeit, MGMT zu nutzen, um die Bildung von Quervernetzungen zu verhindern.
„Dieses einzigartige Profil deutet auf sein Potenzial für die Behandlung von medikamentenresistenten Glioblastomen hin, einem Bereich mit großem ungedecktem klinischem Bedarf“, sagte Bindra, Harvey- und Kate-Cushing-Professorin für Therapeutische Radiologie an der Yale School of Medicine. Bindra ist zudem wissenschaftliche Leiterin des Chenevert Family Brain Tumor Center am Smilo Hospital.
Herzon und Bindra betonten, ihre Studie unterstreiche die Bedeutung der Berücksichtigung der Raten chemischer DNA-Modifikation und biochemischer DNA-Reparatur. Sie glauben, diese Strategie nutzen zu können, um Behandlungen für andere Krebsarten zu entwickeln, die spezifische tumorassoziierte DNA-Reparaturdefekte aufweisen.
