Neue Veröffentlichungen
Neue Studie bringt hohe Triglyceridwerte mit der Entstehung und Ruptur von Aortenaneurysmen in Verbindung
Zuletzt überprüft: 18.08.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
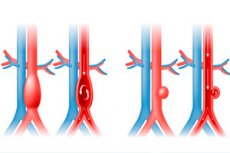
Ein in Circulation veröffentlichter Artikel kombiniert Humangenetik und experimentelle Modelle und gelangt zu einem einfachen Schluss: Hypertriglyceridämie ist nicht nur ein „Begleiter“ von Herz-Kreislauf-Erkrankungen, sondern eine Hauptursache für Bauchaortenaneurysmen (BAA). In Mausmodellen führten sehr hohe Triglyceridwerte zu beschleunigtem Aneurysmawachstum, Dissektion und sogar Ruptur, während niedrigere Triglyceridwerte (ASO zu ANGPTL3) das Fortschreiten verlangsamten. Der Mechanismus besteht darin, dass Fettsäuren (Palmitat) die Reifung der Lysyloxidase (LOX) „unterbrechen“, eines Enzyms, das Elastin und Kollagen in der Aortenwand „vernetzt“. Ohne normale LOX wird das Gewebe locker und anfällig. Beim Menschen bestätigte die Mendelsche Randomisierung einen kausalen Zusammenhang zwischen TG-reichen Lipoproteinen und dem AAA-Risiko.
Hintergrund der Studie
Warum das AAA ein ungelöstes klinisches Problem ist
Das Bauchaortenaneurysma (AAA) ist eine „stumme“ Erkrankung mit hoher Sterblichkeit bei Ruptur; wirksame Medikamente, die das Wachstum zuverlässig verlangsamen, gibt es nicht. Die Strategie besteht heute in Ultraschalluntersuchungen bei Risikogruppen und einer Operation, wenn der Schwellenwert für den Durchmesser erreicht ist. Empfehlungen der USPSTF: einmalige Untersuchung bei Männern im Alter von 65–75 Jahren, die jemals geraucht haben; bei Frauen ohne Risikofaktoren – nicht empfohlen.
Was wurde zuvor versucht und warum hat es nicht funktioniert?
Eine Reihe von „Antidegradations“-Ansätzen (z. B. Doxycyclin als Matrix-Metalloproteinase-Inhibitor) konnten das Wachstum kleiner AAAs in randomisierten kontrollierten Studien nicht verlangsamen und dämpften damit die Hoffnungen auf eine einfache entzündungshemmende/Antimatrix-Therapie.
Die Rolle von Lipiden: Der Fokus verlagert sich auf TG-reiche Partikel.
Während LDL-C der Schlüsselfaktor für die koronare Herzkrankheit bleibt, deuten bei AAA immer mehr Daten auf triglyceridreiche Lipoproteine (TRL, Remnants) hin. Moderne Übersichtsarbeiten und genetische Studien (einschließlich Mendelscher Randomisierung) stützen einen kausalen Zusammenhang zwischen erhöhten TG/TRL-Werten und dem AAA-Risiko. Ein neuer Artikel in Circulation (2025) kombinierte MR-Analysen und Experimente und kam zum gleichen Ergebnis.
Gefäßwandmechanik: Wo es „subtil“ zugeht
Die Festigkeit der Aorta wird durch die „Quervernetzung“ von Kollagen und Elastin bestimmt, für die die Lysyloxidase (LOX) verantwortlich ist. Die LOX-Familie stabilisiert die extrazelluläre Matrix; bei einem Mangel/einer Hemmung wird die Aorta locker und dehnt sich aus – was sowohl durch Studien als auch durch experimentelle Modelle bestätigt wird.
Warum ANGPTL3 ein attraktives Ziel ist:
ANGPTL3 hemmt die Lipoproteinlipase; seine Hemmung reduziert TG (und teilweise auch andere Lipide) drastisch. Es gibt bereits ein zugelassenes Anti-ANGPTL3-Medikament (Evinacumab), und RNA-Ansätze werden entwickelt – das heißt, die „Werkzeuge“ für die klinische Prüfung der Hypothese „TG senken → AAA hemmen“ sind vorhanden.
Kontextzusammenfassung:
Das Fachgebiet verlagert sich von „universellen“ entzündungshemmenden Ideen hin zur Lipid-Matrix-Achse: TRL/TG → Störung der Matrixreifung und „Vernetzung“ (auch über LOX) → Schwächung der Aortenwand → Wachstum/Ruptur eines AAA. Vor diesem Hintergrund prüft die Arbeit in Circulation logischerweise die Kausalität mit der Genetik und zeigt in Modellen, dass eine TG-Korrektur das Fortschreiten verlangsamen kann – dies ist die Brücke zwischen Epidemiologie und Mechanismus, die für die Einleitung klinischer Studien fehlte.
Was genau haben sie getan?
- Menschen (Genetik): Es wurde eine Mendelsche Randomisierung angewendet, bei der genomische, proteomische und metabolomische Daten kombiniert wurden – und ein kausales Signal erhalten wurde: Je höher die TG-reichen Lipoproteine und die mit dem TG-Stoffwechsel verbundenen Proteine/Metaboliten, desto höher das AAA-Risiko.
- Mechanismus (Zellen/Gewebe): Erhöhte TG- und Palmitatwerte stören die LOX-Reifung und reduzieren deren Aktivität → die Aortenwand verliert ihre „Querverbindungen“, dehnt sich aus und reißt leichter. Die lokale Überexpression von LOX in der Aorta beseitigte den „Schaden“ der Hypertriglyceridämie.
- Mäuse (AAA-Modelle):
- bei Lpl-Mangel (extreme Hypertriglyceridämie) starben die meisten Tiere im Angiotensin-II-Modell an einer Aortenruptur;
- Apoa5-/- (mäßig hohe TG) – beschleunigtes Wachstum von AAA;
- transgen für menschliches APOC3 (sehr hoher TG) – Delamination und Bruch.
- Therapeutischer Proof of Concept: Antisense-Oligonukleotid gegen ANGPTL3 reduzierte TG drastisch und hemmte die AAA-Progression bei transgenen APOC3-Mäusen und bei Apoe-/-.
Warum ist das wichtig?
Das Bauchaortenaneurysma ist eine stille und tödliche Erkrankung: Ein Riss führt oft zum Tod, und es gibt praktisch keine wirksamen Medikamente, um das Wachstum des AAA zu verlangsamen (Grundlage sind Beobachtung/Screening und Operation, wenn der Schwellenwert erreicht ist). Die neue Arbeit zeigt erstmals streng und multilinear (Genetik → Mechanismen → Modelle), dass TG-reiche Lipoproteine das Schlüsselglied in der Pathogenese sind und dass ihre gezielte Reduktion zu einer medikamentösen Strategie gegen AAA werden kann.
Details, auf die Sie achten sollten
- LOX als Schwachstelle der Aortenwand. Lysyloxidase vernetzt Elastin- und Kollagenfasern. Die Autoren zeigten, dass Palmitat die LOX-Reifung stört und eine direkte Brücke vom Fettstoffwechsel zur mechanischen Festigkeit der Aorta darstellt. Bei künstlicher Erhöhung des LOX-Spiegels an der Aneurysmastelle kehrte die antianeurysmatische Wirkung trotz hoher TG zurück.
- „Umgekehrte Beweise“: Die pharmakologische Reduktion von TG (ANGPTL3-ASO) hemmte AAA in zwei unabhängigen Modellen, was die klinische Plausibilität stärkt.
Was bedeutet das (möglicherweise) für die Klinik?
- Neues Ziel: TG-reiche Lipoproteine. Die Arbeiten der letzten Jahre haben den Fokus der AAA von „reinem LDL“ auf Entzündungen und Matrix-Remodellierung verlagert. Hier kommt eine harte TG-Verbindung hinzu, mit einem klaren Mechanismus über LOX. Dies eröffnet Raum für präventive/therapeutische Studien mit TG-senkenden Wirkstoffen – von der ANGPTL3-Hemmung bis hin zu anderen Wegen zur Korrektur des TG-Stoffwechsels.
- Biomarker und Risikostratifizierung: Wenn der Zusammenhang in prospektiven Kohorten bestätigt wird, können TG- und TG-reiche Partikelwerte in Risikobewertungsalgorithmen und die Auswahl für eine engere Überwachung bei Patienten mit kleinem/mittelschwerem AAA einbezogen werden.
Wichtige Haftungsausschlüsse
- Mäuse sind keine Menschen: Therapeutische Wirkung von ANGPTL3-ASO und LOX-Reparatur in präklinischen Modellen nachgewiesen; klinische Daten liegen noch nicht vor. RCTs sind erforderlich, um zu testen, ob eine TG-Reduktion das AAA-Wachstum beim Menschen verlangsamt.
- MR - über Kausalität, aber "im Durchschnitt". Die Mendelsche Randomisierung reduziert Störfaktoren, spricht jedoch von einem lebenslangen genetisch bedingten Anstieg der TG und nicht von kurzfristigen Schwankungen bei einem bestimmten Patienten. Die Umstellung auf eine medikamentöse Intervention erfordert einen unabhängigen Test.
Kontext: Warum diese Entdeckung Sinn macht
Das Bild ist: TG-reiche Lipoproteine → Fettsäuren (Palmitat) → LOX-Defekt → schwache Aortenwand → AAA-Wachstum/-Ruptur. Bisher wurde AAA mit Entzündungen, Matrixabbau und Funktionsstörungen der glatten Muskulatur in Verbindung gebracht; diese neue Arbeit rückt die Lipidkomponente in den Mittelpunkt dieser Prozesse – und bietet einen erprobten „Knopf“ für eine Intervention (Senkung der TG).
Quelle: Liu Y. et al. Circulation (Veröffentlichung vor dem Druck, 5. August 2025): „Hypertriglyceridämie als Hauptfaktor für die Entwicklung und Ruptur von Bauchaortenaneurysmen: Erkenntnisse aus genetischen und experimentellen Modellen.“ https://doi.org/10.1161/CIRCULATIONAHA.125.0747
