Neue Veröffentlichungen
Derivate von Thalidomid-Verbindungen führen zum Tod resistenter Krebszellen
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Eine Studie der Goethe-Universität Frankfurt weist darauf hin, dass Thalidomid-Derivate möglicherweise zur Behandlung von Krebs eingesetzt werden könnten. Thalidomid wurde in den 1950er Jahren als Schlafmittel verkauft. Später wurde es dafür berüchtigt, in der Frühschwangerschaft schwere Geburtsfehler zu verursachen.
Das Molekül ist auch dafür bekannt, Proteine in der Zelle zur Zerstörung zu markieren. Im Rahmen der aktuellen Studie stellten Wissenschaftler Derivate von Thalidomid her. Sie konnten zeigen, dass diese Substanzen die Zerstörung von Proteinen beeinflussen, die für das Überleben von Krebszellen verantwortlich sind.
Kaum ein anderes Molekül hat eine so turbulente Vergangenheit wie Thalidomid. Es war der Hauptbestandteil eines Medikaments, das in den 1950er Jahren in vielen Ländern als Beruhigungsmittel und Schlafmittel zugelassen wurde. Doch schon bald stellte sich heraus, dass schwangere Frauen, die Thalidomid einnahmen, häufig Babys mit schweren Missbildungen zur Welt brachten.
In den letzten Jahrzehnten setzte die Medizin jedoch erneut große Hoffnungen in ihn. Studien zeigten unter anderem, dass er das Wachstum von Blutgefäßen hemmt und sich daher möglicherweise dazu eignet, Tumoren ihren Nährboden zu entziehen. Auch bei der Behandlung des Multiplen Myeloms, bösartiger Tumoren im Knochenmark, erwies er sich als sehr wirksam.
„Wir wissen jetzt, dass man Thalidomid als ‚molekularen Klebstoff‘ bezeichnen kann“, erklärt Dr. Xinglai Cheng vom Institut für Pharmazeutische Chemie der Goethe-Universität Frankfurt. „Das bedeutet, dass es in der Lage ist, zwei Proteine zu greifen und miteinander zu verbinden.“
Dies ist besonders interessant, da eines dieser Proteine eine Art „Etikettiermaschine“ ist: Es bringt an einem anderen Protein ein eindeutiges „MÜLL“-Etikett an.
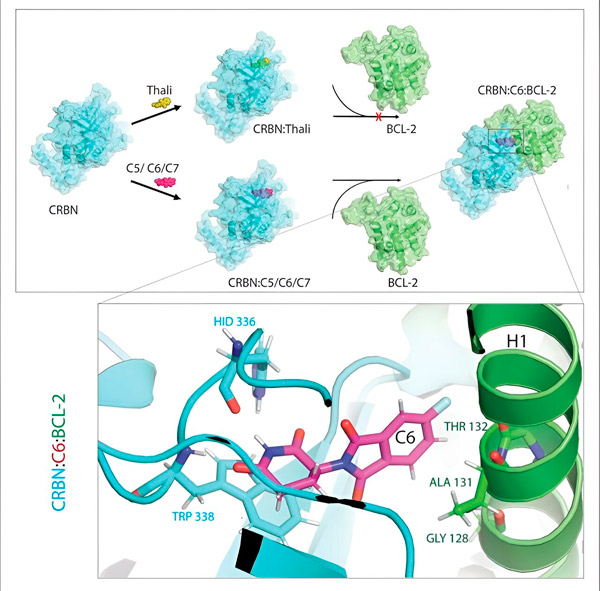
Die Thalidomid-Derivate C5, C6 und C7 verändern CRBN, die „Markierungsmaschine“, so dass es an BCL-2 binden kann. Dadurch wird das BCL-2-Molekül für den Abbau markiert – eine mögliche neue Strategie zur Krebsbekämpfung. Autor: Dr. Xinglai Cheng.
Das Abfallentsorgungssystem der Zelle erkennt diese Markierung: Es schnappt sich das markierte Proteinmolekül und zerkleinert es. „Dieser Mechanismus erklärt die unterschiedlichen Wirkungen von Thalidomid“, sagt Cheng. „Je nachdem, welches Protein markiert ist, kann es während der Embryonalentwicklung Missbildungen verursachen oder bösartige Zellen zerstören.“
Dieser Mechanismus eröffnet große Möglichkeiten für die Medizin, da Krebszellen zum Überleben auf bestimmte Proteine angewiesen sind. Könnte man sie gezielt angreifen und zerstören, ließe sich die Krankheit möglicherweise heilen. Das Problem ist jedoch, dass der molekulare Klebstoff recht eigenartig ist.
Einer seiner Bindungspartner ist stets die Markierungsmaschine der Zelle, wissenschaftlich gesprochen eine E3-Ligase namens CRBN. Nur wenige der vielen Tausend Proteine im Körper können der zweite Partner sein – welche, hängt vom Klebstoff ab.
„Wir haben also eine Reihe von Thalidomid-Derivaten hergestellt“, sagt Cheng. „Anschließend testeten wir, ob sie adhäsive Eigenschaften besitzen und, falls ja, gegen welche Proteine sie wirksam sind.“ Dazu gaben die Forscher ihre Derivate zu allen Proteinen der kultivierten Zelllinie. Anschließend beobachteten sie, welche dieser Proteine in Gegenwart von CRBN abgebaut wurden.
„Dabei haben wir drei Derivate identifiziert, die ein für den Zellabbau sehr wichtiges zelluläres Protein, BCL-2, markieren können“, erklärt Cheng. „BCL-2 verhindert, dass die Zellen ihr Selbstzerstörungsprogramm aktivieren. Fehlt es, sterben die Zellen.“
Deshalb steht BCL-2 schon lange im Fokus der Krebsforschung. Es gibt sogar ein Leukämiemedikament namens Venetoclax, das die Wirksamkeit von BCL-2 verringert und so die Selbstzerstörung mutierter Zellen auslöst.
„In vielen Krebszellen ist BCL-2 jedoch selbst mutiert. Venetoclax hemmt das Protein daher nicht mehr“, sagt Cheng. „Wir konnten zeigen, dass unsere Derivate auch diese mutierte Form für den Abbau markieren. Darüber hinaus simulierten unsere Partner am Max-Planck-Institut für Biophysik die Wechselwirkung von Thalidomid-Derivaten mit BCL-2 am Computer. Dabei zeigte sich, dass die Derivate an völlig anderen Stellen binden als Venetoclax – ein Ergebnis, das wir später experimentell bestätigen konnten.“
Die Forscher testeten ihre Verbindungen auch an Fruchtfliegen mit Krebszellen. Die Überlebensrate der so behandelten Fliegen war deutlich höher. Cheng warnt jedoch davor, sich zu große Hoffnungen zu machen, da es sich bei diesen Ergebnissen noch um Grundlagenforschung handelt. „Sie zeigen zwar, dass die modifizierten Thalidomid-Moleküle großes therapeutisches Potenzial haben, aber wir können noch nicht sagen, ob sie sich irgendwann in der Praxis bewähren werden.“
Die Ergebnisse der Studie wurden in der Zeitschrift Cell Reports Physical Science veröffentlicht.
