Neue Veröffentlichungen
Schlüsselprotein identifiziert, das den Verlust von Knochenmasse bei Osteoporose verhindert
Last reviewed: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
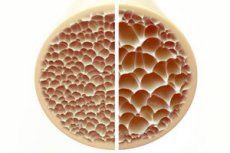
Osteoporose, eine Erkrankung, die durch poröse und brüchige Knochen gekennzeichnet ist, stellt eine erhebliche Bedrohung für die Gesundheit des Skeletts dar. Knochen sind die wichtigste Stütze des menschlichen Körpers und bieten lebenswichtigen Halt. Schwindet die Knochenmasse, beeinträchtigt dies nicht nur diese Stütze, sondern auch die Gesamtfunktion, was zu einer verminderten Lebensqualität führt.
Da Osteoporose in der alternden Bevölkerung immer häufiger auftritt, steigt die Belastung der Gesundheitsressourcen für die Langzeitpflege. Daher ist es notwendig, die Mechanismen zu verstehen, die zur Entstehung von Osteoporose beitragen, und wirksame, gezielte Behandlungen zu entwickeln, um die langfristigen Auswirkungen zu minimieren.
Osteoblasten und Osteoklasten sind zwei Zelltypen, die eine Schlüsselrolle bei der Erhaltung und dem Umbau von Knochengewebe spielen. Während Osteoblasten knochenbildende Zellen sind, die für die Synthese und Ablagerung von neuem Knochengewebe verantwortlich sind, sind Osteoklasten knochenabbauende Zellen, die am Abbau und der Entfernung von altem oder beschädigtem Knochengewebe beteiligt sind.
Ein erhöhter Anteil an Osteoklasten führt zu Knochenschwund bei Erkrankungen wie Osteoporose, rheumatoider Arthritis (Gelenkentzündung) und Knochenmetastasen (Knochenkrebs). Osteoklasten entstehen durch die Differenzierung von Makrophagen oder Monozyten, die zu den Immunzellen gehören.
Die Hemmung der Osteoklastendifferenzierung könnte daher eine therapeutische Strategie zur Verhinderung von Knochenschwund darstellen. Die genauen molekularen Mechanismen, die den komplexen Prozess des Knochenumbaus regulieren, sind jedoch noch unklar.
In einer neuen Studie untersuchten Professor Tadayoshi Hayata, Herr Takuto Konno und Frau Hitomi Murachi von der Tokyo University of Science gemeinsam mit Kollegen die molekulare Regulierung der Osteoklastendifferenzierung. Die Stimulation mit dem Rezeptoraktivator des nukleären Faktors Kappa B (RANKL) induziert die Differenzierung von Makrophagen zu Osteoklasten.
Darüber hinaus wurden Signalwege des Knochenmorphogenetischen Proteins (BMP) und des Transformierenden Wachstumsfaktors (TGF)-β mit der Regulierung der RANKL-vermittelten Osteoklastendifferenzierung in Verbindung gebracht. In der vorliegenden Studie untersuchten die Forscher die Rolle von Ctdnep1, einer Phosphatase (einem Enzym, das Phosphatgruppen entfernt), die nachweislich BMP- und TGF-β-Signalwege unterdrückt.
Die Studie wurde in der Zeitschrift Biochemical and Biophysical Research Communications veröffentlicht.
Professor Hayata erklärt: „RANKL fungiert als ‚Beschleuniger‘ für die Osteoklastendifferenzierung. Zum Autofahren braucht man nicht nur Gas, sondern auch Bremsen. Wir haben festgestellt, dass Ctdnep1 als ‚Bremse‘ bei der Osteoklastendifferenzierung fungiert.“
Die Forscher untersuchten zunächst die Ctdnep1-Expression in RANKL-behandelten Mausmakrophagen und unbehandelten Kontrollzellen. Sie beobachteten, dass sich die Ctdnep1-Expression als Reaktion auf die RANKL-Stimulation nicht veränderte. Allerdings war Ctdnep1 in Makrophagen in granulärer Form im Zytoplasma lokalisiert und differenzierte sich in Osteoklasten, was sich von seiner normalen perinukleären Lokalisierung in anderen Zelltypen unterscheidet. Dies deutet auf seine zytoplasmatische Funktion bei der Osteoklastendifferenzierung hin.
Darüber hinaus führte der Knockdown von Ctdnep1 (Herunterregulierung der Genexpression) zu einer Zunahme der Anzahl der Osteoklasten, die positiv für Tartrat-resistente saure Phosphatase (TRAP) sind, wobei TRAP ein Marker für differenzierte Osteoklasten ist.
Das Ausschalten von Ctdnep1 führte zu einer erhöhten Expression wichtiger Differenzierungsmarker, darunter „Nfatc1“, ein durch RANKL induzierter Master-Transkriptionsfaktor für die Osteoklastendifferenzierung. Diese Ergebnisse stützen eine „Bremsfunktion“ von Ctdnep1, wodurch es die Osteoklastendifferenzierung negativ reguliert. Darüber hinaus führte das Ausschalten von Ctdnep1 auch zu einer erhöhten Calciumphosphatabsorption, was auf eine unterdrückende Rolle von Ctdnep1 bei der Knochenresorption hindeutet.
Obwohl Ctdnep1-Knockout die BMP- und TGF-β-Signalgebung nicht veränderte, zeigten Ctdnep1-defiziente Zellen erhöhte Konzentrationen phosphorylierter (aktivierter) Proteine, die Produkte des RANKL-Signalwegs sind. Diese Ergebnisse legen nahe, dass die hemmende Wirkung von Ctdnep1 auf die Osteoklastendifferenzierung möglicherweise nicht über BMP- und TGF-β-Signalgebung, sondern über eine Herunterregulierung des RANKL-Signalwegs und der Nfatc1-Proteinspiegel vermittelt wird.
Insgesamt liefern diese Ergebnisse neue Einblicke in den Differenzierungsprozess von Osteoklasten und identifizieren potenzielle therapeutische Ansatzpunkte für die Entwicklung von Behandlungen zur Reduzierung des Knochenschwunds durch Osteoklastenüberaktivität. Neben Erkrankungen, die durch Knochenschwund gekennzeichnet sind, wurde Ctdnep1 auch als ursächlicher Faktor beim Medulloblastom, einem Hirntumor im Kindesalter, identifiziert. Die Autoren sind optimistisch, dass ihre Forschung auf andere menschliche Erkrankungen als den Knochenstoffwechsel ausgeweitet werden kann.
Professor Hayata fasst zusammen: „Unsere Ergebnisse legen nahe, dass Ctdnep1 erforderlich ist, um eine übermäßige Osteoklastenbildung zu verhindern. Diese Ergebnisse könnten unser Wissen darüber, wie das Phosphorylierungs-Dephosphorylierungs-Netzwerk die Osteoklastendifferenzierung steuert, weiter erweitern und neue therapeutische Strategien für die Behandlung von Knochenerkrankungen liefern, die mit übermäßiger Osteoklastenaktivität einhergehen.“
