Neue Veröffentlichungen
Klärung der zellulären Mechanismen der Parodontitis anhand eines verbesserten Tiermodells
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Forscher der Tokyo Medical and Dental University (TMDU) haben eine Technik entwickelt, die eine detaillierte Analyse der Entwicklung von Parodontitis im Laufe der Zeit ermöglicht.
Parodontitis ist die häufigste Ursache für Zahnverlust und betrifft weltweit fast jeden fünften Erwachsenen. In den meisten Fällen ist die Erkrankung eine entzündliche Reaktion auf eine bakterielle Infektion des Zahngewebes.
Mit zunehmender Verschlechterung des Zustands beginnt sich das Zahnfleisch zurückzuziehen und legt Zahnwurzeln und Knochen frei. Die Zahl der Parodontitis-Fälle nimmt mit dem Alter zu. Angesichts der steigenden Lebenserwartung der Weltbevölkerung ist es wichtig, die Ursachen und den Verlauf der Erkrankung genau zu verstehen.
In einer in der Fachzeitschrift Nature Communications veröffentlichten Studie haben Forscher der TMDU einen Weg gefunden, dieses Ziel zu erreichen, indem sie ein weit verbreitetes Tiermodell zur Erforschung von Parodontitis verbesserten.
Die direkte Untersuchung von Parodontitis beim Menschen ist schwierig. Daher greifen Wissenschaftler für präklinische Studien häufig auf Tiermodelle zurück. Beispielsweise ermöglicht das „Ligatur-induzierte Parodontitis-Mausmodell“ seit seiner Einführung im Jahr 2012 die Untersuchung der zellulären Mechanismen, die der Erkrankung zugrunde liegen.
Vereinfacht ausgedrückt, induziert dieses Modell künstlich Parodontitis, indem Seidenfäden an den Backenzähnen von Mäusen angebracht werden, wodurch sich Plaque ansammelt. Obwohl diese Methode praktisch und effektiv ist, erfasst sie nicht das vollständige Bild der Parodontitis.
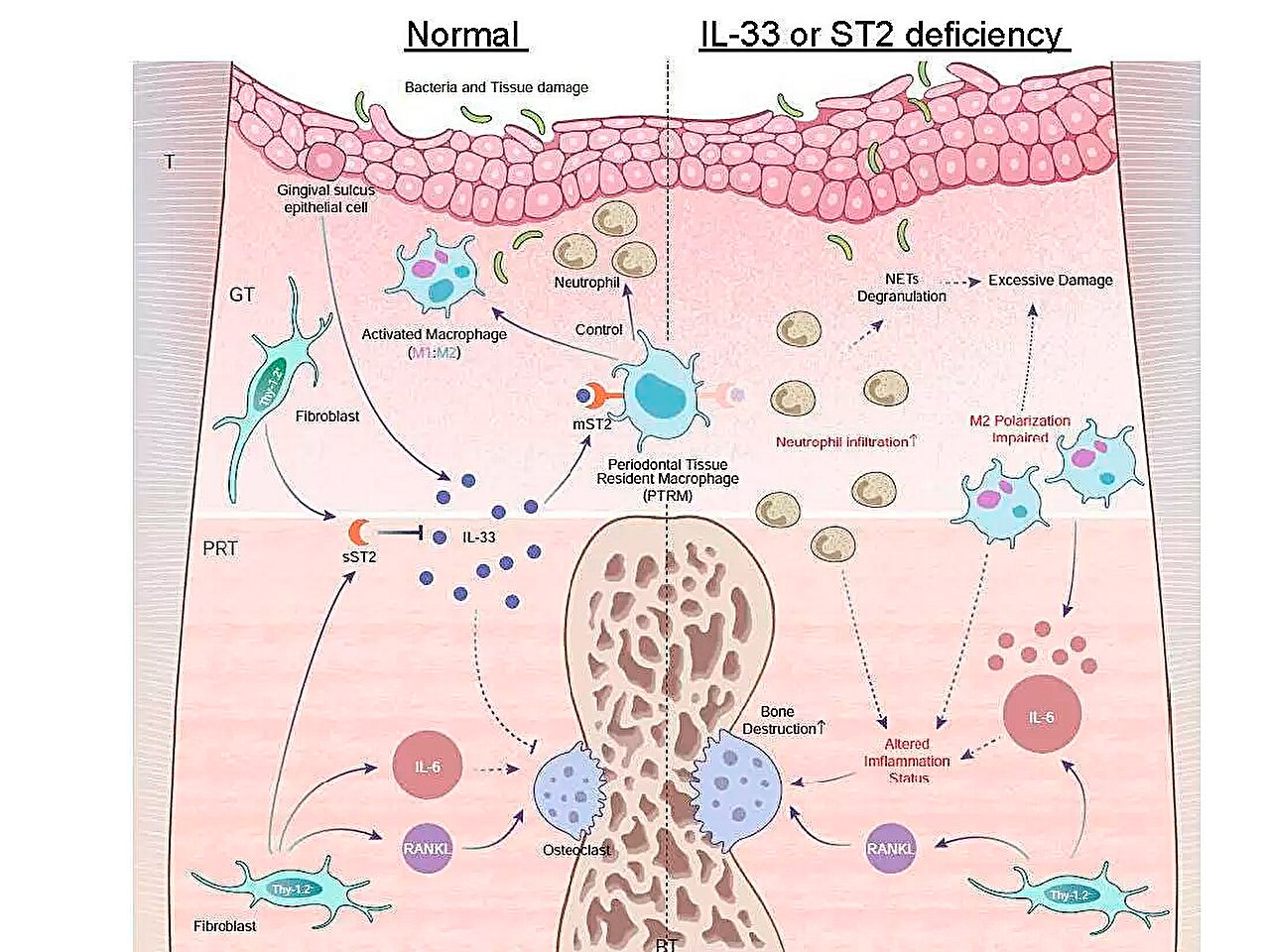
Schematische Darstellung der Expressionsprofile entzündlicher Gene bei Parodontitis und der Rolle der IL-33/ST2-Achse bei der Bekämpfung akuter Entzündungen. Quelle: Tokyo Medical and Dental University.
„Obwohl parodontales Gewebe aus Zahnfleisch, parodontalem Ligament, Alveolarknochen und Zement besteht, werden Analysen aufgrund technischer und quantitativer Einschränkungen üblicherweise ausschließlich an Zahnfleischproben durchgeführt“, erklärt Studienleiter Anhao Liu. „Diese Probenahmestrategie schränkt die Schlussfolgerungen aus diesen Studien ein. Daher sind Methoden erforderlich, die eine gleichzeitige Analyse aller Gewebekomponenten ermöglichen.“
Um diese Einschränkung zu beheben, entwickelte das Forschungsteam ein modifiziertes Ligatur-induziertes Parodontitis-Modell. Anstelle der klassischen Einzelligatur verwendeten sie eine Dreifachligatur am oberen linken Backenzahn männlicher Mäuse. Diese Strategie vergrößerte den Bereich des Knochenverlusts, ohne den Knochen um den zweiten Backenzahn herum signifikant zu zerstören, wodurch die Anzahl verschiedener parodontaler Gewebetypen zunahm.
„Wir haben drei Hauptgewebetypen isoliert und die RNA-Ausbeute der beiden Modelle untersucht. Die Ergebnisse zeigten, dass das dreifach ligierte Modell die Ausbeute effektiv erhöhte, indem es die vierfache Menge an normalem periradikulärem Gewebe erreichte und eine hochauflösende Analyse verschiedener Gewebetypen ermöglichte“, erklärt der leitende Autor Dr. Mikihito Hayashi.
Nachdem die Wirksamkeit ihres modifizierten Modells bestätigt war, machten sich die Forscher daran, die Auswirkungen der Parodontitis auf die Genexpression in verschiedenen Gewebetypen im Laufe der Zeit zu untersuchen, wobei sie sich auf Gene konzentrierten, die mit Entzündungen und der Osteoklastendifferenzierung in Zusammenhang stehen.
Eine ihrer wichtigsten Erkenntnisse war, dass die Expression des Gens Il1rl1 im periradikulären Gewebe fünf Tage nach der Ligatur signifikant erhöht war. Dieses Gen kodiert das ST2-Protein in Rezeptor- und Decoy-Isoformen, das an ein Zytokin namens IL-33 bindet, das an entzündlichen und immunregulatorischen Prozessen beteiligt ist.
Um die Rolle dieses Gens besser zu verstehen, induzierte das Team Parodontitis bei genetisch veränderten Mäusen, denen entweder das Il1rl1- oder das Il33-Gen fehlte. Diese Mäuse zeigten eine beschleunigte entzündliche Knochenzerstörung, was die schützende Rolle des IL-33/ST2-Signalwegs unterstreicht. Weitere Analysen von Zellen, die das ST2-Protein in seiner Rezeptorform mST2 enthielten, zeigten, dass die meisten von ihnen aus Makrophagen stammten.
„Makrophagen werden je nach Aktivierung im Allgemeinen in zwei Haupttypen eingeteilt: proinflammatorische und antiinflammatorische. Wir fanden heraus, dass mST2-exprimierende Zellen einzigartig sind, da sie gleichzeitig einige Marker beider Makrophagentypen exprimierten“, kommentierte der leitende Autor Dr. Takanori Iwata. „Diese Zellen waren bereits vor Beginn der Entzündung im periradikulären Gewebe vorhanden, daher nannten wir sie ‚parodontalgeweberesidente Makrophagen‘.“
Zusammenfassend zeigen die Ergebnisse dieser Studie, dass ein modifiziertes Tiermodell zur Untersuchung von Parodontitis in einem detaillierteren Maßstab bis hinunter zur biomolekularen Ebene geeignet ist.
„Wir schlagen die Möglichkeit eines neuen molekularen Signalwegs zwischen IL-33 und ST2 vor, der Entzündungen und Knochenzerstörung bei Parodontitis reguliert, zusammen mit spezifischen Makrophagen im periradikulären Gewebe, die maßgeblich an Parodontitis beteiligt sind. Dies wird hoffentlich zur Entwicklung neuer Behandlungsstrategien und Präventionsmethoden führen“, so das Fazit des leitenden Autors Dr. Tomoki Nakashima.
