Neue Veröffentlichungen
Wie sich ein Embryo in mütterliches Gewebe „beißt“: Der Mechanismus der Einnistung beim Menschen erstmals in Echtzeit gefilmt
Zuletzt überprüft: 23.08.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
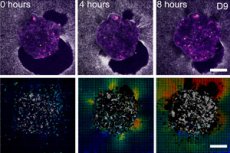
Wissenschaftler aus Barcelona (IBEC, Dexeus Mujer) und Tel Aviv haben erstmals in Echtzeit und in 3D gezeigt, wie sich ein menschlicher Embryo am „Gebärmuttergerüst“ anheftet und das umgebende Gewebe buchstäblich zieht und umstrukturiert. Dazu schufen sie eine deformierbare Ex-vivo-Plattform (Kollagen/ECM-Gele) und wendeten die Zugkraftmikroskopie direkt auf lebende menschliche und Mausembryonen an. Die wichtigste Erkenntnis: Das Kraftmuster ist artspezifisch, und die Embryonen selbst sind mechanosensitiv: Sie reagieren auf äußere mechanische Reize, indem sie das Zytoskelett umstrukturieren und die Wachstumsrichtung ändern.
Hintergrund der Studie
Die Implantation ist der Engpass der menschlichen Fortpflanzung: In diesem Stadium scheitern sowohl natürliche Empfängnisse als auch IVF-Versuche am häufigsten. Gleichzeitig erfolgt die Implantation beim Menschen interstitiell: Der Embryo „klebt“ nicht einfach fest, sondern bettet sich vollständig in die Gebärmutterschleimhaut ein – ein biochemisch und mechanisch komplexer Prozess, der bis vor kurzem in lebenden Systemen beim Menschen kaum beobachtet wurde. Daher blieb die Mechanik der Adhäsion und Invasion eine „Black Box“, und Schlussfolgerungen wurden oft auf der Grundlage indirekter Marker oder Daten aus Tiermodellen gezogen.
Die klassische Implantationsbiologie stützt sich stark auf die Maus, doch es gibt grundlegende Unterschiede zwischen den Arten, von der Blastozystenorientierung über die Implantationstiefe bis hin zum Muster der zellulären Kräfte. Bei Mäusen verläuft die Implantation eher oberflächlich, mit bevorzugten Richtungen der Gewebeverlagerung; beim Menschen ist sie deutlich invasiv, mit multifokalen Zugkräften um den Embryo. Diese Unterschiede deuten darauf hin, dass das Mausmodell nicht immer auf den Menschen übertragbar ist, insbesondere in mechanischer Hinsicht. Direkte Beobachtungen des menschlichen Embryos in einer deformierbaren Umgebung waren erforderlich.
Der technologische Durchbruch wurde durch die Kombination deformierbarer 2D/3D-Matrizen (Kollagen/ECM) und Traktionskraftmikroskopie mit Langzeit-Hochfrequenzbildgebung ermöglicht. Diese „künstliche Gebärmutter“ ermöglichte es, buchstäblich zu sehen und zu messen, wie der Embryo das umgebende Gewebe zieht, umstrukturiert und „bohrt“ – und wie er auf äußere mechanische Reize reagiert (Mechanosensitivität). Dies eröffnet neue Kriterien zur Beurteilung des Implantationspotenzials und zur Feinabstimmung der Bedingungen für den Embryotransfer.
Der Kontext wird angewendet: Wenn die mechanischen Eigenschaften der Umgebung und das Muster der embryonalen Kräfte mit dem Erfolg der Implantation zusammenhängen, ist es bei der IVF möglich, die Steifheit/Zusammensetzung der Matrix gezielt auszuwählen, die Zeitfenster der Übertragung zu berücksichtigen und sogar „Kraft“-Metriken als zusätzlichen Auswahlmarker zu verwenden. Parallel dazu werden solche Plattformen dazu beitragen, den Anteil der frühen Schwangerschaftsverluste zu erklären, wenn die Biochemie „normal“ ist, die Adhäsionsmechanik jedoch nicht. All dies macht direkte 3D-Beobachtungen der menschlichen Implantation nicht nur zu einem schönen Video, sondern zu einem neuen Werkzeug für die Reproduktionsmedizin.
Warum ist das wichtig?
Implantationsfehler sind eine der Hauptursachen für Unfruchtbarkeit und für bis zu 60 % aller Fehlgeburten verantwortlich. Trotz biochemischer Fortschritte in der IVF blieben die Mechanismen dieses Prozesses beim Menschen eine „Blackbox“. Ein neuer Ansatz ermöglicht es, die Kräfte und Bahnen der Embryoimplantation zu erkennen und bietet die Grundlage für eine verbesserte Embryoauswahl und Transferbedingungen.
So wurde es gemacht
Die Forscher bauten eine „künstliche Gebärmutter“ – eine weiche, transparente und verformbare Umgebung, in der sich eine gewebeähnliche Matrix unter dem Einfluss embryonaler Kräfte sichtbar verschiebt. Anschließend wurden die Faserverschiebungen kontinuierlich mikroskopisch und computergestützt analysiert.
- 2D- und 3D-Plattformen: Bei 3D wird der Embryo sofort in die Matrix eingebettet (die Anheftungsphase wird „umgangen“), wodurch man das Bohren in die Dicke des Gewebes sehen kann.
- Hohes „Überleben und Eindringen“ in 3D: etwa 80 % erfolgreiche Invasion (begrenzt durch die Nähe zum Glas).
- Traktionskarten und digitale Volumenkorrelation zeigen die Amplituden und Richtungen der Verschiebungen um den Embryo herum – im Wesentlichen ein „Abdruck“ der Kraft im Laufe der Zeit.
Was genau wurde gefunden (kurz und stichpunktartig)
1) Artspezifische Mechanismen der Implantation
- Mensch: Der Embryo wird in die Matrix eingesetzt, wodurch mehrere Zugherde entstehen und radial gleichmäßige Verschiebungen um sich herum entstehen; die Invasionstiefe beträgt bis zu 200 µm.
- Maus: Der Embryo breitet sich überwiegend auf der Oberfläche aus, mit ausgeprägten Hauptverschiebungsrichtungen.
2) Der Embryo nimmt die Mechanik der Umgebung wahr
- Äußere Kräfte → Antwort: beim menschlichen Embryo – Rekrutierung von Myosin und gerichtete Zellpseudopodien; bei der Maus – Drehung der Implantations-/Wachstumsachse in Richtung der Quelle der äußeren Kraft (Ausrichtung der PD-Achse).
- Mechanosensitive Marker: Bei Mäusen Verschiebungen der YAP-Lokalisierung im Trophoblasten; zusammen deutet dies auf einen mechanosensitiven Rückkopplungskreislauf hin.
3) Die Beziehung zwischen Stärke und Erfolg der Implantation
- Weniger Kollagenverdrängung → schlechterer Implantationsverlauf bei menschlichen Embryonen.
- Integrine – der „Koppler“ der Stärke: RGD-Peptidblockade/Src-Hemmung bei Mäusen reduziert Implantationstiefe/-fläche.
Wie sieht die Umsetzung aus?
- Auf 2D- und 3D-Plattformen bildet sich um den Embryo ein wachsender „Heiligenschein“ aus Faserverschiebungen; die Traktionskarte pulsiert, als würde der Embryo seine Umgebung „scannen“.
- Auf Glas bildet der menschliche Embryo einen flachen Auswuchs, in einer weichen Matrix bleibt er jedoch kugelförmiger und geht tiefer – wie in lebendem Gewebe.
Was bringt das für die Praxis (Aussichten für IVF und nicht nur)
Die Idee ist einfach: Bei der Implantation geht es nicht nur um „Rezeptorchemie“, sondern auch um die Mechanik von Adhäsion und Traktion. Das bedeutet, dass wir Folgendes optimieren können:
- Materialien und Medienhärte während Kultur-/Implantationspotentialtests;
- Neue Marker für die Embryonenauswahl – basierend auf Trajektorien und Amplitude der Verschiebungen in der „intelligenten“ Matrix;
- Gebärmuttertraining/-modulation (z. B. durch sanfte mechanische Reize) zur Verbesserung der Adhäsion ohne aggressive Eingriffe.
Achtung: Ex-vivo-Arbeit findet nicht „im Mutterleib“ statt. Aber allein die Tatsache, dass ein externes mechanisches Signal die Ausrichtung der Implantation/Achsenanordnung verändert, eröffnet die Möglichkeit zu personalisierten Bedingungen des Embryotransfers.
Einschränkungen
- Das Ex-vivo-Modell berücksichtigt nicht die Immun-, Hormon- und Gefäßdynamik des realen Endometriums.
- Matrigel/Kollagen definieren eine Reihe von Eigenschaften (Steifigkeit, Viskoelastizität, Zusammensetzung), es ist schwierig, sie durch einen Parameter zu ändern;
- Ethische Einschränkungen bei Studien am Menschen (bis zu 14 Tage) begrenzen die Langzeitbeobachtung. Die hohe Übereinstimmung mit bekannten In-vivo-Implantationsarten (interstitiell beim Menschen vs. oberflächlich bei Mäusen) erhöht jedoch das Vertrauen in das Modell.
Abschluss
Der menschliche Embryo „zieht“ und „bohrt“ sich aktiv in das mütterliche Gewebe, und mechanische Reize aus der Umgebung können sein Verhalten verändern. Das Kraftmuster und die Einnistungsstrategie unterscheiden sich bei Mensch und Maus – und dies könnte erklären, warum das Mausmodell beim Menschen nicht immer eine erfolgreiche Einnistung vorhersagt. Die Mechanik spielt heute eine wichtige Rolle in der frühen Embryologie und Reproduktionsmedizin.
Quelle: Godeau AL et al. Zugkraft und Mechanosensitivität vermitteln speziesspezifische Implantationsmuster in menschlichen und Mausembryonen. Science Advances 11(33): eadr5199 (15. August 2025). DOI: 10.1126/sciadv.adr519
