Neue Erkenntnisse erweitern das Verständnis der Ursachen des Rett-Syndroms
Zuletzt überprüft: 14.06.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.

Das Rett-Syndrom ist eine seltene neurologische Entwicklungsstörung, für die es derzeit weder eine Heilung noch eine gute Therapie gibt. Es verursacht schwere körperliche und kognitive Symptome, von denen sich viele mit Autismus-Spektrum-Störungen überschneiden.
Rett-Syndrom wird durch Mutationen im MECP2-Gen verursacht, das im Gehirn stark exprimiert wird und eine wichtige Rolle bei der Erhaltung der Gesundheit von Neuronen zu spielen scheint. Das Gen befindet sich auf dem X-Chromosom und das Syndrom betrifft hauptsächlich Mädchen. Um Behandlungen für das Rett-Syndrom zu entwickeln, möchten Forscher MECP2 und seine Funktionen im Gehirn besser verstehen.
Forscher, darunter Rudolf Jaenisch, Mitbegründer des Whitehead Institute, untersuchen MECP2 seit Jahrzehnten, doch viele grundlegende Fakten über das Gen blieben unbekannt. Das MECP2-Protein, das durch das Gen kodiert wird, ist an der Genregulation beteiligt; es bindet an DNA und beeinflusst die Expressionsniveaus verschiedener anderer Gene, also die Menge an Protein, die sie produzieren.
Den Forschern stand jedoch keine vollständige Liste der Gene zur Verfügung, die MECP2 beeinflusst, und es bestand kein Konsens darüber, wie MECP2 diese Gene beeinflusst.
Frühe Studien zu MECP2 legten nahe, dass es ein Repressor sei, der die Expression seiner Zielgene reduziert, aber Forschungen von Jaenisch und anderen hatten zuvor gezeigt, dass MECP2 auch als Aktivator wirkt und die Expression seiner Ziele erhöht – und dass es in erster Linie ein Aktivator sein könnte. Ebenfalls unbekannt war der Wirkungsmechanismus von MECP2 oder was genau das Protein tut, das zu Veränderungen der Genexpression führt.
Technische Einschränkungen haben Forscher daran gehindert, Klarheit über diese Fragen zu gewinnen. Doch Yanish, ein Postdoc in seinem Labor, Yi Liu, und ein ehemaliges Mitglied von Yanishs Labor, Anthony Flamier, heute Assistenzprofessor am Forschungszentrum CHU Sainte-Justine der Université de Montréal, haben modernste Methoden eingesetzt, um diese verbleibenden Fragen zu MECP2 zu beantworten und neue Erkenntnisse über seine Rolle bei der Gesundheit und Erkrankung des Gehirns zu gewinnen.
Ihre Ergebnisse wurden in der Zeitschrift Neuron veröffentlicht, und die Forscher haben auch ein Online-Repository ihrer MECP2-Daten erstellt, das MECP2-NeuroAtlas-Portal, als Ressource für andere Forscher.
„Ich denke, dieser Artikel wird die Art und Weise, wie die Menschen darüber denken, wie MECP2 das Rett-Syndrom verursacht, grundlegend verändern. Wir haben ein völlig neues Verständnis des Mechanismus, und dies könnte neue Wege für die Entwicklung von Behandlungen für diese Krankheit eröffnen“, sagt Jaenisch, der auch Professor für Biologie am Massachusetts Institute of Technology ist. Technologie.
Erweitertes Verständnis von MECP2 im Gehirn
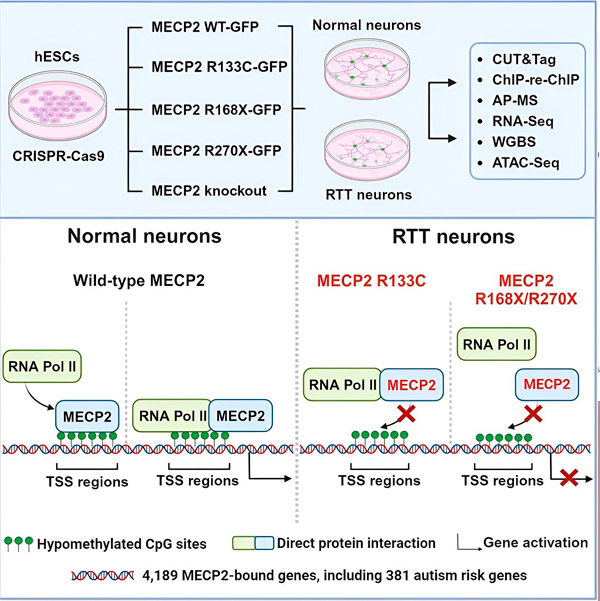
Die Forscher erstellten zunächst eine detaillierte Karte der Bindungsorte von MECP2 in der Gensequenz menschlicher Neuronen, entweder innerhalb von Genen oder in regulatorischen DNA-Regionen in deren Nähe. Sie verwendeten einen Ansatz namens CUT&Tag, der Protein-DNA-Interaktionen mit hoher Genauigkeit erkennen kann.
Forscher haben mehr als viertausend Gene entdeckt, die mit MECP2 in Zusammenhang stehen. Sie wiederholten ihre Kartierung in Neuronen mit häufigen MECP2-Mutationen, die mit dem Rett-Syndrom in Zusammenhang stehen, um festzustellen, wo MECP2 im Krankheitszustand erschöpft ist.
Das Wissen, an welche Gene MECP2 bindet, ermöglichte es Liu und Flamier, Verbindungen zwischen den Zielen von MECP2 und der Gesundheit des Gehirns herzustellen. Sie fanden heraus, dass viele seiner Ziele an der Entwicklung und Funktion neuronaler Axone und Synapsen beteiligt sind.
Sie verglichen außerdem ihre Liste der MECP2-Ziele mit der Datenbank der Simons Foundation Autism Research Initiative (SFARI) mit autismusbezogenen Genen und fanden heraus, dass 381 Gene in dieser Datenbank MECP2-Ziele waren.
Quelle: Neuron (2024). DOI: 10.1016/j.neuron.2024.04.007
Diese Erkenntnisse können helfen, die Mechanismen zu klären, die den Autismussymptomen beim Rett-Syndrom zugrunde liegen, und bieten einen guten Ausgangspunkt für die Untersuchung der möglichen Rolle von MECP2 bei Autismus.
„Wir haben die erste integrierte Karte des Epigenoms von MECP2 in Gesundheit und Krankheit erstellt, und diese Karte kann zukünftige Forschungen leiten“, sagt Liu. „Das Wissen, welche Gene von MECP2 angegriffen werden und welche Gene bei der Krankheit direkt gestört werden, bietet eine solide Grundlage für das Verständnis des Rett-Syndroms und für Fragen zur Genregulation in Neuronen.“
Die Forscher untersuchten auch, ob MECP2 die Expression seiner Zielgene erhöht oder verringert. Im Einklang mit der Geschichte von MECP2, das von einigen als Aktivator und von anderen als Repressor identifiziert wurde, fanden Liu und Flamier Beispiele, bei denen MECP2 beide Rollen spielt.
Obwohl MECP2 häufiger als Repressor betrachtet wird, fanden Liu und Flamier heraus, dass es in erster Linie ein Aktivator ist – was die früheren Ergebnisse von Jaenisch und Liu bestätigt. Ein neues Experiment zeigte, dass MECP2 mindestens 80 % seiner Ziele aktiviert, und ein anderes, dass es bis zu 88 % seiner Ziele aktiviert.
Die von den Forschern erstellte Zielgenkarte lieferte zusätzliche Einblicke in die Rolle von MECP2 als Aktivator. Sie fanden heraus, dass MECP2 bei Genen, die aktiviert werden, typischerweise an eine DNA-Region oberhalb des Gens bindet, die als Transkriptionsstartstelle bezeichnet wird.
Hier leitet die Zellmaschinerie den Prozess des Ablesens eines Gens in RNA ein, wonach die RNA in ein funktionelles Protein übersetzt wird, das das Produkt der Genexpression ist. Die Anwesenheit von MECP2 an der Transkriptionsstartstelle, an der die Genexpression beginnt, steht im Einklang mit seiner Rolle als Genaktivator.
Die Forscher machten sich dann daran, herauszufinden, welche Rolle MECP2 bei der Aktivierung von Genen spielt. Sie untersuchten, an welche Moleküle MECP2 an dieser Stelle zusätzlich zu DNA bindet, und fanden heraus, dass MECP2 direkt mit einem Proteinkomplex namens RNA-Polymerase II (RNA Pol II) interagiert. RNA Pol II ist eine wichtige Zellmaschine, die DNA in RNA transkribiert. RNA Pol II kann Gene nicht selbst finden, daher benötigt es viele Kofaktoren oder kooperierende Proteine, die ihm bei seiner Aufgabe helfen.
Die Forscher vermuten, dass MECP2 als ein solcher Kofaktor dient und RNA Pol II hilft, die Transkription an Genen zu initiieren, an die MECP2 bindet. Strukturanalysen von MECP2 haben Teile des Moleküls identifiziert, die an RNA Pol II binden, und andere Experimente haben bestätigt, dass der Verlust von MECP2 die Präsenz von RNA Pol II an relevanten Transkriptionsstartstellen sowie die Expressionsniveaus von Zielgenen verringert.
Dies deutet darauf hin, dass das Rett-Syndrom durch eine verringerte Transkription von Genen verursacht werden könnte, die von MECP2 angesteuert werden, aufgrund von Mutationen in MECP2, die verhindern, dass es an RNA Pol II oder an DNA bindet. Im Einklang mit dieser Idee sind die häufigsten mit Krankheiten verbundenen MECP2-Mutationen Trunkierungen: Mutationen, bei denen ein Teil des Proteins fehlt, was die Interaktion zwischen MECP2 und RNA Pol II verändern kann.
Die Forscher hoffen, dass ihre Erkenntnisse nicht nur unser Verständnis von MECP2 verändern, sondern dass ein tieferes und breiteres Verständnis davon, wie MECP2 die Entwicklung und Funktion des Gehirns beeinflusst, zu neuen Erkenntnissen führen kann, die Menschen mit Rett-Syndrom und verwandten Störungen, einschließlich Autismus, helfen werden.
„Dieses Projekt ist ein hervorragendes Beispiel für die kollaborative Natur der Arbeit des Jaenisch-Labors“, sagt Flamier. „Rudolph und Yi hatten ein spezifisches Problem mit dem Rett-Syndrom, und ich hatte Erfahrung mit der CUT&Tag-Technologie, die dieses Problem lösen könnte. Durch Diskussionen wurde uns klar, dass wir unsere Bemühungen bündeln konnten, und jetzt verfügen wir über eine großartige Informationssammlung über MECP2 und seine Verbindungen zur Krankheit.“
