Geschlossenes Arzneimittelverabreichungssystem könnte Chemotherapie verbessern
Zuletzt überprüft: 14.06.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
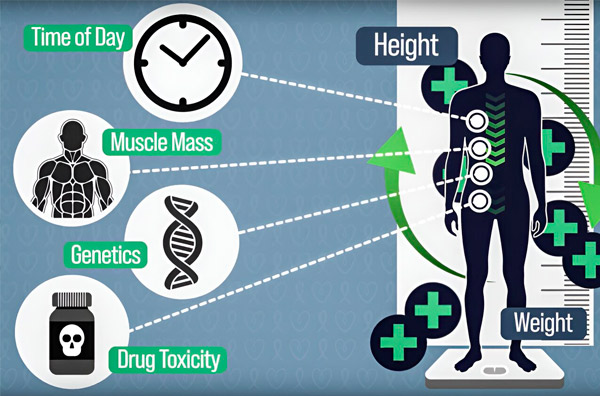
Wenn Krebspatienten eine Chemotherapie erhalten, wird die Dosierung der meisten Medikamente auf Grundlage der Körperoberfläche des Patienten berechnet. Dieser Indikator wird mithilfe einer Gleichung geschätzt, in die Größe und Gewicht des Patienten eingesetzt werden. Diese Gleichung wurde 1916 auf Grundlage der Daten von nur neun Patienten formuliert.
Dieser vereinfachte Ansatz zur Dosierung berücksichtigt keine anderen Faktoren und kann dazu führen, dass dem Patienten zu viel oder zu wenig des Medikaments verschrieben wird. Infolgedessen kann es bei manchen Patienten zu übermäßiger Toxizität oder mangelnder Wirksamkeit der Chemotherapie kommen.
Um die Genauigkeit der Chemotherapiedosierung zu verbessern, haben Ingenieure des MIT einen alternativen Ansatz entwickelt, der eine individuelle Dosierung für jeden Patienten ermöglicht. Ihr System misst die Medikamentenmenge im Körper des Patienten und diese Daten werden in den Controller eingegeben, der die Infusionsrate entsprechend anpassen kann.
Dieser Ansatz kann helfen, Unterschiede in der Pharmakokinetik von Medikamenten auszugleichen, die durch Körperzusammensetzung, genetische Veranlagung, durch Chemotherapie verursachte Organtoxizität, Wechselwirkungen mit anderen Medikamenten und Nahrungsmitteln sowie zirkadiane Schwankungen bei Enzymen, die für den Abbau von Chemotherapiemedikamenten verantwortlich sind, verursacht werden, sagen die Forscher. p>
„Indem wir Fortschritte im Verständnis des Medikamentenstoffwechsels erkennen und technische Werkzeuge anwenden, um die individuelle Dosierung zu vereinfachen, glauben wir, dass wir dazu beitragen können, die Sicherheit und Wirksamkeit vieler Medikamente zu verbessern“, sagt Giovanni Traverso, Assistenzprofessor für Maschinenbau am MIT und Gastroenterologe am Krankenhaus. Brigham and Women's Hospital und leitender Autor der Studie.
Louis DeRidder, ein MIT-Student, ist der Hauptautor des in Med veröffentlichten Artikels.
Kontinuierliche Überwachung
In dieser Studie konzentrierten sich die Forscher auf ein Medikament namens 5-Fluorouracil, das zur Behandlung von Darmkrebs und anderen Krebsarten eingesetzt wird. Das Medikament wird normalerweise über einen Zeitraum von 46 Stunden verabreicht und die Dosierung wird anhand einer Formel bestimmt, die auf der Größe und dem Gewicht des Patienten basiert und eine Schätzung der Körperoberfläche liefert.
Dieser Ansatz berücksichtigt jedoch keine Unterschiede in der Körperzusammensetzung, die die Verteilung des Medikaments im Körper beeinflussen können, oder genetische Variationen, die den Stoffwechsel beeinflussen. Diese Unterschiede können zu schädlichen Nebenwirkungen führen, wenn zu viel des Medikaments verabreicht wird. Wenn das Medikament nicht ausreicht, tötet es den Tumor möglicherweise nicht wie erwartet ab.
„Menschen mit gleicher Körperoberfläche können sehr unterschiedliche Körpergrößen und -gewichte, unterschiedliche Muskelmasse oder Genetik haben, aber solange Größe und Gewicht in diese Gleichung einbezogen werden, ergibt sich dieselbe Körperoberfläche, ist ihre Dosis identisch“, sagt DeRidder, Doktorand im Studiengang Medizintechnik und Medizinphysik des Harvard-MIT Health Sciences and Technology Program.
Ein weiterer Faktor, der die Menge des Medikaments im Blut zu einem bestimmten Zeitpunkt verändern kann, ist die zirkadiane Schwankung eines Enzyms namens Dihydropyrimidin-Dehydrogenase (DPD), das 5-Fluorouracil abbaut. Die Expression von DPD wird wie viele andere Enzyme im Körper durch einen zirkadianen Rhythmus reguliert. Somit ist der Abbau von 5-FU DPD nicht konstant, sondern variiert je nach Tageszeit. Diese zirkadianen Rhythmen können im Verlauf einer Infusion zu zehnfachen Schwankungen der 5-Fluorouracil-Menge im Blut eines Patienten führen.
„Wenn wir die Chemotherapiedosis anhand der Körperoberfläche berechnen, wissen wir, dass 5-Fluorouracil bei zwei Personen völlig unterschiedliche Toxizitäten hervorrufen kann. Ein Patient kann Behandlungszyklen mit minimaler Toxizität und dann einen Zyklus mit schrecklicher Toxizität durchlaufen. Von einem Zyklus zum nächsten hat sich etwas daran geändert, wie dieser Patient die Chemotherapie verstoffwechselt. Unsere veraltete Dosierungsmethode erfasst diese Veränderungen nicht, und die Patienten leiden darunter“, sagt Douglas Rubinson, klinischer Onkologe am Dana-Farber Cancer Institute und Autor des Artikels.
Eine Möglichkeit, die Variabilität der Pharmakokinetik einer Chemotherapie auszugleichen, ist eine Strategie namens „Therapeutisches Arzneimittelmonitoring“, bei der der Patient am Ende eines Behandlungszyklus eine Blutprobe abgibt. Nachdem diese Probe auf die Wirkstoffkonzentrationen analysiert wurde, kann die Dosierung bei Bedarf zu Beginn des nächsten Zyklus (bei 5-Fluorouracil normalerweise nach zwei Wochen) angepasst werden.
Dieser Ansatz hat sich als zu besseren Ergebnissen für die Patienten erwiesen, wurde jedoch bei Chemotherapien wie 5-Fluorouracil nicht weit verbreitet eingesetzt.
MIT-Forscher wollten eine ähnliche Art der Überwachung entwickeln, jedoch auf automatisierte Weise, die die Medikamentendosierung in Echtzeit personalisieren könnte, was zu besseren Ergebnissen für die Patienten führen könnte.
In ihrem geschlossenen Kreislaufsystem können die Medikamentenkonzentrationen kontinuierlich überwacht werden und diese Informationen werden verwendet, um die Infusionsrate des Chemotherapeutikums automatisch anzupassen, um die Dosis im Zielbereich zu halten.
Dieses geschlossene Kreislaufsystem ermöglicht eine personalisierte Medikamentendosierung, um zirkadiane Rhythmen sich ändernder Konzentrationen von medikamentenmetabolisierenden Enzymen sowie alle Änderungen der Pharmakokinetik des Patienten seit der letzten Behandlung, wie z. B. Durch die Chemotherapie verursachte Organschäden, zu berücksichtigen. Toxizität.
Um die Dosierung der Chemotherapie präziser zu gestalten, haben Ingenieure des MIT eine Methode entwickelt, mit der die Medikamentenmenge im Körper eines Patienten während einer stundenlangen Infusion kontinuierlich gemessen werden kann. Dies hilft dabei, Unterschiede auszugleichen, die durch Körperzusammensetzung, Genetik, Medikamententoxizität und zirkadiane Schwankungen verursacht werden. Quelle: Von Forschern bereitgestellt.
Das neue System, das von den Forschern entwickelt wurde und als CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor) bekannt ist, verwendet für jeden Schritt handelsübliche Geräte. Alle fünf Minuten werden Blutproben entnommen und schnell für die Analyse vorbereitet. Dabei wird die Konzentration von 5-Fluorouracil im Blut gemessen und mit dem Zielbereich verglichen.
Die Differenz zwischen Ziel- und gemessener Konzentration wird in den Kontrollalgorithmus eingegeben, der dann bei Bedarf die Infusionsrate anpasst, um die Dosis innerhalb des Konzentrationsbereichs zu halten, in dem das Medikament wirksam und ungiftig ist.
„Wir haben ein System entwickelt, mit dem wir die Medikamentenkonzentrationen kontinuierlich messen und die Infusionsrate entsprechend anpassen können, um die Medikamentenkonzentrationen innerhalb des therapeutischen Fensters zu halten“, sagt DeRidder.
Schnelle Anpassung
In Tierversuchen stellten die Forscher fest, dass sie mit CLAUDIA die im Körper zirkulierende Medikamentenmenge etwa 45 Prozent der Zeit im Zielbereich halten konnten.
Die Medikamentenspiegel bei Tieren, die eine Chemotherapie ohne CLAUDIA erhielten, blieben durchschnittlich nur 13 Prozent der Zeit im Zielbereich. In dieser Studie testeten die Forscher nicht die Wirksamkeit der Medikamentendosen, aber man geht davon aus, dass eine Aufrechterhaltung der Konzentrationen innerhalb des Zielfensters zu besseren Ergebnissen und geringerer Toxizität führt.
CLAUDIA konnte die 5-Fluorouracil-Dosis auch dann im Zielbereich halten, wenn ihr ein Medikament verabreicht wurde, das das DPD-Enzym hemmt. Bei Tieren, die ohne kontinuierliche Überwachung und Anpassung mit diesem Inhibitor behandelt wurden, stiegen die 5-Fluorouracil-Werte um das bis zu Achtfache.
Für diese Demonstration führten die Forscher jeden Schritt des Prozesses manuell mit handelsüblicher Ausrüstung durch, planen nun jedoch, jeden Schritt zu automatisieren, sodass Überwachung und Dosisanpassung ohne menschliches Eingreifen erfolgen können.
Zur Messung der Arzneimittelkonzentrationen verwendeten die Forscher Hochleistungsflüssigkeitschromatographie-Massenspektrometrie (HPLC-MS), eine Technik, die angepasst werden kann, um praktisch jede Art von Arzneimittel zu erkennen.
„Wir stellen uns eine Zukunft vor, in der wir CLAUDIA für jedes Arzneimittel verwenden können, das geeignete pharmakokinetische Eigenschaften aufweist und durch HPLC-MS nachweisbar ist, was eine personalisierte Dosierung für viele verschiedene Arzneimittel ermöglicht“, sagt DeRidder.
