Schlüsselprotein zur Vorbeugung von Knochenschwund bei Osteoporose identifiziert
Zuletzt überprüft: 14.06.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
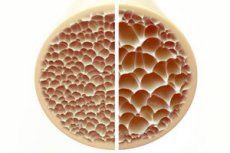
Osteoporose, eine Erkrankung, die durch poröse und brüchige Knochen gekennzeichnet ist, stellt eine erhebliche Bedrohung für die Gesundheit des Skeletts dar. Knochen sind die wichtigste strukturelle Stütze des menschlichen Körpers und bieten lebenswichtigen Halt. Wenn die Knochenmasse abnimmt, beeinträchtigt dies nicht nur diese Stütze, sondern auch die Gesamtfunktion, was zu einer verminderten Lebensqualität führt.
Da die Häufigkeit von Osteoporose in der alternden Bevölkerung zunimmt, steigt die Belastung der Gesundheitsressourcen für die Langzeitpflege. Daher ist es notwendig, die Mechanismen zu verstehen, die zur Entstehung von Osteoporose beitragen, und wirksame gezielte Behandlungen zu entwickeln, um ihre langfristigen Auswirkungen zu minimieren.
Osteoblasten und Osteoklasten sind zwei Arten von Zellen, die eine Schlüsselrolle bei der Erhaltung und Umgestaltung von Knochengewebe spielen. Während Osteoblasten knochenbildende Zellen sind und für die Synthese und Ablagerung von neuem Knochengewebe verantwortlich sind, sind Osteoklasten knochenabbauende Zellen, die an der Zersetzung und Entfernung von altem oder beschädigtem Knochengewebe beteiligt sind.
Eine Erhöhung des Anteils an Osteoklasten führt zu Knochenschwund bei Erkrankungen wie Osteoporose, rheumatoider Arthritis (Gelenkentzündung) und Knochenmetastasen (Krebs, der sich auf die Knochen ausgebreitet hat). Osteoklasten entstehen aus der Differenzierung von Makrophagen oder Monozyten, die Arten von Immunzellen sind.
Die Hemmung der Osteoklastendifferenzierung kann daher als therapeutische Strategie zur Verhinderung von Knochenschwund dienen. Die genauen molekularen Mechanismen, die den komplexen Prozess des Knochenumbaus regulieren, sind jedoch noch unklar.
In einer neuen Studie haben sich Professor Tadayoshi Hayata, Herr Takuto Konno und Frau Hitomi Murachi von der Tokyo University of Science zusammen mit Kollegen eingehender mit der molekularen Regulierung der Osteoklastendifferenzierung befasst. Die Stimulation durch den Rezeptor-Nuklearfaktor-Kappa-B-Aktivator-Liganden (RANKL) induziert die Differenzierung von Makrophagen in Osteoklasten.
Darüber hinaus wurden Signalwege des Knochenmorphogenetischen Proteins (BMP) und des Transformierenden Wachstumsfaktors (TGF)-β mit der Regulierung der RANKL-vermittelten Osteoklastendifferenzierung in Verbindung gebracht. In der aktuellen Studie wollten die Forscher die Rolle von Ctdnep1 untersuchen, einer Phosphatase (ein Enzym, das Phosphatgruppen entfernt), die die BMP- und TGF-β-Signalwege unterdrückt.
Die Studie wurde in der Zeitschrift Biochemical and Biophysical Research Communications veröffentlicht.
Professor Hayata erklärt: „RANKL wirkt als ‚Beschleuniger‘ für die Osteoklastendifferenzierung. Autofahren erfordert nicht nur ein Gaspedal, sondern auch Bremsen. Hier haben wir festgestellt, dass Ctdnep1 als ‚Bremse‘ bei der Osteoklastendifferenzierung wirkt.“
Die Forscher untersuchten zunächst die Expression von Ctdnep1 in Makrophagen von Mäusen, die mit RANKL behandelt wurden, und Kontrollzellen ohne Behandlung. Sie stellten fest, dass sich die Ctdnep1-Expression als Reaktion auf die RANKL-Stimulation nicht veränderte. Es war jedoch in Makrophagen in granulärer Form im Zytoplasma lokalisiert und differenzierte sich in Osteoklasten, was sich von seiner normalen perinukleären Lokalisierung in anderen Zelltypen unterschied, was auf seine zytoplasmatische Funktion bei der Osteoklastendifferenzierung hindeutet.
Darüber hinaus führte Ctdnep1-Knockout (Herunterregulierung des Gens) zu einer Zunahme der Anzahl von Osteoklasten, die positiv für Tartrat-resistente saure Phosphatase (TRAP) waren, wobei TRAP ein Marker für differenzierte Osteoklasten ist.
Ctdnep1-Knockout führte zu einer erhöhten Expression wichtiger Differenzierungsmarker, darunter „Nfatc1“, ein durch RANKL induzierter Haupttranskriptionsfaktor für die Osteoklastendifferenzierung. Diese Ergebnisse stützen eine „hemmende Funktion“ von Ctdnep1, wobei es die Osteoklastendifferenzierung negativ reguliert. Darüber hinaus führte das Knockout von Ctdnep1 auch zu einer erhöhten Calciumphosphatabsorption, was auf eine hemmende Rolle von Ctdnep1 bei der Knochenresorption hindeutet.
Obwohl das Knockout von Ctdnep1 die BMP- und TGF-β-Signalwege nicht veränderte, zeigten Ctdnep1-defiziente Zellen erhöhte Konzentrationen phosphorylierter (aktivierter) Proteine, die Produkte des RANKL-Signalwegs sind. Diese Ergebnisse legen nahe, dass die unterdrückende Wirkung von Ctdnep1 auf die Osteoklastendifferenzierung möglicherweise nicht über die BMP- und TGF-β-Signalwege vermittelt wird, sondern über eine negative Regulierung des RANKL-Signalwegs und der Nfatc1-Proteinspiegel.
Insgesamt liefern diese Ergebnisse neue Einblicke in den Osteoklastendifferenzierungsprozess und identifizieren potenzielle therapeutische Ziele, die zur Entwicklung von Behandlungen verwendet werden können, die auf die Verringerung des Knochenverlusts aufgrund von Osteoklastenüberaktivität abzielen. Neben Erkrankungen, die durch Knochenschwund gekennzeichnet sind, wurde Ctdnep1 auch als ursächlicher Faktor beim Medulloblastom, einem Hirntumor bei Kindern, identifiziert. Die Autoren sind optimistisch, dass ihre Forschung auf andere menschliche Erkrankungen als den Knochenstoffwechsel ausgeweitet werden kann.
Professor Hayata kommt zu dem Schluss: „Unsere Ergebnisse legen nahe, dass Ctdnep1 erforderlich ist, um eine übermäßige Osteoklastenbildung zu verhindern. Diese Ergebnisse könnten das Wissen darüber, wie das Phosphorylierungs-Dephosphorylierungs-Netzwerk die Osteoklastendifferenzierung steuert, weiter erweitern und neue therapeutische Strategien für die Behandlung von Knochenerkrankungen liefern, die mit übermäßiger Osteoklastenaktivität verbunden sind.“
