Wissenschaftler verfolgen die frühesten physischen Veränderungen in Zellen, die Krebs verursachen
Zuletzt überprüft: 14.06.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Wenn Krebs diagnostiziert wird, liegen bereits viele Ereignisse auf zellulärer und molekularer Ebene dahinter, die unbemerkt passiert sind. Obwohl Krebs für klinische Zwecke in frühe und späte Stadien eingeteilt wird, ist selbst ein Tumor im „frühen“ Stadium das Ergebnis vieler früherer Veränderungen im Körper, die nicht erkennbar waren.
Nun haben Wissenschaftler der Yale University School of Medicine (YSM) und ihre Kollegen ein detailliertes Verständnis einiger dieser frühen Veränderungen gewonnen, indem sie leistungsstarke hochauflösende Mikroskopie verwendeten, um die allerersten physischen Veränderungen zu verfolgen, die Krebs in Hautzellen von Mäusen verursachen.
Durch die Untersuchung von Mäusen, die eine Mutation tragen, die die Entwicklung von Krebs in ihren Haarfollikeln fördert, entdeckten Wissenschaftler, dass die ersten Anzeichen der Krebsbildung zu einer bestimmten Zeit und an einer bestimmten Stelle im Wachstum der Haarfollikel der Mäuse auftreten. Darüber hinaus stellten sie fest, dass diese präkanzerösen Veränderungen mit Medikamenten, sogenannten MEK-Inhibitoren, blockiert werden können.
Das Team wurde von Tianchi Xin, Ph.D., einem Postdoktoranden in der Genetikabteilung der YSM, geleitet und umfasste Valentina Greco, Ph.D., eine YSM-Professorin für Genetik und Mitglied des Yale Cancer Center und des Yale Stem Cell Center, sowie Sergi Regot, Ph.D., einen Assistenzprofessor für Molekularbiologie und Genetik an der Johns Hopkins School of Medicine.
Die Ergebnisse ihrer Forschung wurden in der Zeitschrift Nature Cell Biology veröffentlicht.
Die Wissenschaftler untersuchten Mäuse, die ein kutanes Plattenepithelkarzinom entwickelten, die zweithäufigste Art von Hautkrebs beim Menschen. Diese Mäuse wurden genetisch so verändert, dass sie eine krebsfördernde Mutation im KRAS-Gen aufwiesen, einem der am häufigsten mutierten Onkogene bei Krebserkrankungen beim Menschen. KRAS-Mutationen wurden auch bei Lungen-, Bauchspeicheldrüsen- und Dickdarmkrebs festgestellt.
Zu den frühen Veränderungen, die die Wissenschaftler untersuchten, gehörte das Wachstum einer winzigen, abnormalen Beule im Haarfollikel, die als präkanzeröse Anomalie eingestuft wird. „Das Verständnis dieser frühen Ereignisse kann uns helfen, Ansätze zu entwickeln, um die Entstehung von Krebs zu verhindern“, sagte Xin, Erstautor der Studie.
Obwohl sich ihre Studie auf Hautkrebs konzentrierte, glauben die Forscher, dass die von ihnen entdeckten Prinzipien auf viele andere durch KRAS-Mutationen verursachte Krebsarten angewendet werden könnten, da die beteiligten Schlüsselgene und -proteine bei verschiedenen Tumoren dieselben sind.
Mehr als nur Zellvermehrung Sowohl bei Menschen als auch bei Mäusen wachsen Haarfollikel ständig, verlieren altes Haar und bilden neues. Stammzellen, die sich in verschiedene Zelltypen entwickeln können, spielen bei diesem Erneuerungsprozess eine große Rolle. Frühere Studien haben gezeigt, dass KRAS-Mutationen zu einer erhöhten Stammzellvermehrung in Haarfollikeln führen, und dieser signifikante Anstieg der Stammzellzahlen wurde für die präkanzeröse Gewebeschädigung verantwortlich gemacht.
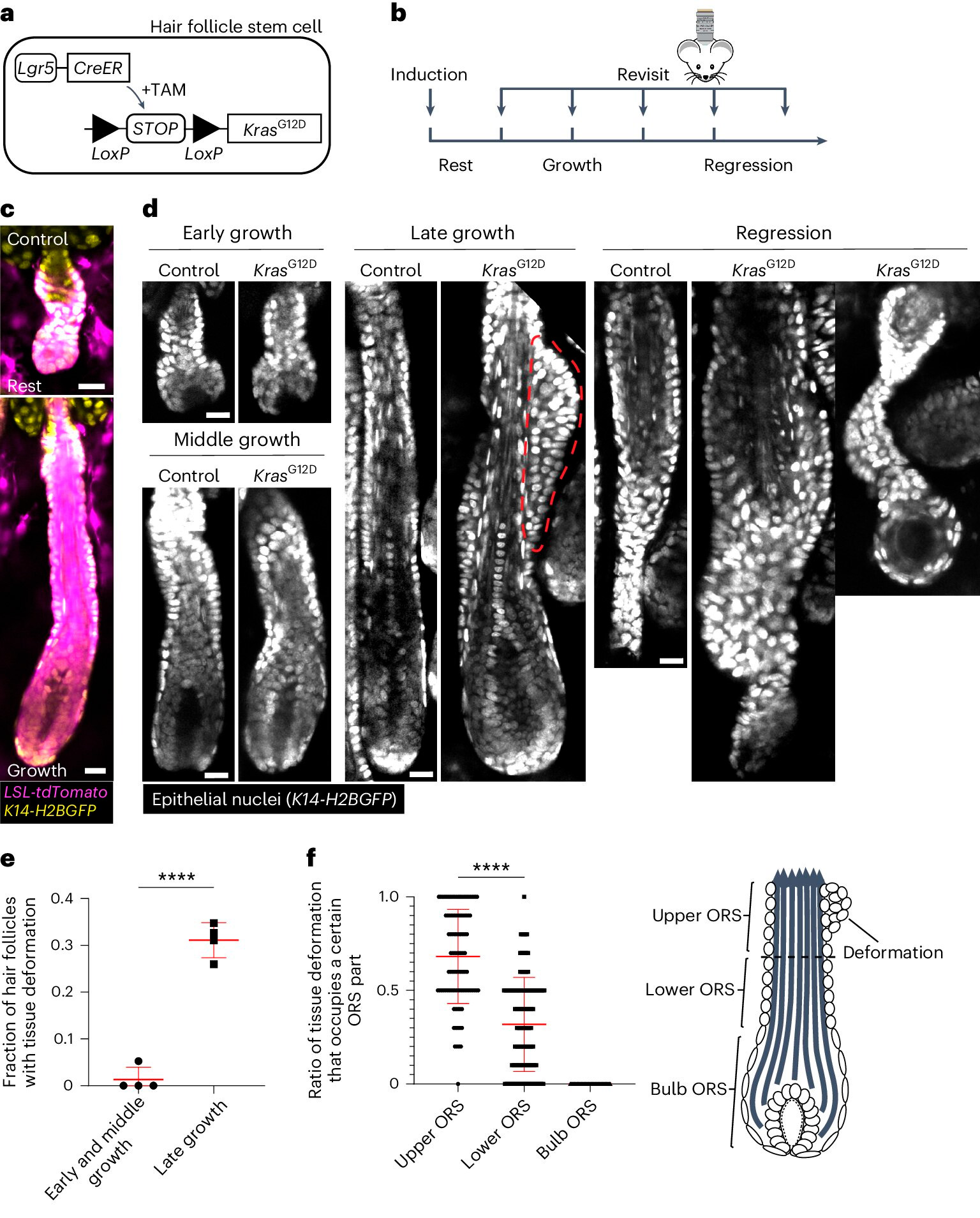
KrasG12D verursacht räumlich-zeitliche spezifische Gewebedeformationen während der Haarfollikelregeneration.
a. Schema des genetischen Ansatzes zur Induktion von KrasG12D in Haarfollikelstammzellen unter Verwendung des Tamoxifen-induzierbaren Cre–LoxP (TAM)-Systems.
b. Diagramm, das den Zeitpunkt der KrasG12D-Induktion und Neuabbildung in Bezug auf die Stadien des Haarwachstumszyklus zeigt.
c. Repräsentative Bilder von ruhenden und wachsenden Wildtyp-Haarfollikeln, die nach der Induktion den induzierbaren Cre tdTomato (Magenta)-Reporter enthalten.
d. Repräsentative Bilder von Kontroll- und KrasG12D-Haarfollikeln in verschiedenen Stadien des Haarwachstumszyklus. Gewebedeformationen in Form von Tuberkeln in der äußeren Wurzelscheide (ORS) werden durch die rote gepunktete Linie angezeigt.
e. Anteil der KrasG12D-Haarfollikel mit Gewebedeformation in verschiedenen Stadien des Haarfollikelwachstums.
f. Anteil der Gewebedeformationen, die die oberen, unteren und bauchigen Teile des ORS für einzelne KrasG12D-Haarfollikel besetzen.
Quelle: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Um diese Hypothese zu testen, verwendete das Team eine speziell entwickelte Form von mutiertem KRAS, das sie zu bestimmten Zeiten in den Hautzellen tierischer Haarfollikel aktivieren konnten. Xin und seine Kollegen verwendeten eine Mikroskopietechnik namens Intravitalbildgebung, die hochauflösende Bilder von Zellen in einem lebenden Körper ermöglicht und einzelne Stammzellen in Tieren markiert und verfolgt.
Als die KRAS-Mutation aktiviert wurde, begannen alle Stammzellen schneller zu proliferieren, aber die präkanzeröse Beule bildete sich nur an einer bestimmten Stelle im Haarfollikel und in einem Wachstumsstadium, was bedeutet, dass die allgemeine Zunahme der Zellzahl wahrscheinlich nicht die ganze Geschichte war.
Die Aktivierung der KRAS-Mutation in Haarfollikeln führte dazu, dass sich Stammzellen schneller vermehrten, ihre Migrationsmuster änderten und sich in andere Richtungen teilten als Zellen ohne die krebsfördernde Mutation.
Die Mutation betrifft ein Protein namens ERK. Xin konnte die ERK-Aktivität in einzelnen Stammzellen in lebenden Tieren in Echtzeit beobachten und entdeckte eine spezifische Änderung der Aktivität dieses Proteins, die durch die KRAS-Mutation verursacht wurde. Die Forscher konnten die Bildung einer präkanzerösen Beule auch mithilfe eines MEK-Inhibitors stoppen, der die ERK-Aktivität blockiert.
Das Medikament stoppte die Auswirkungen der Mutation auf die Zellmigration und -ausrichtung, jedoch nicht auf die allgemeine Stammzellvermehrung. Dies bedeutet, dass die Bildung der präkanzerösen Erkrankung auf diese ersten beiden Veränderungen und nicht auf eine erhöhte Zellvermehrung zurückzuführen ist.
Präkanzeröse Veränderungen im Kontext Die Verfolgung der Auswirkungen einer onkogenen Mutation in Echtzeit in einem lebenden Organismus ist die einzige Möglichkeit, wie Forscher diese Prinzipien entdecken konnten. Dies ist wichtig, da Krebs nicht im Vakuum entsteht – er ist stark von seiner Mikroumgebung abhängig, um zu wachsen und sich zu erhalten. Die Wissenschaftler mussten außerdem nicht nur das Verhalten einzelner Zellen, sondern auch der Moleküle in diesen Zellen verfolgen.
„Bei unserem Ansatz zum Verständnis dieser onkogenen Ereignisse geht es wirklich darum, Verbindungen über verschiedene Maßstäbe hinweg herzustellen“, sagte Greco. „Der Rahmen und die Ansätze, die Dr. Xin in Zusammenarbeit mit Dr. Regot verwendet hat, haben es uns ermöglicht, zu den molekularen Elementen vorzudringen und sie mit der Zell- und Gewebeebene zu verknüpfen. Dadurch erhalten wir eine Auflösung dieser Ereignisse, die außerhalb des lebenden Organismus so schwer zu erreichen ist.“
Die Forscher möchten den Prozess nun über einen längeren Zeitraum verfolgen, um zu sehen, was passiert, nachdem sich die erste Beule gebildet hat. Sie möchten auch andere onkogene Ereignisse wie Entzündungen untersuchen, um zu sehen, ob die von ihnen entdeckten Prinzipien auch in anderen Zusammenhängen anwendbar sind.
