Medikament LM11A-31 verlangsamt in Studie das Fortschreiten der Alzheimer-Krankheit
Zuletzt überprüft: 14.06.2024

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.

In einer kürzlich in Nature Medicine veröffentlichten Studie führten Forscher eine randomisierte, doppelblinde, placebokontrollierte Phase-2a-Studie durch, um die Sicherheit und Wirksamkeit von LM11A-31 bei der Behandlung der Alzheimer-Krankheit (AD) durch Modulation des p75-Neurotrophin-Rezeptors (p75NTR) zu untersuchen.
Die spät einsetzende Alzheimer-Krankheit ist die häufigste Form der Demenz und ist durch synaptische Störungen, Degeneration und Verlust von Nervenzellen gekennzeichnet. Obwohl die beiden wichtigsten Medikamente zur Behandlung von Alzheimer auf die Ansammlung von abnormalem Amyloid-β oder Tau-Protein abzielen, greifen sie nur einen Teil der Pathophysiologie an. Ein anderer Ansatz besteht darin, Rezeptoren und Signalnetzwerke anzugreifen, die grundlegende biologische Wege beeinflussen. Präklinische Studien zeigen, dass die Modulation von p75NTR mit dem neuen kleinen Molekül LM11A-31 den durch Amyloid und pathologisches Tau verursachten synaptischen Verlust verringert.
Beschreibung der Studie
In dieser randomisierten klinischen Studie untersuchten Forscher, ob LM11A-31 das Fortschreiten der Alzheimer-Krankheit durch Modulation von p75NTR beim Menschen verlangsamen könnte.
Den Studienteilnehmern wurden 242 Patienten mit leichtem bis mittelschwerem Asthma 26 Wochen lang orale Kapseln mit LM11A-31 in Dosen von 200 mg und 400 mg oder Placebo im Verhältnis 1:1:1 verabreicht. Bei den Teilnehmern war eine biologisch bestätigte Alzheimer-Krankheit (Amyloid-β-Protein-42-Spiegel (Aβ42) in der Zerebrospinalflüssigkeit unter 550 ng/l oder Aβ42:β40-Verhältnis unter 0,89) festgestellt worden. Die Diagnose erfolgte nach den McKhann-Kriterien. Die Teilnehmer hatten einen Mini Psychiatric SE (MMSE)-Score von 18 bis 26, einen Geriatric Depression Scale (GDS)-Score von unter 5,0, einen modifizierten Hacinski Ischemic Scale (HIS)-Score von ≤ 4,0, eine formale Schulbildung von ≥ 8 Jahren und einen früheren kognitiven Abbau von ≥ 6 Monaten.
Teilnehmer, die teilnahmeberechtigt waren, hatten ≥ 3 Monate vor Studienbeginn Acetylcholinesterasehemmer (AChEIs) oder partielle NMDA-Rezeptorantagonisten eingenommen. Sie nahmen keine illegalen Drogen wie Antipsychotika, Benzodiazepine, Antiepileptika, Sedativa, zentral wirksame Antihypertensiva, Nootropika (außer Ginkgo biloba) oder Analgetika mit Opioiden ein.
Das primäre Ergebnis der Studie war die Arzneimittelsicherheit und -verträglichkeit, die anhand der Columbia Suicidal Ideation and Behavior Severity Rating Scale (C-SSRS), Vitalzeichen, Blutdruck und hämatologischen Parametern bewertet wurde. Strukturelle Magnetresonanztomographie (sMRI), Fluorodesoxyglucose-Positronen-Emissions-Tomographie (FDG-PET) und Biomarker in der Zerebrospinalflüssigkeit (CSF) wurden verwendet, um sekundäre kognitive Ergebnisse zu bewerten. Zu den AD-Indikatoren gehörten an Thr181 phosphoryliertes Tau, Gesamt-Tau-Protein, Aβ40, Aβ42 und AChE-Aktivität. Das Team verwendete einen individualisierten neuropsychologischen Test, um sekundäre kognitive Ergebnisse zu Beginn sowie in den Wochen 12 und 26 zu bewerten.
Forschungsergebnisse
Die Studie ergab, dass LM11A-31 sicher und gut verträglich war und keine wesentlichen Sicherheitsbedenken aufwies. Die häufigsten Nebenwirkungen waren Kopfschmerzen, Durchfall, Eosinophilie und Nasopharyngitis, wobei Magen-Darm-Probleme und Eosinophilie die Hauptgründe für das Absetzen des Medikaments waren. Es gab mehr Abbrüche in der 400-mg-Gruppe als in der 200-mg- und Placebo-Gruppe. Die MRT ergab keine Bedenken hinsichtlich der Arzneimittelsicherheit, einschließlich amyloidbedingter Anomalien. Es gab keine signifikanten Unterschiede bei den kognitiven Werten oder Amyloidanomalien zwischen den beiden Behandlungsgruppen.
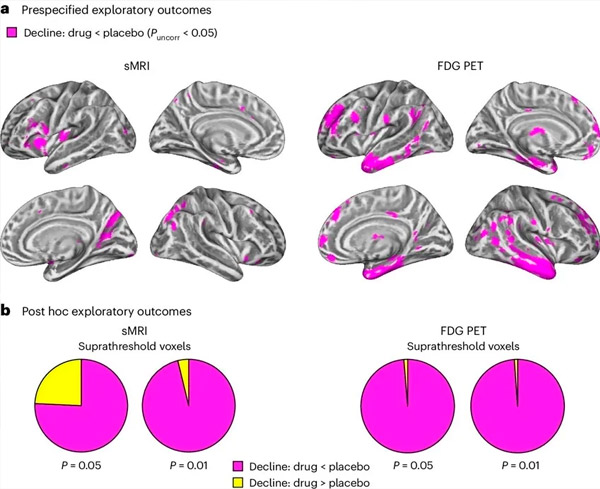
A. Kovarianzanalysen mit zwei Faktoren gemischter Modelle untersuchten Wechselwirkungen zwischen Behandlung (Medikament oder Placebo) und Zeit (vor oder nach der Behandlung). Ein einseitiger T-Kontrast zur Prüfung der Interaktionshypothese (Medikament verlangsamt Progression im Vergleich zu Placebo) zeigte, dass die Behandlung mit LM11A-31 die longitudinale Degeneration (linke Tafeln) und den Glukosehypometabolismus (rechte Tafeln) in der medikamentenbehandelten Gruppe (cMRI, n = 127; PET, n = 121) im Vergleich zur Placebogruppe (sMRI, n = 66; PET, n = 62) verlangsamte. Voxel, die diese Interaktion zeigen, werden am unkorrigierten Schwellenwert P < 0,05 (magentafarben) auf einer populationsspezifischen kortikalen Oberfläche angezeigt. Die linke und rechte Hemisphäre werden jeweils in der oberen und unteren Reihe angezeigt. Hirnregionen, die Interaktionen zeigen, die nicht mit der Hypothese übereinstimmen, werden in Abbildung 7 in den ergänzenden Daten angezeigt.
b. Gesamtzahl der Voxel in vorab definierten anfälligen AD-Gehirnregionen (Gesamtfläche der Kreisdiagramme), die entweder eine hypothesenkonsistente Interaktion (magenta) oder eine hypotheseninkonsistente Interaktion (gelb) in jeder der Bildgebungsmodalitäten (cMRI, linkes Feld; FDG-PET, rechtes Feld) bei zunehmend liberalen, nicht angepassten P-Schwellenwerten < 0,01 und P < 0,05 zeigen. Monte-Carlo-Simulationen zeigten, dass die Verhältnisse der Voxel, die Effekte zeigten, die mit der Hypothese übereinstimmten, gegenüber denen, die nicht mit der Hypothese übereinstimmten, signifikant höher waren als die aus zufällig generierten Daten für cMRI und PET (P < 0,001 für jede Methode; zweiseitiger Test).
LM11A-31 reduzierte effektiv den Anstieg von Aβ42 und Aβ40 in der Zerebrospinalflüssigkeit im Vergleich zur Placebogruppe. Das Medikament zeigte auch eine Abnahme der mittleren jährlichen prozentualen Veränderung des präsynaptischen Proteinbiomarkers SNAP25 und eine Abnahme des postsynaptischen Biomarkers NG, was auf eine Verlangsamung des Verlusts präsynaptischer und postsynaptischer Verbindungen hindeutet. LM11A-31 reduzierte auch das YKL40-Wachstum, was zu niedrigeren MMSE-Werten und höheren ADAS-Cog-13-Werten führte. Das Medikament reduzierte auch den Verlust grauer Substanz im Frontallappen und im hinteren parietalen Kortex und verringerte den Glukosestoffwechsel in Bereichen wie dem entorhinalen Kortex, dem temporalen Kortex, dem Hippocampus, dem Inselkortex und dem präfrontalen Kortex.
Fazit
Die Studie kam zu dem Schluss, dass die Modulation von p75NTR durch LM11A-31 für größere klinische Studien geeignet ist. LM11A-31 erfüllte das primäre Sicherheitskriterium und wurde von Patienten mit leichten bis schweren Formen von Asthma gut vertragen. Die Ergebnisse zeigen, dass weitere Studien mit längeren Behandlungsdauern erforderlich sind, um die Machbarkeit der Verwendung kleiner Moleküle zur Regulierung von p75NTR als krankheitsmodifizierende Therapie bei AD zu bewerten. Die Studie ergab, dass LM11A-31 mehrere Biomarker, darunter Aβ40, Aβ42, SNAP25, NG und YKL40, signifikant beeinflusste, was auf eine Abschwächung der pathologischen Entwicklung hindeutet. Zukünftige Studien könnten weitere Indikatoren für die Gesundheit der Gliazellen untersuchen.
