Neue Veröffentlichungen
ARID1A-Genmutation macht Tumore empfindlich für Immuntherapie
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.
Die Immuntherapie hat die Krebsbehandlung in den letzten Jahren revolutioniert. Anstatt Tumore direkt anzugreifen, lenkt die Immuntherapie das Immunsystem der Patienten, um Tumore effektiver anzugreifen. Dies ist besonders wirksam bei einigen schwer behandelbaren Krebsarten. Allerdings spricht weniger als die Hälfte aller Krebspatienten auf aktuelle Immuntherapien an. Daher besteht dringender Bedarf an der Identifizierung von Biomarkern, die vorhersagen können, welche Patienten am wahrscheinlichsten von der Behandlung profitieren.
Kürzlich haben Wissenschaftler festgestellt, dass Patienten, deren Tumoren eine Mutation im ARID1A-Gen aufweisen, eher positiv auf eine Immun-Checkpoint-Blockade reagieren, eine Art Immuntherapie, die funktioniert, indem sie krebsbekämpfende Immunzellen aktiviert hält.
Da die ARID1A-Genmutation bei vielen Krebsarten vorkommt, darunter bei Gebärmutterkrebs, Eierstockkrebs, Dickdarmkrebs, Magenkrebs, Leberkrebs und Bauchspeicheldrüsenkrebs, fragten sich die Forscher des Salk Institute, wie sie zur Behandlungsempfindlichkeit beitragen könnte und wie Ärzte diese Informationen nutzen könnten, um die Krebsbehandlung für jeden Patienten individuell anzupassen.
Ihre neue, in der Fachzeitschrift Cell veröffentlichte Studie zeigt, dass die ARID1A-Mutation Tumore empfindlich gegenüber einer Immuntherapie macht, indem sie durch eine antivirale Immunreaktion krebsbekämpfende Immunzellen zum Tumor rekrutiert.
Die Forscher vermuten, dass diese Mutation und die antivirale Immunantwort als Biomarker genutzt werden könnten, um Patienten für spezifische Immuntherapien, wie beispielsweise die Immun-Checkpoint-Blockade, besser auszuwählen. Diese Erkenntnisse fördern zudem die Entwicklung von Medikamenten, die auf ARID1A und verwandte Proteine abzielen, um andere Tumore empfindlicher für Immuntherapien zu machen.
„Dies könnte den Erfolg der Krebsbehandlung für Patienten deutlich verbessern“, sagte Associate Professor Diana Hargreaves, leitende Autorin der Studie. „Patienten mit der ARID1A-Mutation haben bereits eine Immunreaktion. Wir müssen diese Reaktion nur noch durch eine Immun-Checkpoint-Blockade verstärken, um ihnen zu helfen, ihre Tumore von innen heraus zu zerstören.“
Obwohl bekannt war, dass Menschen mit ARID1A-Mutationen gut auf eine Immun-Checkpoint-Blockade reagierten, blieb der genaue Zusammenhang zwischen beiden unklar. Um den Mechanismus zu beleuchten, verwendeten Wissenschaftler des Salk Institute Mausmodelle von Melanomen und Dickdarmkrebs, die sowohl die ARID1A-Mutation als auch funktionelles ARID1A aufwiesen.
Quelle: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Das Team beobachtete eine robuste Immunreaktion in allen Modellen mit der ARID1A-Mutation, jedoch nicht in denen mit funktionsfähigem ARID1A. Dies stützt die Annahme, dass die ARID1A-Mutation tatsächlich diese Reaktion auslöst. Doch wie funktioniert dies auf molekularer Ebene?
„Wir haben festgestellt, dass ARID1A im Zellkern eine wichtige Rolle spielt, indem es die korrekte DNA-Organisation aufrechterhält“, sagt Matthew Maxwell, Erstautor der Studie und Doktorand im Hargreaves-Labor. „Ohne funktionsfähiges ARID1A kann freie DNA herausgeschnitten und ins Zytosol freigesetzt werden, was eine erwünschte antivirale Immunantwort auslöst, die durch eine Blockade von Immun-Checkpoints verstärkt werden kann.“
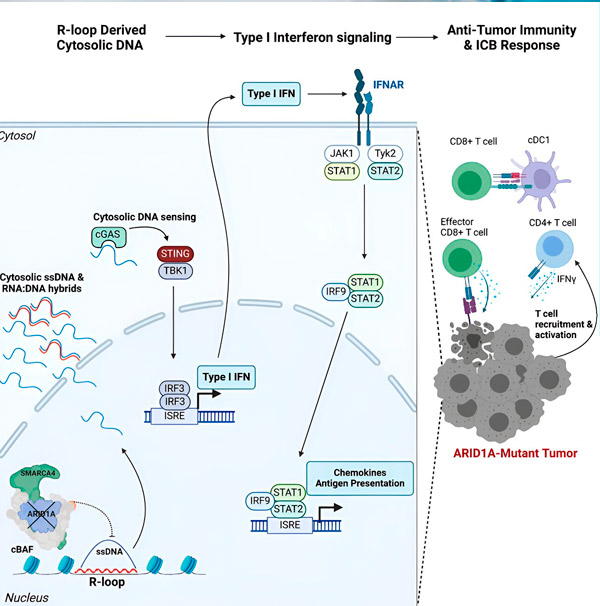
Das ARID1A-Gen kodiert ein Protein, das die Form unserer DNA reguliert und die Genomstabilität aufrechterhält. Mutationen in ARID1A lösen in Krebszellen eine Rube-Goldberg-ähnliche Ereigniskette aus.
Erstens führt der Mangel an funktionellem ARID1A zur Freisetzung von DNA ins Zytosol. Die zytosolische DNA aktiviert daraufhin ein antivirales Alarmsystem, den cGAS-STING-Signalweg, da unsere Zellen darauf eingestellt sind, jegliche DNA im Zytosol als fremd zu markieren, um sich vor Virusinfektionen zu schützen. Schließlich veranlasst der cGAS-STING-Signalweg das Immunsystem, T-Zellen zum Tumor zu rekrutieren und sie zu spezialisierten Krebskiller-T-Zellen zu aktivieren.
Jeder Schritt dieser Ereigniskette – ARID1A-Mutation, DNA-Entweichung, cGAS-STING-Alarm, T-Zell-Rekrutierung – führt, abhängig vom vorherigen, zu einer Zunahme der Anzahl krebsbekämpfender T-Zellen im Tumor. Eine Immun-Checkpoint-Blockade kann dann dazu beitragen, dass diese T-Zellen aktiviert bleiben und so ihre Fähigkeit zur Krebsbekämpfung verbessern.
„Unsere Ergebnisse liefern einen neuen molekularen Mechanismus, durch den eine ARID1A-Mutation zu einer Anti-Tumor-Immunreaktion beitragen kann“, sagt Hargreaves. „Das Spannende an diesen Erkenntnissen ist ihr translationales Potenzial. Wir können ARID1A-Mutationen nutzen, um Patienten für eine Immun-Checkpoint-Blockade auszuwählen, und wir erkennen nun einen Mechanismus, durch den Medikamente, die ARID1A oder seinen Proteinkomplex hemmen, die Immuntherapie bei anderen Patienten weiter verbessern könnten.“
Durch die Beschreibung des Mechanismus, durch den die Immun-Checkpoint-Blockade bei ARID1A-mutierten Krebsarten wirksamer ist, liefern die Forscher Klinikern eine Begründung für die Priorisierung dieser Immuntherapie bei Patienten mit einer ARID1A-Mutation. Diese Erkenntnisse sind ein wichtiger Schritt zur personalisierten Krebsbehandlung und inspirieren die Entwicklung neuer Therapien, die auf ARID1A und seinen Proteinkomplex abzielen.
Das Team des Salk Institute hofft, dass seine Erkenntnisse künftig zu einer Verbesserung der Behandlungsergebnisse bei Patienten mit verschiedenen Krebsarten führen werden, die mit ARID1A-Mutationen in Zusammenhang stehen. Es beabsichtigt, diese klinische Umsetzung in Zusammenarbeit mit der University of California, San Diego, zu erforschen.
