Neue Veröffentlichungen
LM11A-31 verlangsamt in Studie das Fortschreiten der Alzheimer-Krankheit
Zuletzt überprüft: 02.07.2025

Alle iLive-Inhalte werden medizinisch überprüft oder auf ihre Richtigkeit überprüft.
Wir haben strenge Beschaffungsrichtlinien und verlinken nur zu seriösen Medienseiten, akademischen Forschungseinrichtungen und, wenn möglich, medizinisch begutachteten Studien. Beachten Sie, dass die Zahlen in Klammern ([1], [2] usw.) anklickbare Links zu diesen Studien sind.
Wenn Sie der Meinung sind, dass einer unserer Inhalte ungenau, veraltet oder auf andere Weise bedenklich ist, wählen Sie ihn aus und drücken Sie Strg + Eingabe.

In einer kürzlich in der Fachzeitschrift Nature Medicine veröffentlichten Studie führten Wissenschaftler eine randomisierte, doppelblinde, placebokontrollierte Phase-2a-Studie durch, um die Sicherheit und Wirksamkeit von LM11A-31 bei der Behandlung der Alzheimer-Krankheit (AD) durch Modulation des p75-Neurotrophin-Rezeptors (p75NTR) zu untersuchen.
Die spät einsetzende Alzheimer-Krankheit ist die häufigste Form der Demenz und zeichnet sich durch synaptische Störungen, Degeneration und Verlust von Nervenzellen aus. Obwohl die beiden führenden Medikamente zur Behandlung von Alzheimer die Ansammlung abnormaler Amyloid-β- oder Tau-Proteine angreifen, adressieren sie nur einen Teil der Pathophysiologie. Ein anderer Ansatz zielt auf Rezeptoren und Signalnetzwerke ab, die grundlegende biologische Prozesse beeinflussen. Präklinische Studien zeigen, dass die Modulation von p75NTR mit einem neuartigen kleinen chemischen Molekül, LM11A-31, den durch Amyloid und abnormales Tau verursachten synaptischen Verlust reduziert.
Beschreibung der Studie
In dieser randomisierten klinischen Studie untersuchten die Forscher, ob LM11A-31 das Fortschreiten der Alzheimer-Krankheit durch Modulation von p75NTR beim Menschen verlangsamen könnte.
Die Studienteilnehmer erhielten 242 Patienten mit leichtem bis mittelschwerem Asthma 26 Wochen lang orale Kapseln LM11A-31 in Dosen von 200 mg und 400 mg oder ein Placebo im Verhältnis 1:1:1. Bei den Teilnehmern lag eine biologisch bestätigte Alzheimer-Krankheit vor (Amyloid-β-Protein-42-Spiegel (Aβ42) im Liquor unter 550 ng/l oder ein Aβ42:β40-Verhältnis unter 0,89), die gemäß den McKhann-Kriterien diagnostiziert worden war, mit Werten der Mini-Psychiatric Examination (MMSE) von 18 bis 26, Werten auf der Geriatric Depression Scale (GDS) unter 5,0, Werten auf der modifizierten Hachinski Ischemic Scale (HIS) ≤ 4,0, einer formalen Ausbildung von ≥ 8 Jahren und einem vorangegangenen kognitiven Abbau von ≥ 6 Monaten.
Die teilnahmeberechtigten Teilnehmer hatten mindestens drei Monate vor Studienbeginn Acetylcholinesterasehemmer (AChEI) oder partielle NMDA-Rezeptorantagonisten eingenommen. Sie nahmen keine illegalen Drogen wie Antipsychotika, Benzodiazepine, Antiepileptika, Sedativa, zentral wirksame Antihypertensiva, Nootropika (außer Ginkgo biloba) oder opioidhaltige Analgetika ein.
Das primäre Ergebnis der Studie war Sicherheit und Verträglichkeit, bewertet anhand der Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), Vitalparametern, Blutdruck und hämatologischen Parametern. Strukturelle Magnetresonanztomographie (cMRI), Fluorodesoxyglucose-Positronen-Emissions-Tomographie (FDG-PET) und Biomarker im Liquor cerebrospinalis (CSF) wurden zur Bewertung sekundärer kognitiver Ergebnisse eingesetzt. Zu den AD-Messungen gehörten Thr181-phosphoryliertes Tau, Gesamt-Tau-Protein, Aβ40, Aβ42 und AChE-Aktivität. Das Team verwendete einen maßgeschneiderten neuropsychologischen Test, um sekundäre kognitive Ergebnisse zu Studienbeginn sowie in den Wochen 12 und 26 zu bewerten.
Forschungsergebnisse
Die Studie ergab, dass LM11A-31 sicher und gut verträglich ist und keine nennenswerten Sicherheitsbedenken aufwies. Zu den häufigsten Nebenwirkungen zählten Kopfschmerzen, Durchfall, Eosinophilie und Nasopharyngitis, wobei Magen-Darm-Probleme und Eosinophilie die Hauptgründe für den Abbruch der Behandlung waren. In der 400-mg-Gruppe kam es häufiger zu Abbrüchen als in der 200-mg- und Placebo-Gruppe. Die MRT ergab keine Sicherheitsbedenken, auch keine Amyloid-bedingten Anomalien. Es gab keine signifikanten Unterschiede in den kognitiven Werten oder Amyloid-Anomalien zwischen den beiden Behandlungsgruppen.
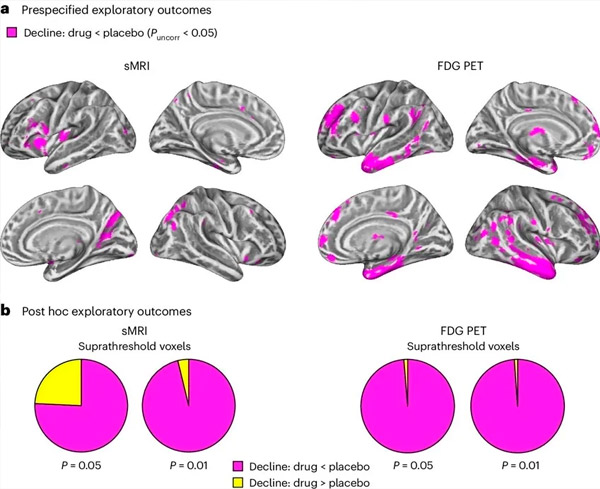
A. Eine zweiseitige Kovarianzanalyse mit gemischten Modellen untersuchte die Wechselwirkungen zwischen Behandlung (Medikament oder Placebo) und Zeit (vor oder nach der Behandlung). Eine einseitige T-Kontraststudie zur Prüfung der Wechselwirkungshypothese (Medikament verlangsamt Fortschreiten im Vergleich zu Placebo) zeigte, dass die Behandlung mit LM11A-31 die Längsdegeneration (linke Tafeln) und den Glukosehypometabolismus (rechte Tafeln) in der Medikamentengruppe (cMRI, n = 127; PET, n = 121) im Vergleich zur Placebogruppe (cMRI, n = 66; PET, n = 62) verlangsamte. Voxel, die diese Wechselwirkung zeigen, werden bei einem unkorrigierten Schwellenwert von P < 0,05 (magenta) auf einer populationsspezifischen kortikalen Oberfläche dargestellt. Die linke und rechte Hemisphäre werden jeweils in der oberen und unteren Reihe dargestellt. Hirnregionen, die Wechselwirkungen zeigen, die nicht mit der Hypothese übereinstimmen, sind in Abbildung 7 in den ergänzenden Daten dargestellt.
B. Gesamtzahl der Voxel in vordefinierten, anfälligen AD-Hirnregionen (Gesamtfläche der Kreisdiagramme), die entweder eine mit der Hypothese übereinstimmende Interaktion (magenta) oder eine mit der Hypothese nicht übereinstimmende Interaktion (gelb) in jeder Bildgebungsmodalität (cMRI, linkes Feld; FDG-PET, rechtes Feld) bei zunehmend liberaleren Schwellenwerten von unkorrigiertem P < 0,01 und P < 0,05 zeigen. Monte-Carlo-Simulationen zeigten, dass die Verhältnisse der Voxel, die Effekte im Einklang mit der Hypothese zeigten, gegenüber denen, die mit der Hypothese nicht übereinstimmten, signifikant höher waren als die auf der Grundlage zufällig generierter Daten für cMRI und PET beobachteten (P < 0,001 für jede Modalität; zweiseitiger Test).
LM11A-31 reduzierte effektiv den Anstieg von Aβ42 und Aβ40 im Liquor im Vergleich zur Placebogruppe. Das Medikament zeigte außerdem eine Verringerung der medianen jährlichen prozentualen Veränderung des präsynaptischen Proteinbiomarkers SNAP25 und eine Abnahme des postsynaptischen Biomarkers NG, was auf eine Verlangsamung des Verlusts präsynaptischer und postsynaptischer Verbindungen hindeutet. LM11A-31 reduzierte zudem den Anstieg von YKL40, was zu einer Verringerung der MMSE-Werte und einer Erhöhung der ADAS-Cog-13-Werte führte. Das Medikament reduzierte zudem den Verlust grauer Substanz im Frontallappen und im posterioren parietalen Kortex sowie eine Verringerung des Glukosestoffwechsels in Bereichen wie dem entorhinalen Kortex, dem temporalen Kortex, dem Hippocampus, dem Inselkortex und dem präfrontalen Kortex.
Abschluss
Die Studie kam zu dem Schluss, dass die Modulation von p75NTR durch LM11A-31 für größere klinische Studien geeignet ist. LM11A-31 erreichte den primären Sicherheitsendpunkt und wurde von Patienten mit leichter bis schwerer Alzheimer-Krankheit gut vertragen. Die Ergebnisse zeigen, dass weitere Studien mit längeren Behandlungsdauern erforderlich sind, um das Potenzial kleiner Moleküle zur Regulierung von p75NTR als krankheitsmodifizierende Therapie bei Alzheimer zu untersuchen. Die Studie zeigte, dass LM11A-31 mehrere Biomarker, darunter Aβ40, Aβ42, SNAP25, NG und YKL40, signifikant beeinflusste, was auf eine Verlangsamung des Krankheitsverlaufs hindeutet. Zukünftige Studien könnten zusätzliche Indikatoren für die Gesundheit der Gliazellen untersuchen.
